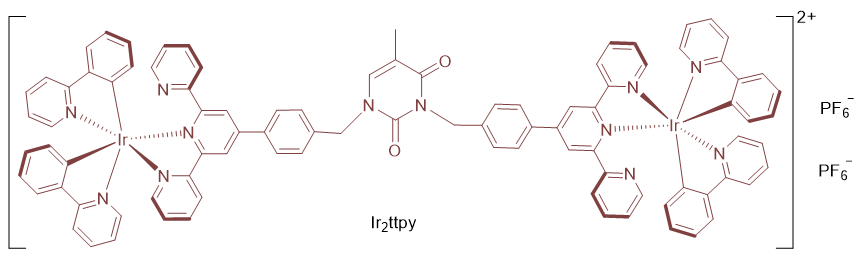
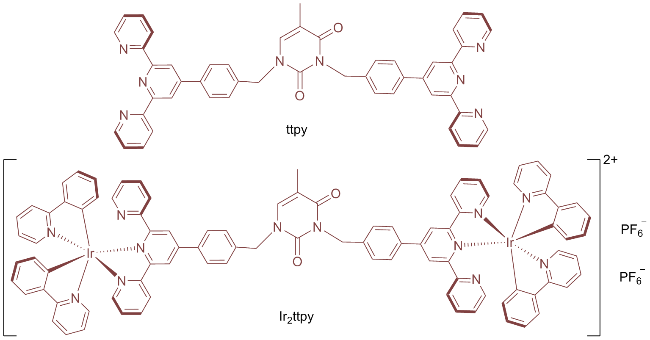
1 引言
2 结果与讨论
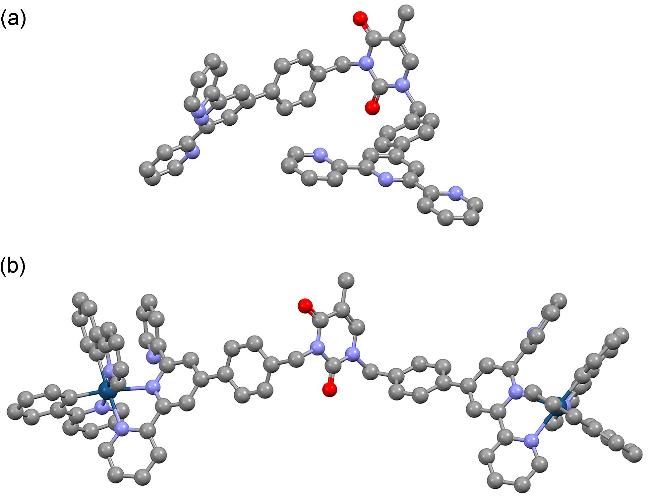
2.1 合成与结构表征
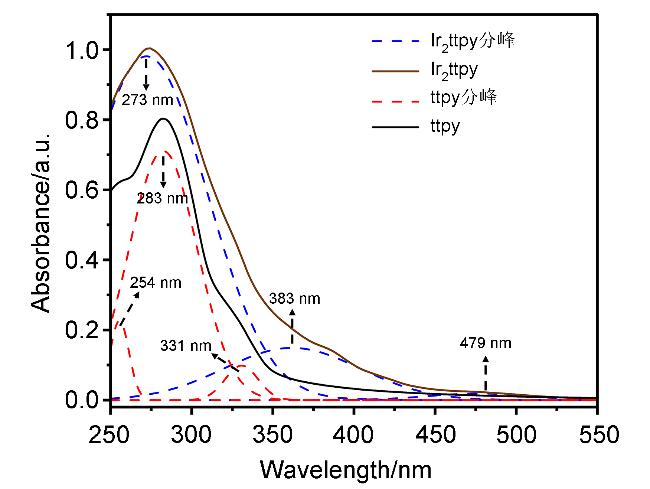
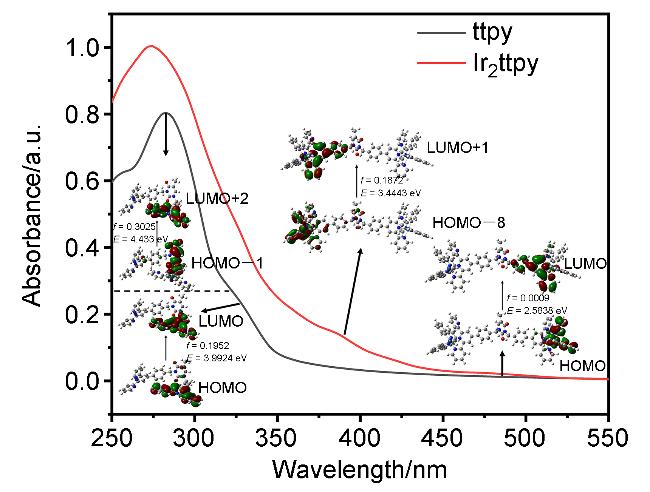
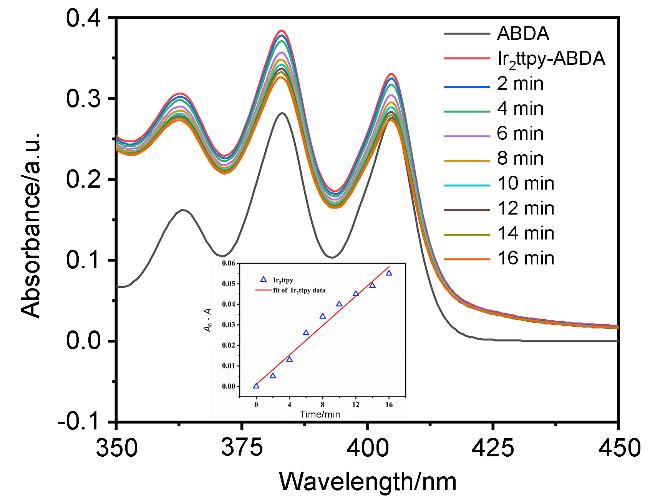
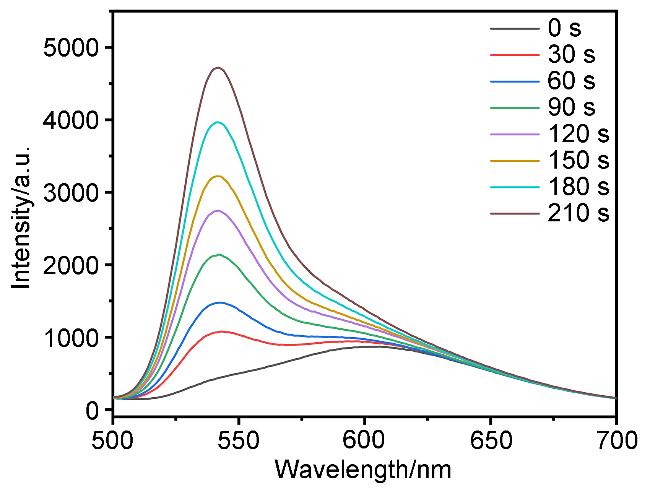
2.2 配体及铱配合物的单光子吸收与发射性能
图4 配体ttpy与配合物Ir2ttpy的紫外-可见吸收光谱指认结果(通过TD-DFT计算得到ttpy和Ir2ttpy优化几何结构的分子轨道. 使用TD-B3LYP方法和6-31G(d)基组计算跃迁能, 单位为eV)Figure 4 Assignment for the UV-vis spectra of ligand ttpy and complex Ir2ttpy (Molecular orbitals for ttpy and Ir2ttpy were optimized from TD-DFT calculations. Transition energies were calculated using the TD-B3LYP method with 6-31G(d) basis sets, eV) |
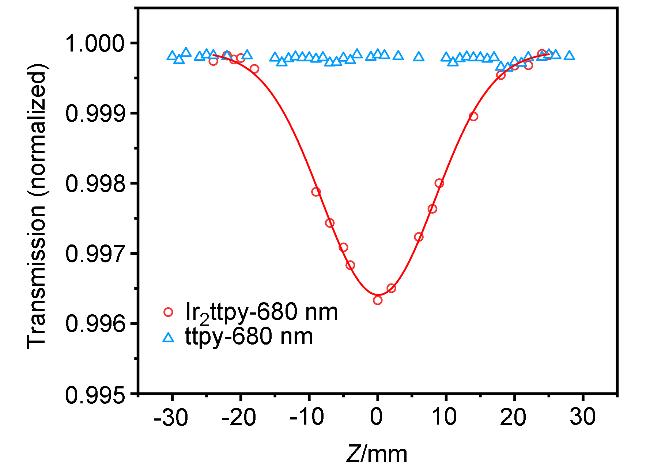
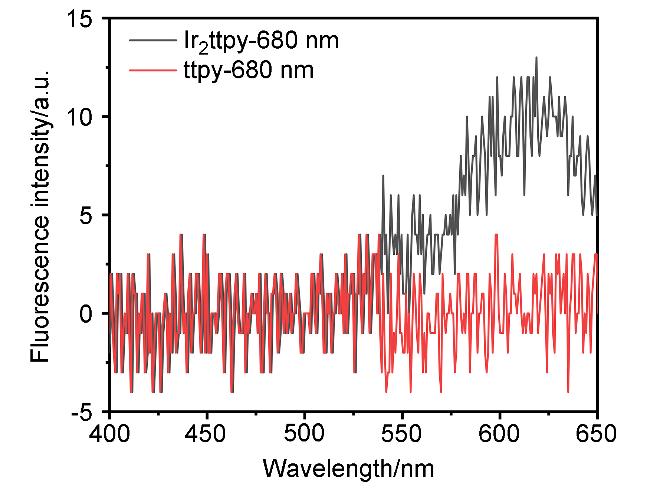
2.3 配体及铱配合物的双光子吸收与发射性能
图6 配体ttpy与配合物Ir2ttpy在680 nm飞秒激光激发下的开孔Z-扫描结果及高斯拟合曲线(实线)Figure 6 Open-aperture Z-scan experimental data and fitting curve for complex Ir2ttpy under a 680 nm femtosecond laser beam |
2.4 铱配合物的抗肿瘤活性
2.5 铱配合物的细胞内定位
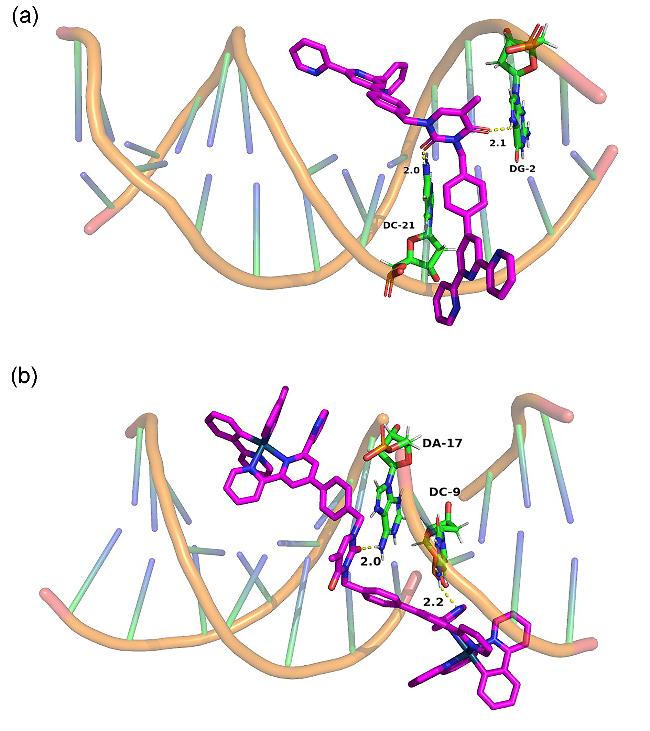
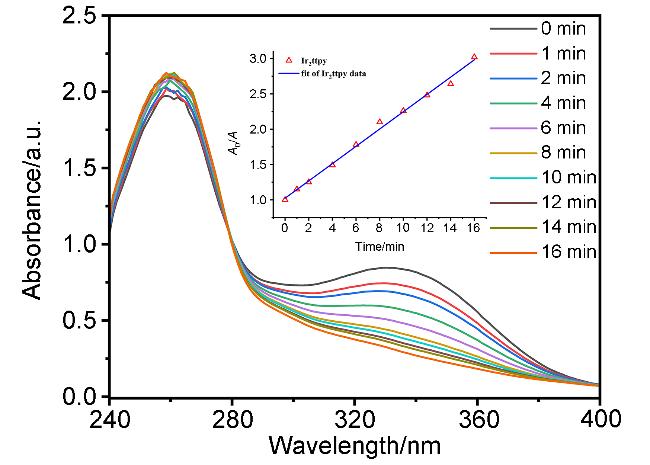
2.6 配体及铱配合物的DNA结合性能
图8 ttpy (a)和Ir2ttpy (b)的紫外可见吸收光谱随DNA浓度递加的变化图(化合物的浓度为2.0×10-5 mol/L, 缓冲溶液组成: 5 mmol/L tris, 50 mmol/L NaCl, pH=7.42, r=[CT-DNA]/[ttpy or Ir2ttpy]=0~1.0.)Figure 8 UV absorption spectra of ttpy (a) and Ir2ttpy (b) solution with increasing concentration of CT-DNA [buffer=5 mmol/L tris, 50 mmol/L NaCl, pH=7.42. The concentration of ttpy (or Ir2ttpy) is 2.0×10-5 mol/L, r=[CT-DNA]/[ttpy/or Ir2ttpy]=0~1.0] |