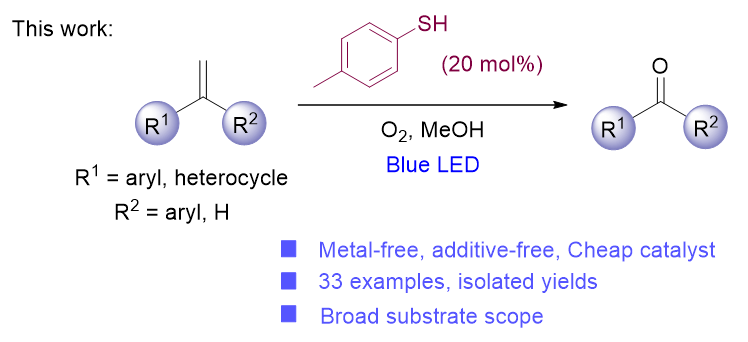
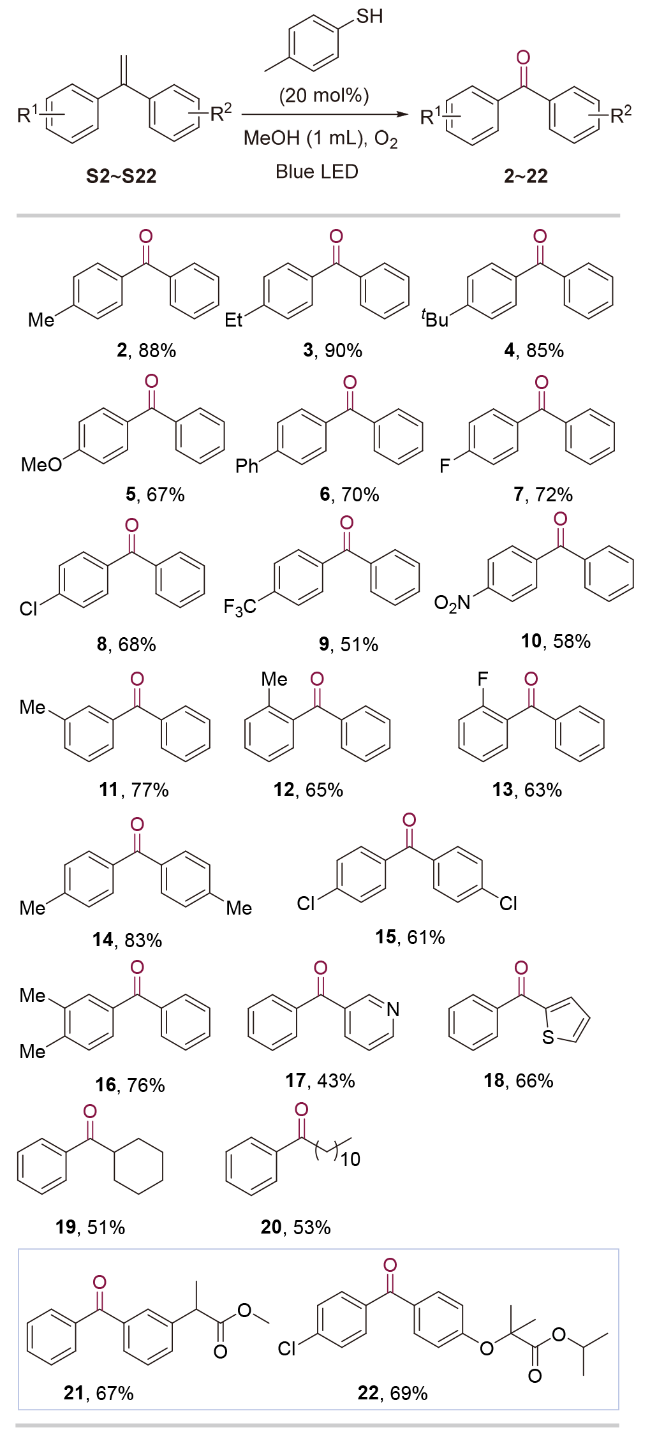
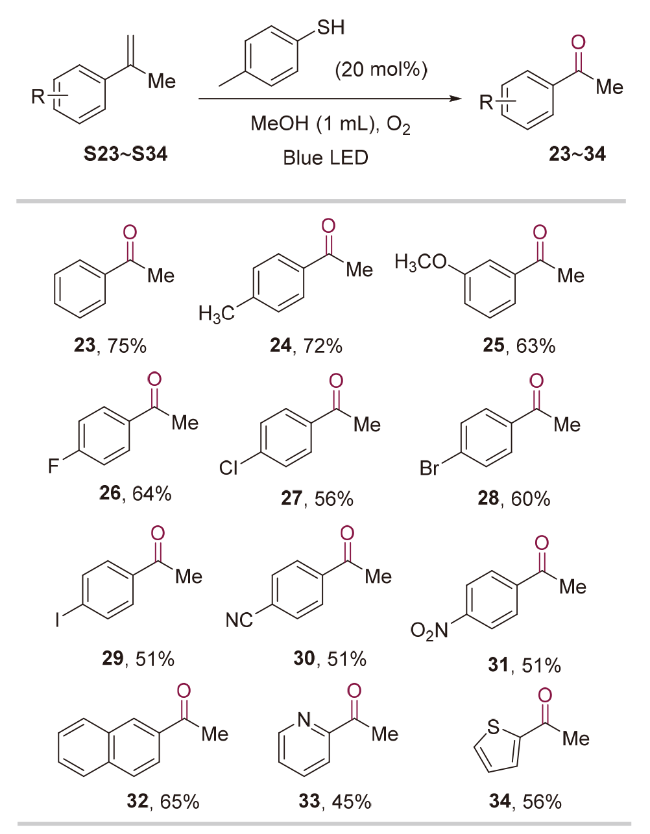
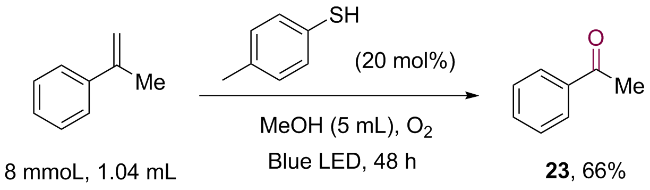
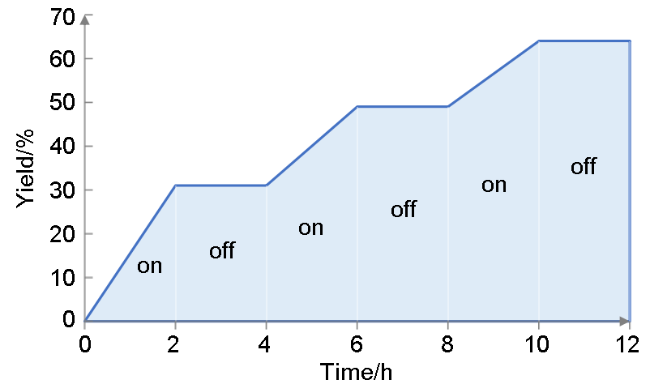
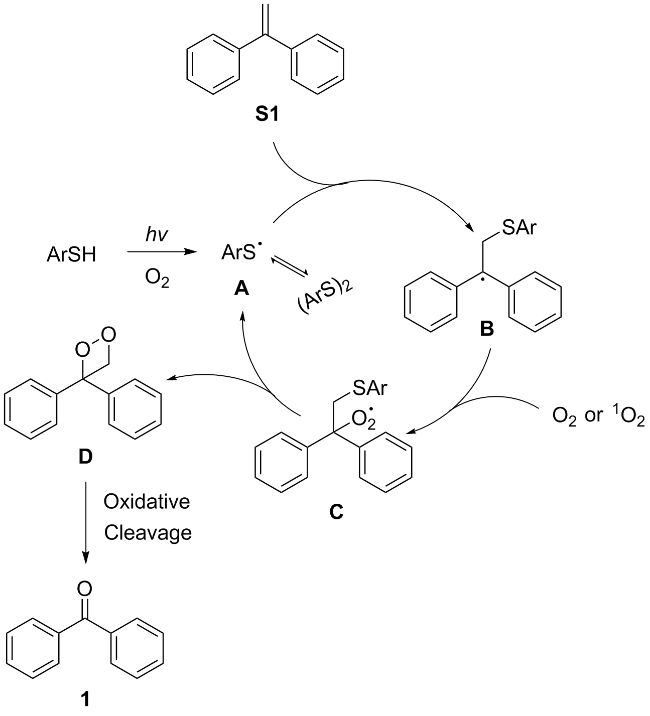
1 引言
2 结果与讨论
2.1 反应条件优化
表1 实验条件的优化Table 1 Optimization of reaction conditionsa |
| Entry | Photocatalyst | Solvent | Yieldb/% |
|---|---|---|---|
| 1 | [Mes-Acr+-Me$ClO_{4}^{-}$] | CH3CN | 20 |
| 2 | Ethidium bromide | CH3CN | 26 |
| 3 | 2,4,6-Triphenylpyrylium Tetrafluoroborate | CH3CN | 18 |
| 4 | Eosin B | CH3CN | 21 |
| 5 | Eosin YS | CH3CN | 18 |
| 6 | Rhodamine B | CH3CN | 19 |
| 7 | p-toluenethiol | CH3CN | 46 |
| 8 | p-toluenethiol | H2O | 32 |
| 9 | p-toluenethiol | DMAc | 39 |
| 10 | p-toluenethiol | DMSO | 45 |
| 11 | p-toluenethiol | DCE | 53 |
| 12 | p-toluenethiol | THF | 43 |
| 13 | p-toluenethiol | 1,4-Dioxane | 51 |
| 14 | p-toluenethiol | IPA | 60 |
| 15 | p-toluenethiol | EtOH | 54 |
| 16 | p-toluenethiol | MeOH | 63 |
| 17c | p-toluenethiol | MeOH | 85 |
a Reaction conditions: 1,1-diphenylethylene (0.2 mmol, 35 μL), photocatalysts (20 mol%), solvents (1 mL), air, 30 W blue LED, r.t., 12 h. b Isolated yields. c O2. |