1 引言
2 结果与讨论
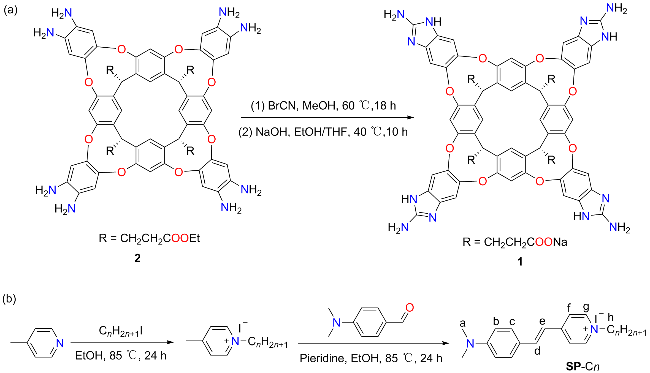
2.1 合成与结构
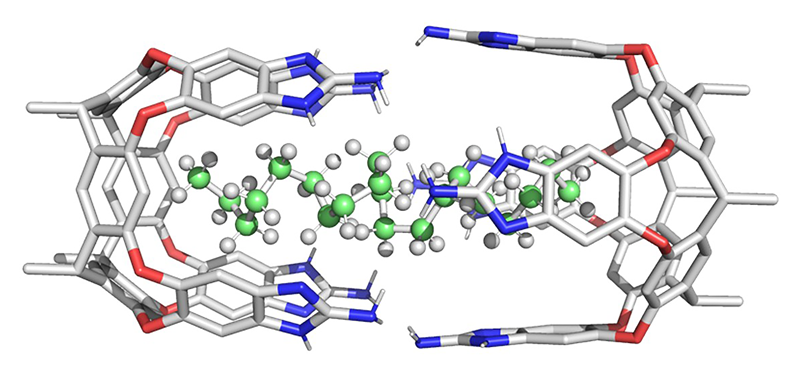
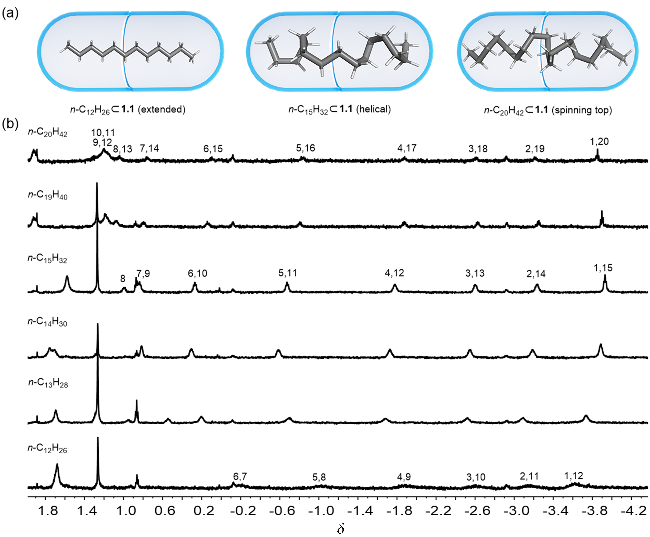
2.2 对称型直链烷烃
2.3 非对称型直链烷基苯乙烯类半菁染料分子SP-Cn
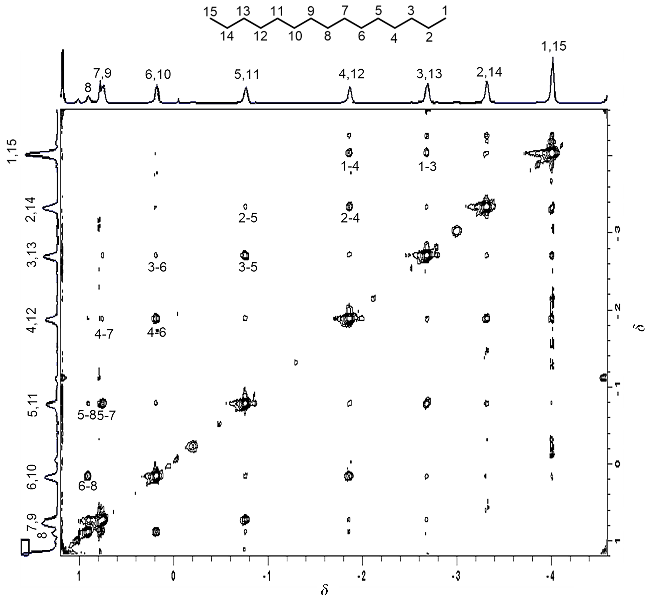
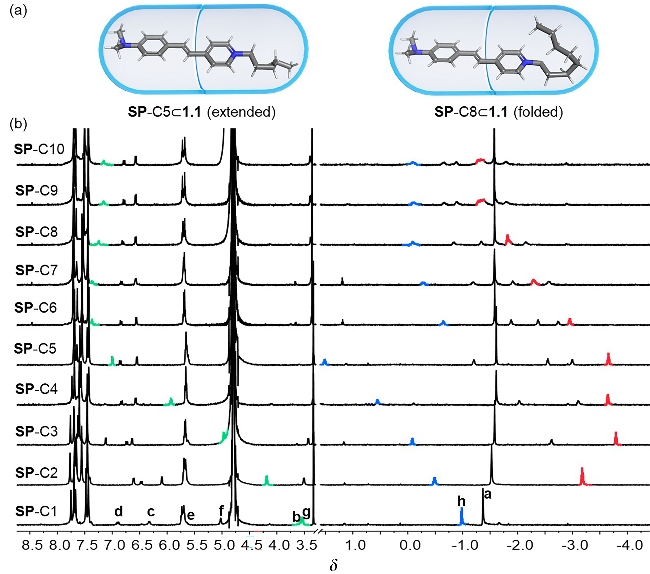
图3 (a) SP-C5和SP-C8在胶囊1.1中的构象示意图; (b) SP-Cn (n=1~10)在胶囊1.1中的部分1H NMR谱图(600 MHz, D2O, 298 K), 红色为烷基链上甲基Figure 3 (a) Conformational schematic illustration of SP-C5 and SP-C8 in Capsule 1.1; (b) Partial 1H NMR spectra of SP-Cn (n=1~10) in Capsule 1.1 (600 MHz, D2O, 298 K), red colors indicate methyl groups for alkyl chains |
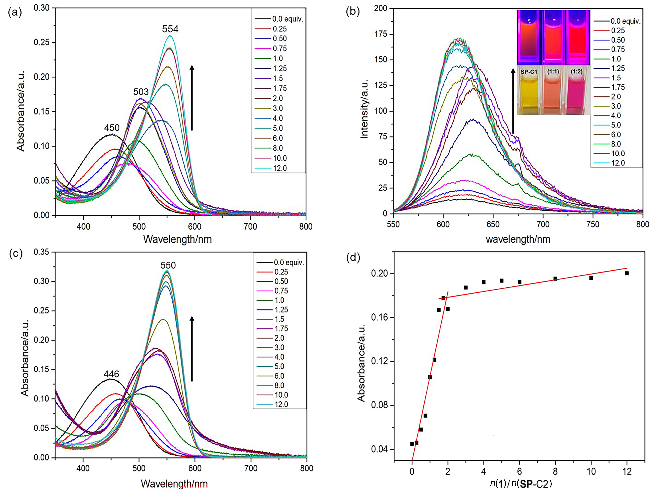
图4 SP-C1的水溶液(2.5 μmol/L)在不同物质的量1存在下的紫外吸收光谱(a)和荧光光谱图(b), 激发波长为450 nm; 插图为SP-C1⊂1在日光或405 nm光下的图像; (c) SP-C2的水溶液(2.5 μmol/L)在不同物质的量1存在下的紫外吸收光谱; (d)在515 nm处吸光度与n(1)/n(SP-C2)物质的量比的关系图Figure 4 The absorption spectra (a) and fluorescent spectra (b) of SP-C1 in water in the presence of incremental amount of 1; Inset: photograph of SP-C1⊂1 under daylight or 405 nm light (c=2.5 μmol/L, λex=450 nm); (c) The absorption spectra of SP-C2 in water in the presence of incremental amount of 1; (d) The absorbance at 515 nm versus molar ratio of n(1)/n(SP-C2) |