1 引言
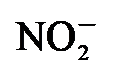 还原为NH3. Yang等[21]制备了CoP@Co核壳催化剂, 研究发现通过改变催化剂结构可以优化催化剂的合成氨反应性能. 上述研究表明, 钴基催化剂适用于NRR反应.
还原为NH3. Yang等[21]制备了CoP@Co核壳催化剂, 研究发现通过改变催化剂结构可以优化催化剂的合成氨反应性能. 上述研究表明, 钴基催化剂适用于NRR反应.
Nitrogen Reduction Properties of Cu2S@Co3S4/CF Core-shell Heterojunction Catalysts with Built-in Electric Field Effect
Received date: 2025-03-24
Online published: 2025-06-20
Supported by
Ordered Energy Conversion Basic Science Center Project of the National Natural Science Foundation of China(52488201)
In the context of the energy crisis and sustainable development, the electrocatalytic nitrogen reduction reaction (NRR) for ammonia synthesis with zero-carbon emission characteristics holds great promise. Developing highly efficient electrocatalysts with high ammonia yield and Faradaic efficiency (FE) for the nitrogen reduction reaction process (NRR) is crucial for enhancing the efficiency of ammonia synthesis. The modulation of electronic structure through interface engineering and vacancy engineering is a new approach to enhance the performance of catalyst. An efficient Cu2S@Co3S4/CF catalyst with core-shell heterojunction structure and sulfur vacancies was prepared, which exhibited an ammonia yield of 122 μg•h-1•cm-2 and a Faradaic efficiency of 34.6%, with the ammonia synthesis rate remaining consistently stable over 6 cycles of testing, outperforming most reported similar catalysts. Comprehensive experiments and characterization demonstrate that the high performance of the catalyst is attributed to the fact that the Cu2S core donates electrons to the Co3S4 shell through a uniform interface, which can promote the hydrogenation reactions of NRR while retarding the coupling of *H to form byproduct hydrogen. This contribute to a more optimal balance between the rate of ammonia production and the Faraday efficiency. Additionally, the formation of abundant sulfur vacancies significantly enhances nitrogen adsorption performance in this material. Moreover, the Zn‐N2 battery assembled with Cu2S@Co3S4/CF shows an excellent power density of 14.6 mW•cm−2, which enables the simultaneous ammonia production and energy supply. This work demonstrates a promising approach to develop highly efficient electrocatalysts for sustainable ammonia production, with significant implications for addressing the energy crisis and promoting the transition towards a low-carbon economy.

Key words: catalyst; nitrogen reduction reaction; core-shell structure; heterojunction; vacancy
Chaofan Guo , jinzhan Su , Liejin Guo . Nitrogen Reduction Properties of Cu2S@Co3S4/CF Core-shell Heterojunction Catalysts with Built-in Electric Field Effect[J]. Acta Chimica Sinica, 2025 , 83(7) : 716 -724 . DOI: 10.6023/A25030091
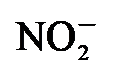 还原为NH3. Yang等[21]制备了CoP@Co核壳催化剂, 研究发现通过改变催化剂结构可以优化催化剂的合成氨反应性能. 上述研究表明, 钴基催化剂适用于NRR反应.
还原为NH3. Yang等[21]制备了CoP@Co核壳催化剂, 研究发现通过改变催化剂结构可以优化催化剂的合成氨反应性能. 上述研究表明, 钴基催化剂适用于NRR反应.| [1] |
(郭烈锦, 科技导报, 2021, 39, 1.)
|
| [2] |
(张谭, 余钟亮, 余嘉祺, 万慧凝, 包成宇, 涂文强, 杨颂, 化学学报, 2022, 80, 788.)
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
(詹溯, 章福祥, 化学学报, 2021, 79, 146.)
|
| [9] |
(张晓方, 甘汶, 纪之骄, 许明, 李初福, 何广利, 化工进展, 2025, 44, 809.)
|
| [10] |
(熊昆, 陈伽瑶, 杨娜, 蒋尚坤, 李莉, 魏子栋, 化学学报, 2021, 79, 1138.)
|
| [11] |
|
| [12] |
|
| [13] |
(姚嫣, 付年凯, 有机化学, 2025, 45, 1.)
|
| [14] |
(叶增辉, 刘华清, 张逢质, 有机化学, 2024, 44, 840.)
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
(应霞薇, 浮建军, 曾敏, 刘文, 张天宇, 沈培康, 张信义, 化学学报, 2022, 80, 503.)
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
(王亚飞, 徐良晨, 姚向昱, 闫霆, 潘卫国, 当代化工研究, 2024, 15.)
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
/
| 〈 |
|
〉 |