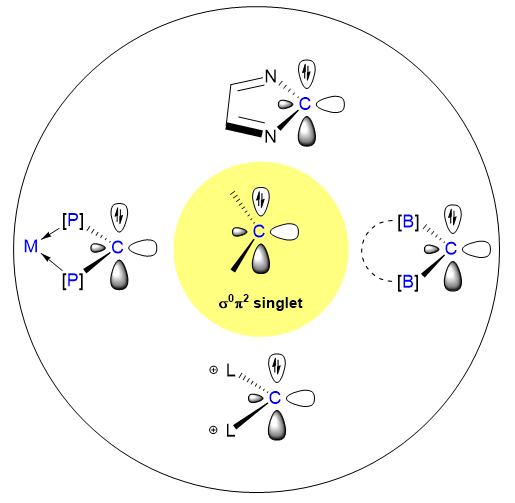
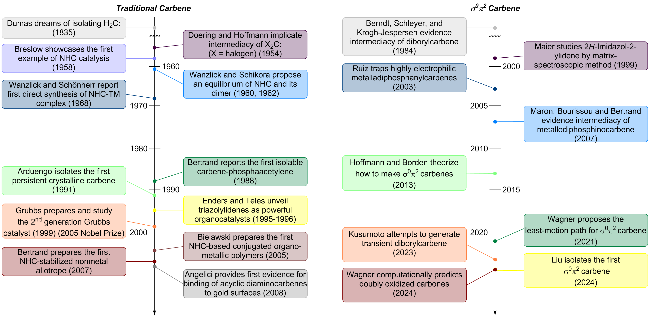
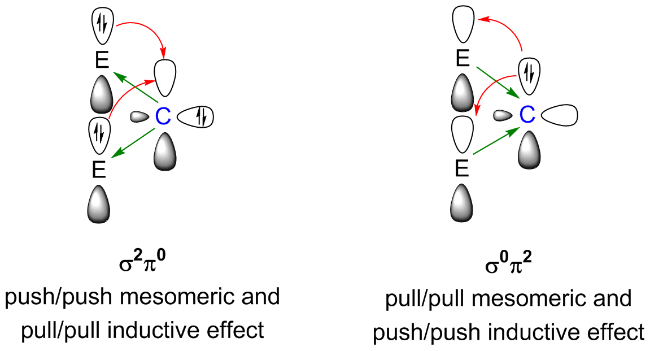
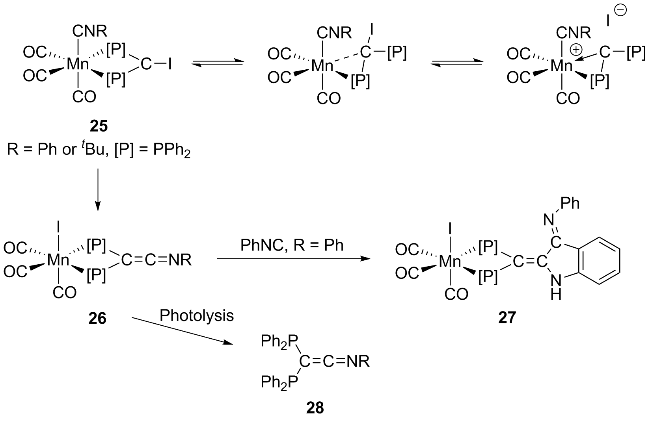
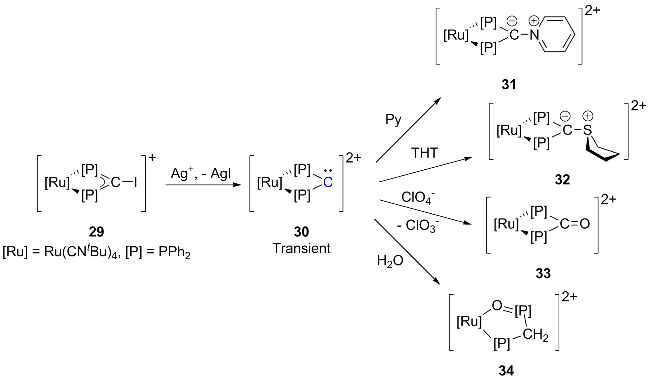
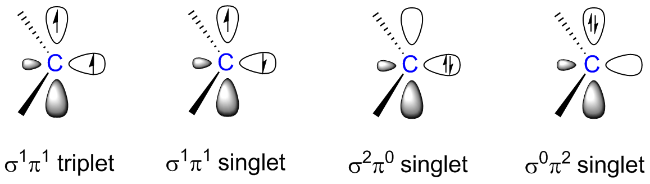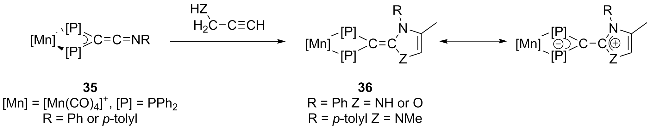1 引言
2 反转电子态(σ0π2)卡宾的相关研究情况
2.1 反转电子态卡宾的稳定策略
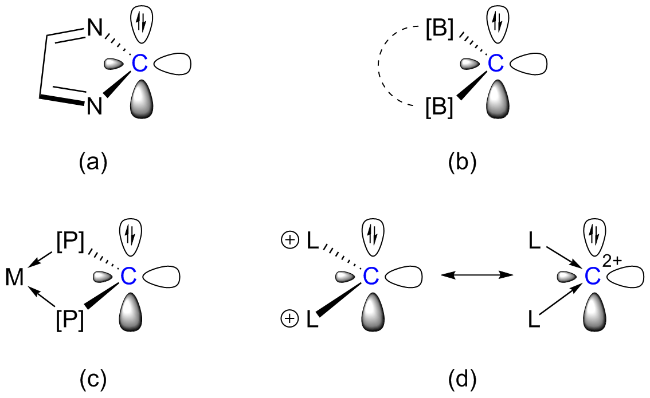
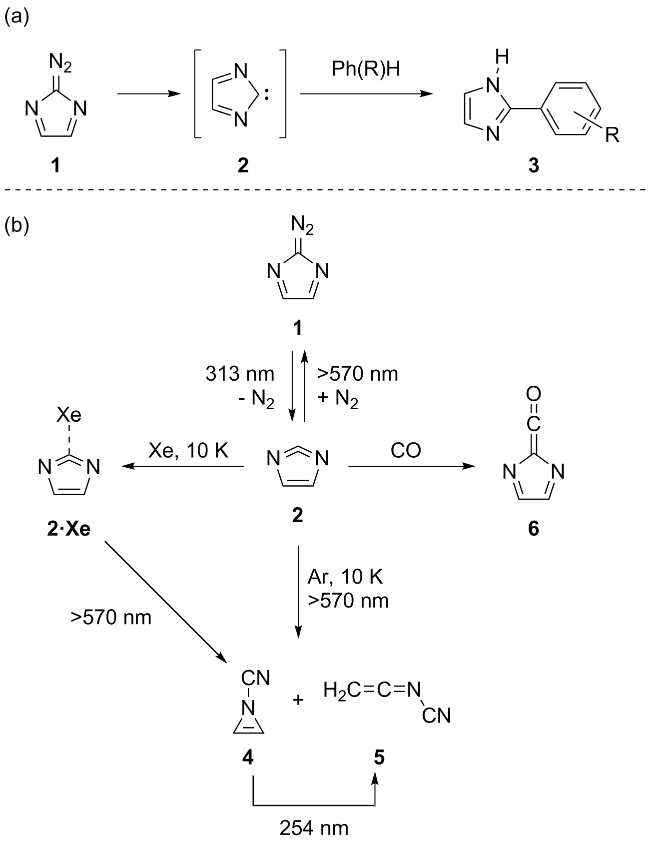
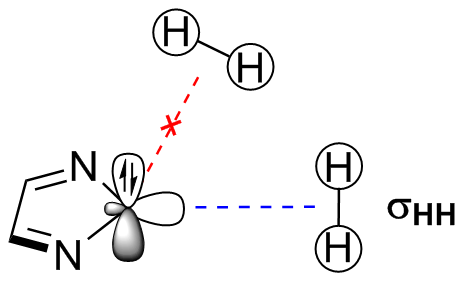
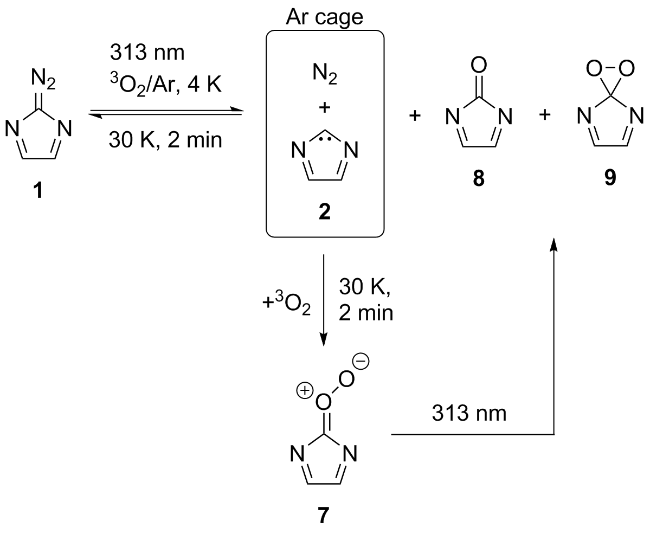
2.2 环状二亚氨基卡宾的相关研究进展
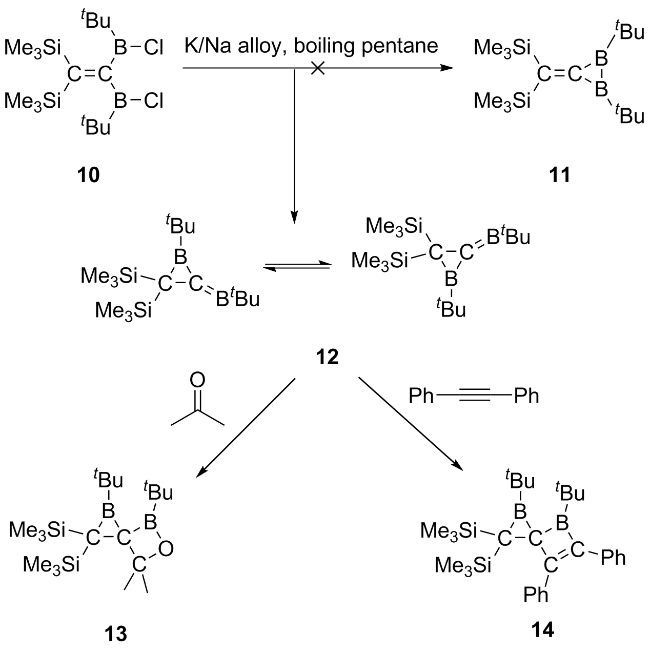
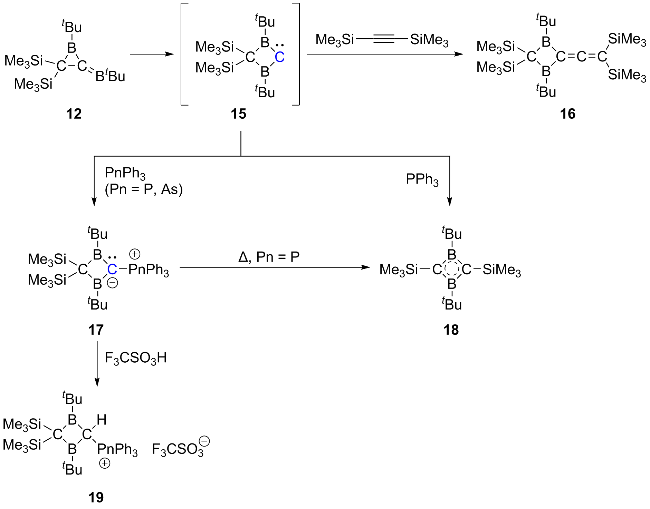
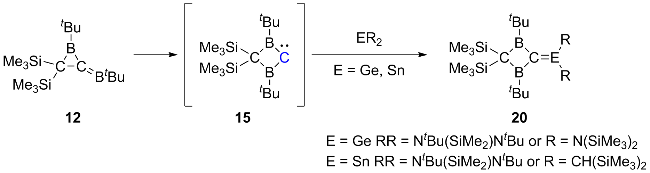
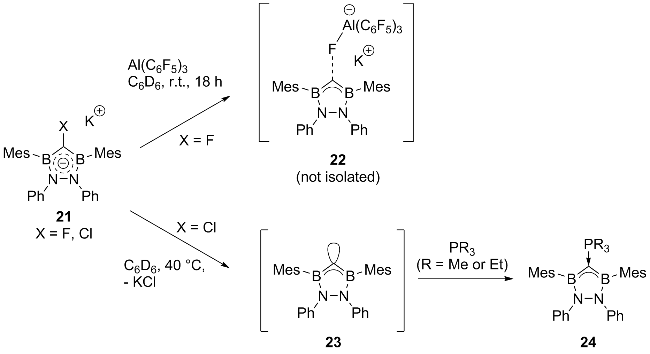
2.3 二硼基卡宾的相关研究进展
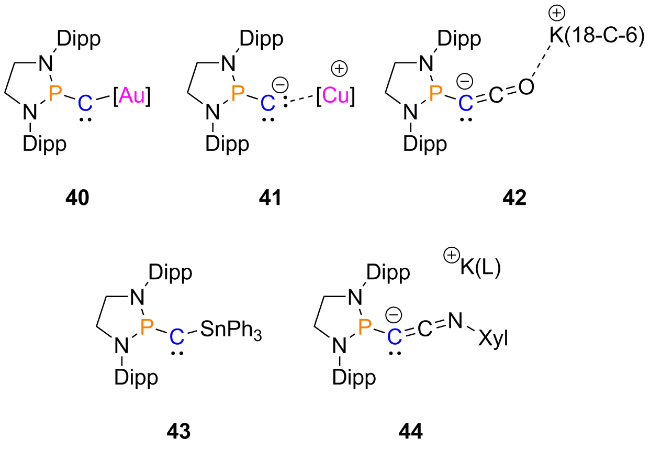
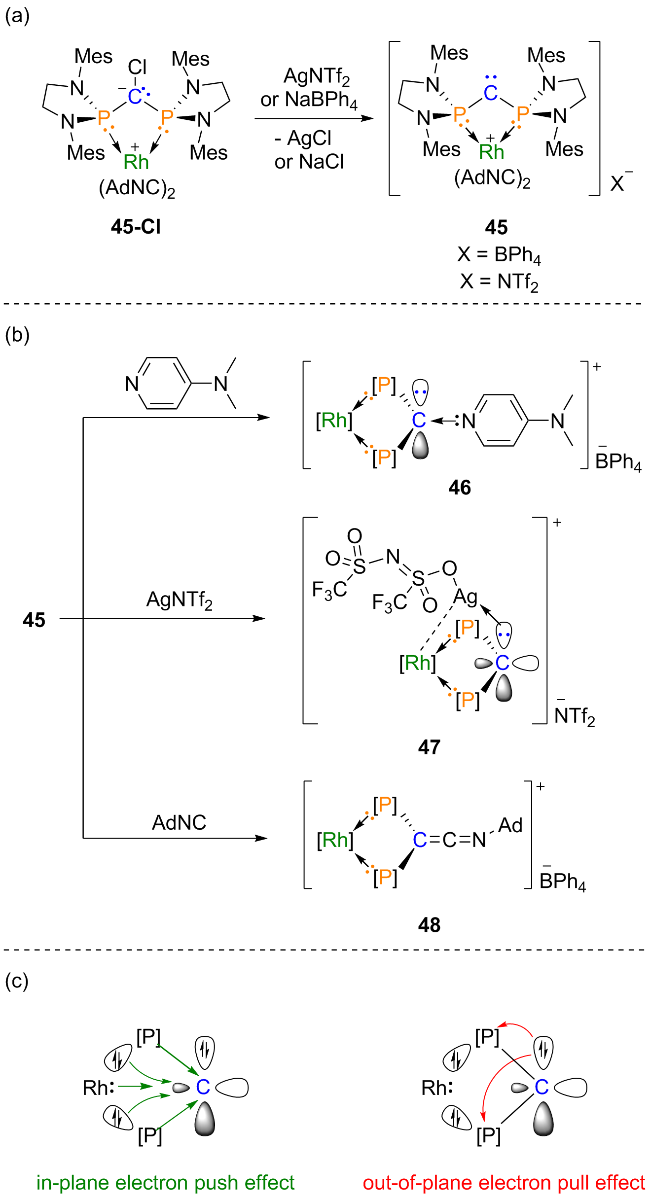
2.4 金属配位的环状二磷基卡宾的相关研究进展
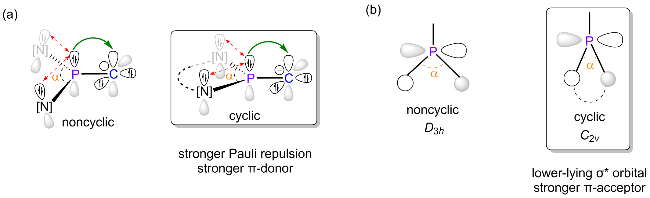
图16 (a)非环状与环状二氨基磷取代基的π供体能力对比; (b)平面磷基取代基的电子结构前沿分子轨道图(基于理想化D3h和C2v点群)Figure 16 (a) Comparison of the π-donating ability for noncyclic and cyclic diaminophosphino substituents; (b) Frontier molecular orbital diagrams depicting the electronic structure of planar phosphine substituents with the idealized D3h and C2v point groups |