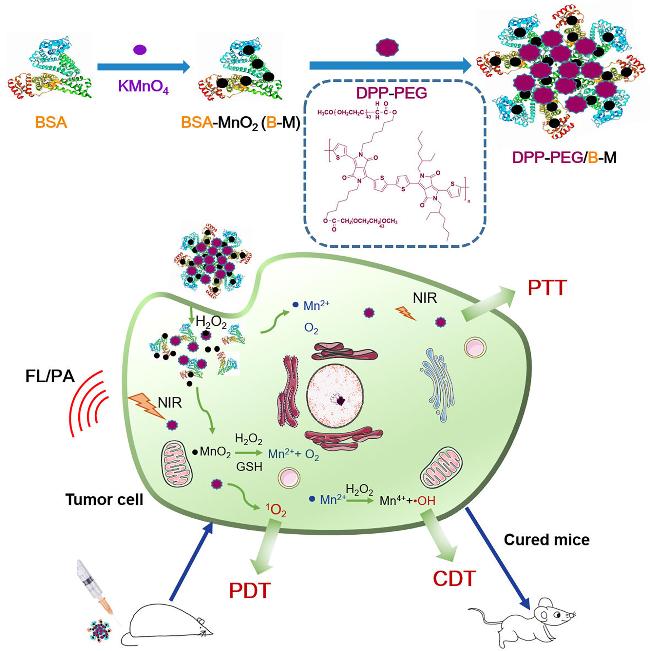
1 引言
2 结果与讨论
2.1 DPP-PEG的合成与表征
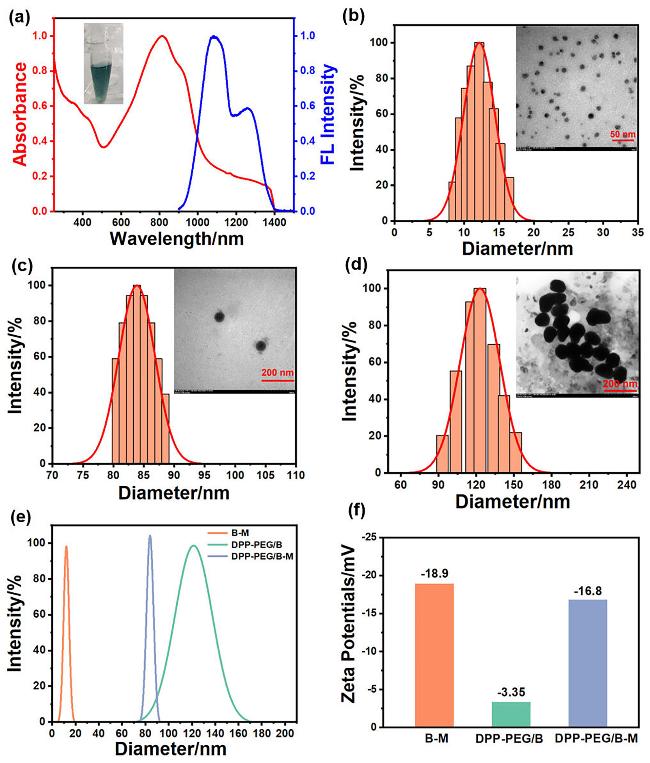
图2 (a) DPP-PEG水溶液的UV-Vis-NIR吸收光谱和808 nm激光激发的荧光光谱(插图: DPP-PEG水溶液的照片); (b) B-M, (c) DPP-PEG/B-M和(d) DPP-PEG/B的流体动力学尺寸和TEM图像; (e) B-M、DPP-PEG/B和DPP-PEG/B-M的流体动力学尺寸对比图; (f) B-M、DPP-PEG/B和DPP-PEG/B-M的Zeta电位Figure 2 (a) UV-Vis-NIR absorption and fluorescence (λexc: 808 nm) spectra of DPP-PEG aqueous solution (inset: photograph of DPP-PEG aqueous solution); hydrodynamic sizes and TEM images of (b) B-M, (c) DPP-PEG/B-M, and (d) DPP-PEG/B; (e) comparison of hydrodynamic sizes of B-M, DPP-PEG/B, and DPP-PEG/B-M; (f) Zeta potentials of B-M, DPP-PEG/B, and DPP-PEG/B-M |
2.2 DPP-PEG/B-M的制备与表征
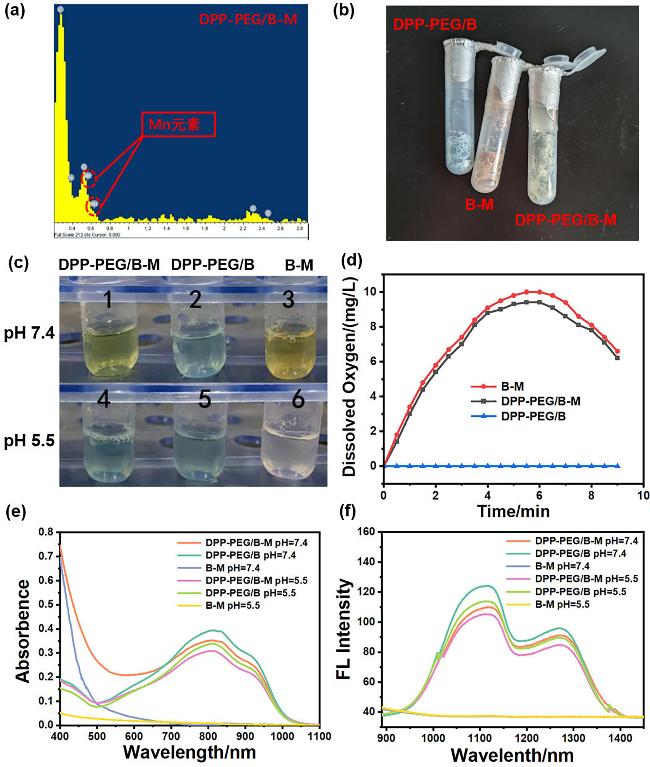
图3 (a) DPP-PEG/B-M的能量色散X射线光谱图; (b) DPP-PEG/B, B-M和DPP-PEG/B-M的固态照片; (c) DPP-PEG/B, B-M和DPP-PEG/B-M在中性PBS (pH 7.4)和弱酸性PBS (pH 5.5, 100 μmol/L H2O2)中的溶液照片; (d)在酸性PBS(pH 5.5, 100 μmol/L H2O2)中的溶解氧浓度随时间变化; DPP-PEG/B、B-M和DPP-PEG/B-M在中性PBS (pH 7.4)和酸性PBS (pH 5.5, 100 μmol/L H2O2)中的(e) UV-Vis-NIR吸收光谱; (f)荧光光谱(激发波长: 808 nm)Figure 3 (a) Energy-dispersive X-ray spectroscopy spectrum of DPP-PEG/B-M; (b) photos of DPP-PEG/B, B-M, and DPP-PEG/B-M solid state; (c) DPP-PEG/B, B-M, and DPP-PEG/B-M in the solution of neutral PBS (pH 7.4) and weakly acidic PBS (pH 5.5, 100 μmol/L H2O2); (d) time-dependent dissolved oxygen concentration of DPP-PEG/B, B-M, and DPP-PEG/B-M in acidic PBS (pH 5.5, 100 μmol/L H2O2); (e) UV-Vis-NIR absorption spectra and (f) fluorescence spectra (λexc: 808 nm) of DPP-PEG/B, B-M, and DPP-PEG/B-M in neutral PBS (pH 7.4) and acidic PBS (pH 5.5, 100 μmol/L H2O2) |
2.3 体外光动力、化学动力学和光热性能
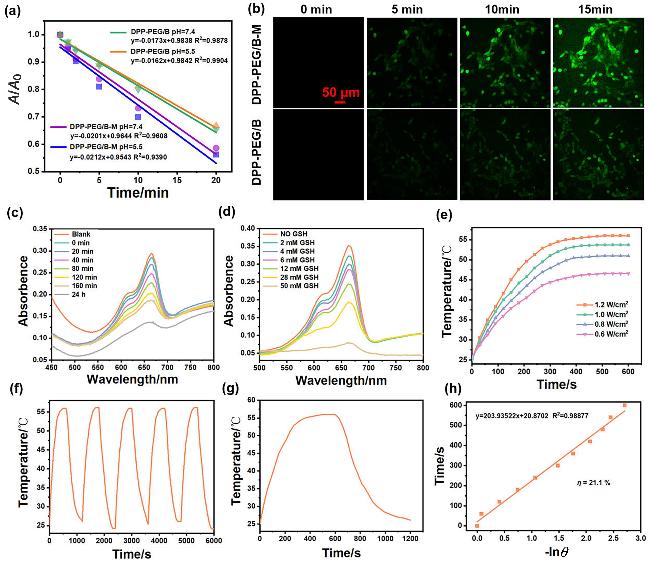
图4 (a) DPBF在含有DPP-PEG/B-M或DPP-PEG/B的中性PBS (pH 7.4)或弱酸性PBS (pH 5.5, 100 μmol/L H2O2)中的吸光度变化与辐照时间(808 nm, 1 W/cm2)的线性关系; (b)在与DPP-PEG/B-M和DPP-PEG/B分别孵育后的4T1细胞内检测1 O2, 采用DCFH-DA作为荧光探针; DPP-PEG/B-M, GSH, H2O2和MB在NaHCO3缓冲溶液(25 mmol/L)中(c)混合不同时间后, MB的吸收光谱变化; (d)混合0.5 h后, MB的吸收光谱随GSH浓度(0~50 mmol/L)的变化; (e)在不同功率的激光(808 nm)激发下, DPP-PEG/B-M (400 μg/mL)的升温曲线; (f) DPP-PEG/B-M在激光(808 nm, 1.2 W/cm2)照射下的光热响应, 重复照射和关闭, 循环五次; (g) f图中的单次光热循环; (h)从图g的降温过程得到的时间与-lnθ的线性关系Figure 4 (a) Linear relationship between absorbance changes of DPBF and irradiation time (808 nm, 1 W/cm²) in neutral PBS (pH 7.4) or weakly acidic PBS (pH 5.5, 100 μmol/L H₂O₂) containing DPP-PEG/B-M or DPP-PEG/B; (b) intracellular detection of ¹O₂ in 4T1 cells incubated with DPP-PEG/B-M and DPP-PEG/B using DCFH-DA as a fluorescent probe; (c) absorption spectral changes of MB in NaHCO₃ buffer (25 mmol/L) after mixing DPP-PEG/B-M, GSH, H₂O₂, and MB for different durations; (d) absorption spectra of MB at varying GSH concentrations (0~50 mmol/L) after mixing DPP-PEG/B-M, GSH, H₂O₂, and MB for 0.5 h; (e) temperature elevation curves of DPP-PEG/B-M (400 μg/mL) under 808 nm laser irradiation at different power densities; (f) photothermal response of DPP-PEG/B-M during five on/off cycles under 808 nm laser irradiation (1.2 W/cm²); (g) single photothermal cycle from (f); (h) linear relationship between time and −lnθ derived from the cooling phase in (g) |
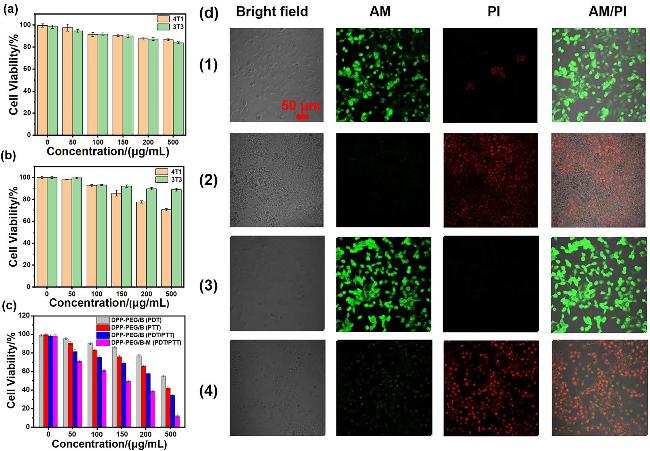
2.4 细胞毒性分析
图5 黑暗条件下(a)与DPP-PEG/B共孵育的3T3和4T1细胞存活率; (b)黑暗条件下与DPP-PEG/B-M共孵育的3T3和4T1细胞存活率; (c)经过DPP-PEG/B光动力、光热和光动力/光热联合治疗后的4T1细胞存活率, 经过DPP-PEG/B-M光动力/光热联合治疗后的4T1细胞存活率(808 nm激光照射8 min, 0.8 W/cm2); (d)与DPP-PEG/B-M共孵育的4T1细胞在(1)黑暗和(2)光照(808 nm, 0.8 W/cm2) 8 min条件下的AM/PI染色; 与DPP-PEG/B共孵育的4T1细胞在(3)黑暗和(4)光照(808 nm, 0.8 W/cm2)8 min 条件下的AM/PI染色Figure 5 Cell viability of 3T3 and 4T1 cells coincubated with (a) DPP-PEG/B or (b) DPP-PEG/B-M under dark conditions; (c) cell viability of 4T1 cells after PDT, PTT and PDT/PTT treatment with DPP-PEG/B, and cell viability of 4T1 cells after PTT/PDT treatment with DPP-PEG/B-M (808 nm laser irradiation, 8 min, 0.8 W/cm²); (d) AM/PI staining of 4T1 cells coincubated with DPP-PEG/B-M: (1) under dark condition and (2) under laser irradiation (808 nm, 0.8 W/cm², 8 min); AM/PI staining of 4T1 cells coincubated with DPP-PEG/B: (3) under dark condition and (4) under laser irradiation (808 nm, 0.8 W/cm², 8 min) |
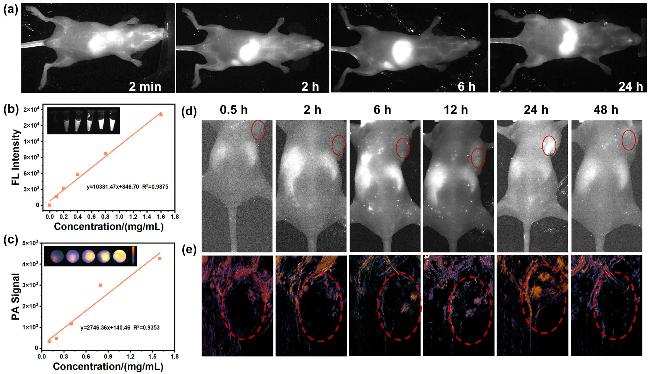
2.5 近红外二区荧光成像和光声成像
图6 (a)静脉注射DPP-PEG NPs的PBS溶液后不同时间点的小鼠全身血管NIR-II荧光成像; (b) DPP-PEG/B-M的PBS溶液浓度与NIR-II荧光强度的线性关系; (c) DPP-PEG/B-M的PBS溶液浓度与光声强度的线性关系; 静脉注射DPP-PEG/B-M的PBS溶液后不同时间点的4T1荷瘤小鼠(d)体内NIR-II荧光成像; (e)体内光声成像(激发波长均为808 nm, 红色圆圈代表肿瘤区域)Figure 6 (a) NIR-II fluorescence imaging of systemic vasculature in mice at various time points post intravenous injection of DPP-PEG NPs in PBS; (b) linear relationship between the concentration of DPP-PEG/B-M in PBS and NIR-II fluorescence intensity; (c) linear relationship between the concentration of DPP-PEG/B-M in PBS and photoacoustic intensity; (d) in vivo NIR-II fluorescence imaging and (e) in vivo photoacoustic imaging of 4T1 tumor-bearing mice at different time points after intravenous injection of DPP-PEG/B-M in PBS (λexc: 808 nm; red circles indicate tumor regions) |