1 引言
2 结果与讨论
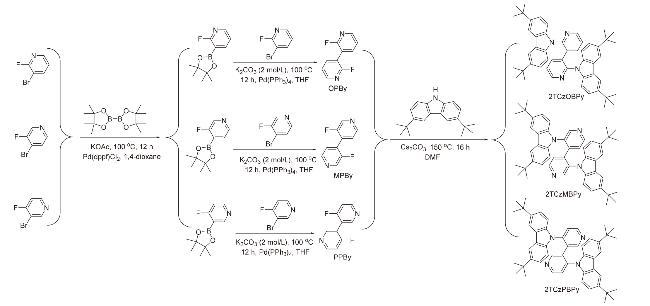
2.1 合成与表征
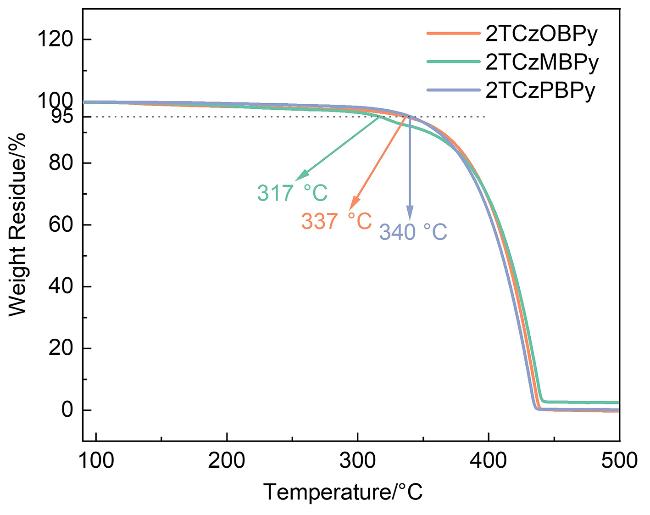
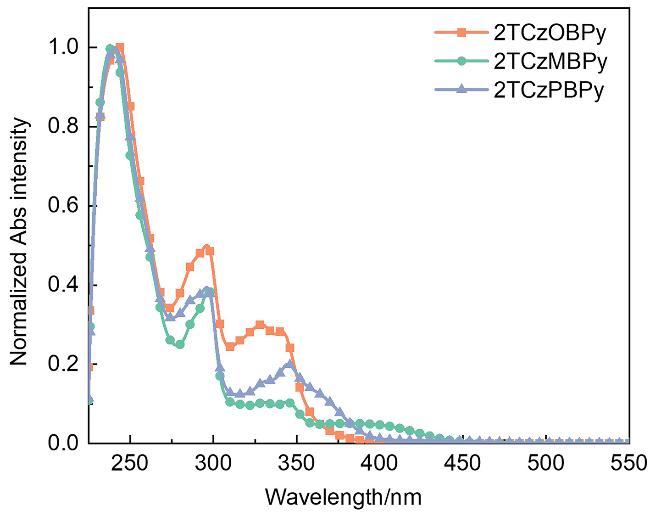
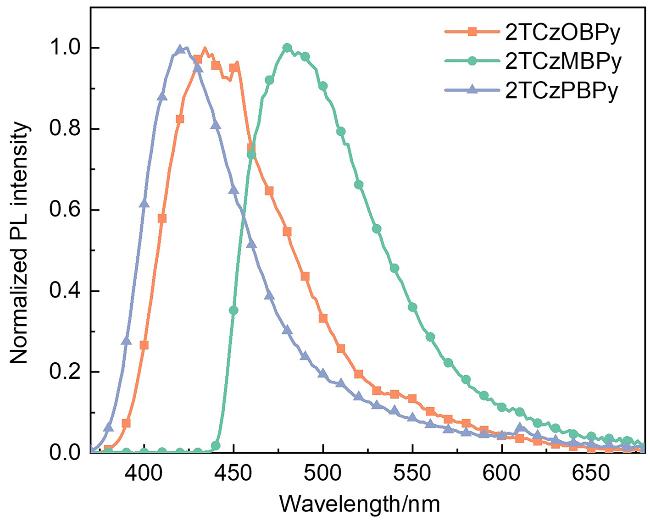
2.2 热物理性质和光物理性质
表1 三种化合物的光物理性能数据Table 1 Photophysical properties data of the three compounds |
| Compound | Absorptiona/nm | Emissionb/nm | τb/ns | PLQYb/% | Td/℃ |
|---|---|---|---|---|---|
| 2TCzOBPy | 243, 295, 328, 342 | 440 | 2.8 | 50.7 | 337 |
| 2TCzMBPy | 239, 297, 345, 391 | 487 | 11.6 | 94.4 | 317 |
| 2TCzPBPy | 241, 296, 344 | 422 | 3.2 | 38.0 | 340 |
a Measured in dichloromethane solution at room temperature; b Measured at room temperature in the doped film state. |
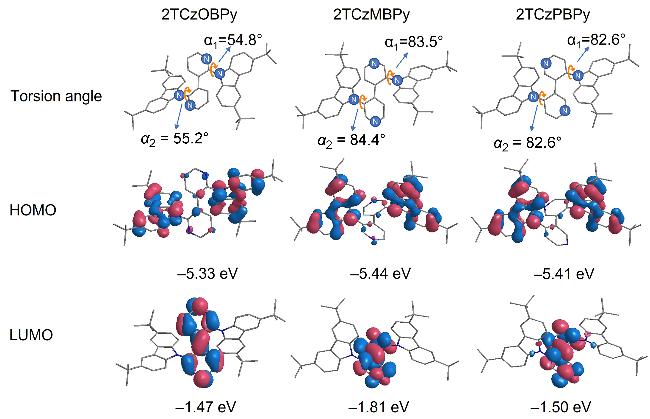
2.3 理论计算和电化学性质
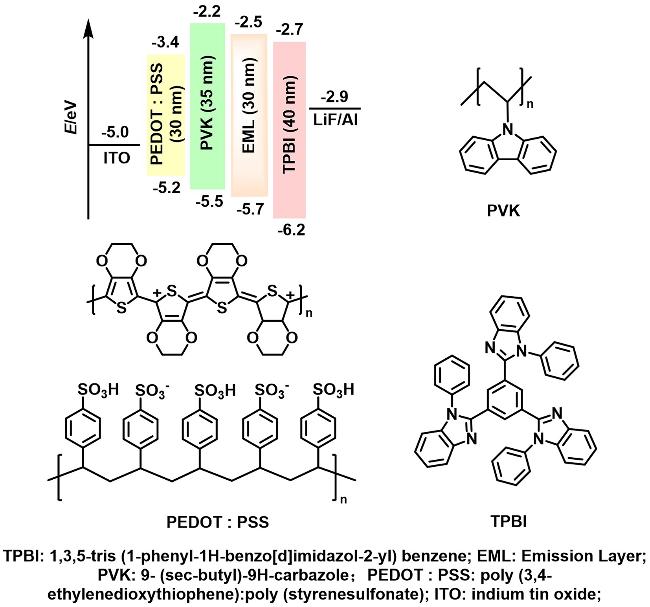
2.4 电致发光性能
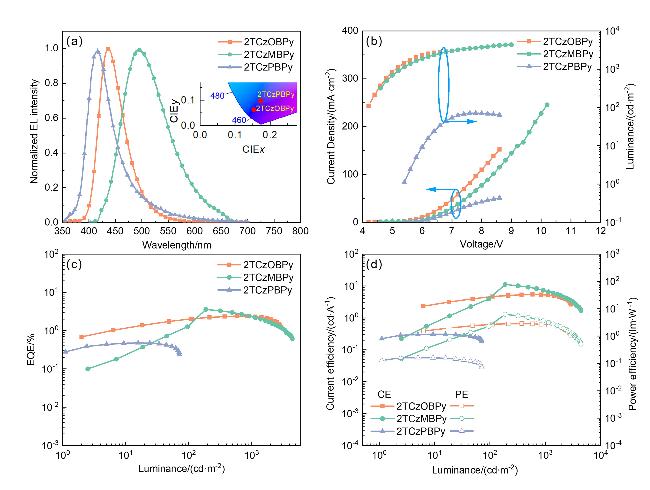
图6 基于三种材料的(a) EL光谱和CIE坐标图、(b)电流密度-电压-亮度曲线、(c)最大外量子效率-亮度曲线及(d)电流效率-亮度-功率效率曲线Figure 6 (a) EL spectra and CIE coordinate diagram, (b) current density-voltage-luminance curves, (c) maximum external quantum efficiency-luminance curves, and (d) current efficiency-luminance-power efficiency curves based on the three materials |
表2 三种材料的电致发光性能Table 2 Electroluminescence properties of three materials |
| Device | Vona/V | Lmaxb/(cd•m−2) | EQEc/% | CEd/(cd•A−1) | PEe/(lm•W−1) | λEL/nm | CIE (x, y) |
|---|---|---|---|---|---|---|---|
| 2TCzOBPy | 4.5 | 2888 | 2.4/2.3 | 5.4 | 2.9 | 437 | (0.172, 0.098) |
| 2TCzMBPy | 4.6 | 5423 | 3.6/2.4 | 11.2 | 6.3 | 496 | (0.224, 0.399) |
| 2TCzPBPy | 5.4 | 71 | 0.5/— | 0.3 | 0.2 | 416 | (0.152, 0.063) |
a The voltage at a luminance of 1 cd•m−2; b The maximum luminance; c The maximum EQE/The EQE at 1000 cd•m−2; d The maximum current efficiency; e The maximum power efficiency. |