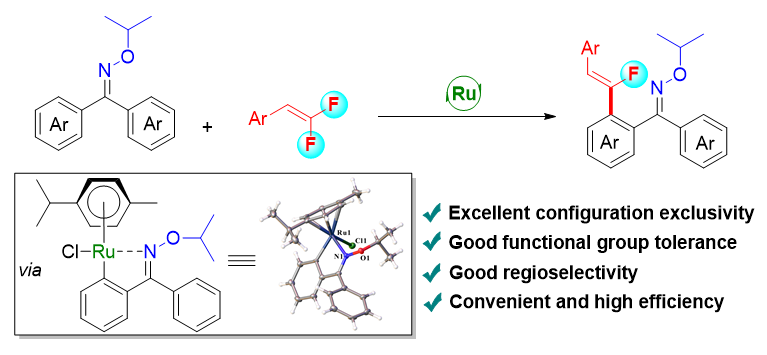
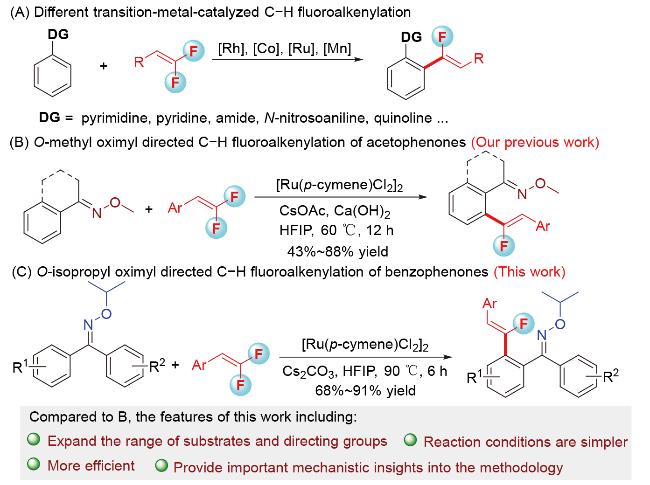
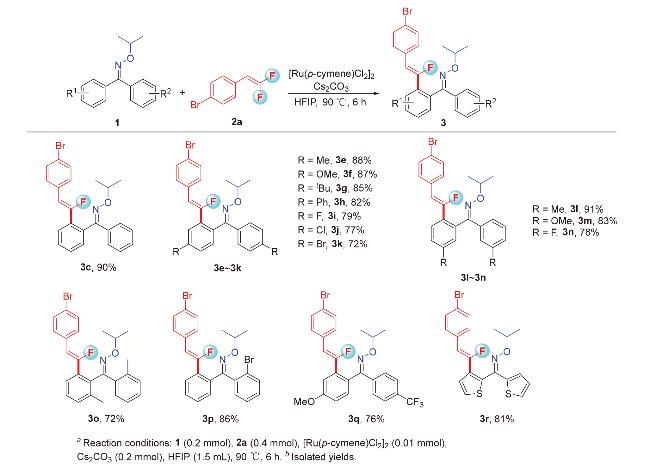
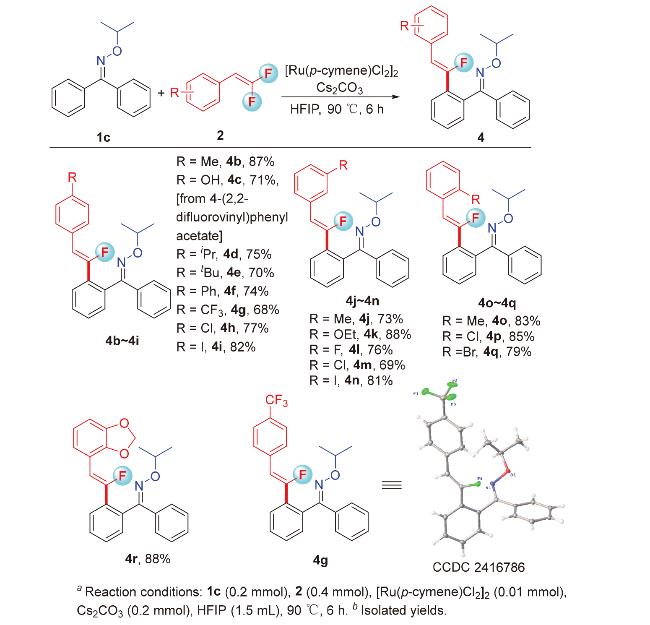
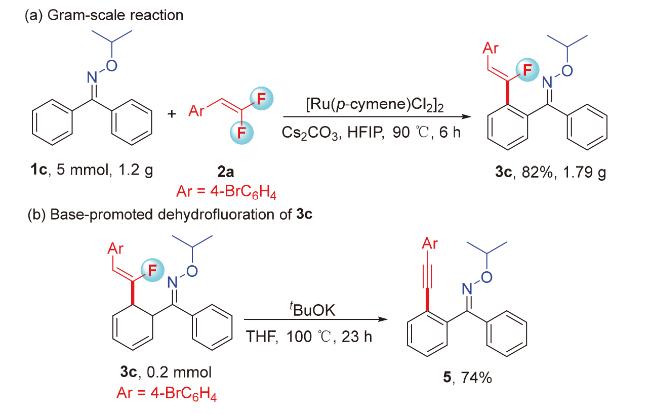
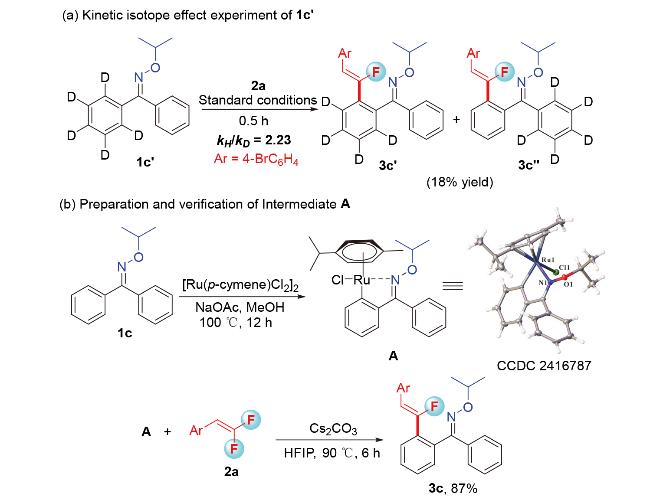
1 引言
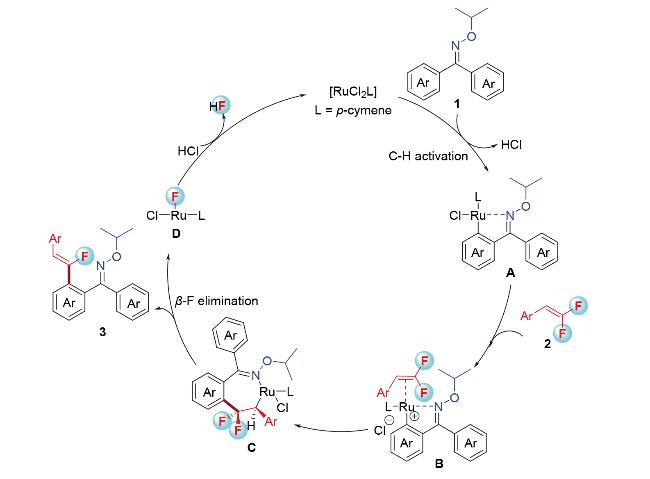
2 结果与讨论
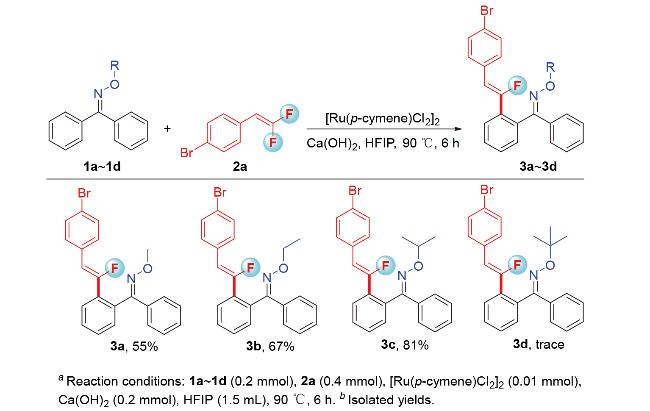
2.1 导向基筛选
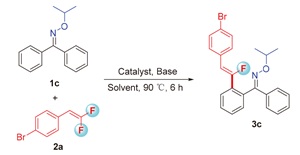
2.2 反应条件优化
表1 反应条件优化aTable 1 Optimization of the reaction conditionsa |
| Entry | Catalyst | Base | Solvent | Yieldb/% |
|---|---|---|---|---|
| 1 | [Ru(p-cymene)Cl2]2 | Ca(OH)2 | HFIP | 81 |
| 2 | [Cp*RhCl2]2 | Ca(OH)2 | HFIP | 0 |
| 3 | Pd(OAc)2 | Ca(OH)2 | HFIP | 0 |
| 4 | Cu(OAc)2 | Ca(OH)2 | HFIP | 0 |
| 5 | — | Ca(OH)2 | HFIP | 0 |
| 6 | [Ru(p-cymene)Cl2]2 | CsOAc | HFIP | 29 |
| 7 | [Ru(p-cymene)Cl2]2 | Cs2CO3 | HFIP | 90 |
| 8 | [Ru(p-cymene)Cl2]2 | DBU | HFIP | 0 |
| 9 | [Ru(p-cymene)Cl2]2 | pyridine | HFIP | 0 |
| 10 | [Ru(p-cymene)Cl2]2 | — | HFIP | 0 |
| 11 | [Ru(p-cymene)Cl2]2 | Cs2CO3 | TFE | 34 |
| 12 | [Ru(p-cymene)Cl2]2 | Cs2CO3 | MeOH | 0 |
| 13 | [Ru(p-cymene)Cl2]2 | Cs2CO3 | THF | 0 |
| 14c | [Ru(p-cymene)Cl2]2 | Cs2CO3 | HFIP | 16 |
| 15d | [Ru(p-cymene)Cl2]2 | Cs2CO3 | HFIP | 77 |
| 16e | [Ru(p-cymene)Cl2]2 | Cs2CO3 | HFIP | 84 |
| 17f | [Ru(p-cymene)Cl2]2 | Cs2CO3 | HFIP | 79 |
| 18g | [Ru(p-cymene)Cl2]2 | Cs2CO3 | HFIP | 89 |
| 19h | [Ru(p-cymene)Cl2]2 | Cs2CO3 | HFIP | 46 |
a Reaction conditions: 1c (0.2 mmol), 2a (0.4 mmol), catalyst (0.01 mmol), base (0.2 mmol), solvent (1.5 mL), 90 ℃, 6 h. b Isolated yields. c r.t. d 60 ℃. e 100 ℃. f 2 h. g 12 h. h Using 0.1 mmol Cs2CO3. DBU=1,8-diazabicyclo- [5.4.0]undec-7-ene. |