1 引言
2 结果与讨论
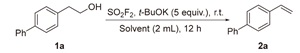
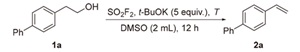
2.1 反应条件优化
表1 碱的优化aTable 1 Optimization of bases |
| Entry | Base | Yieldb/% 2a |
|---|---|---|
| 1 | Et3N | n.d. |
| 2 | DBU | 5 |
| 3 | DIPEA | n.d. |
| 4 | DABCO | n.d. |
| 5 | TMEDA | n.d. |
| 6 | K2CO3 | 6 |
| 7 | KOH | 11 |
| 8 | t-BuOK | 48 |
a Reaction conditions: 1a (0.20 mmol), base (0.6 mmol), DMSO (2 mL), r.t., 12 h. DBU: 1,8-diazabicyclo[5.4.0]undec-7-ene; DIPEA: N,N-diisopropyl- ethylamine; DABCO: 1,4-diazabicyclo[2.2.2]octane; TMEDA: N,N,N',N'- tetramethylethylenediamine. b Yield was determined by high-performance liquid chromatography using pure product 2a as an external standard. |
表2 碱的当量优化aTable 2 Optimization of equivalent of base |
| Entry | X | Yieldb/% 2a |
|---|---|---|
| 1 | 1 | 16 |
| 2 | 2 | 35 |
| 3 | 4 | 59 |
| 4 | 5 | 69 |
| 5 | 6 | 68 |
| 6 | 7 | 67 |
a Reaction conditions: 1a (0.20 mmol), t-BuOK (X equiv.), DMSO (2 mL), r.t., 12 h. b Yield was determined by high-performance liquid chromatography using pure product 2a as an external standard. |
表3 反应溶剂优化aTable 3 Optimization of reaction solvent |
| Entry | Solvent | Yieldb/% |
|---|---|---|
| 1 | DMSO | 69 |
| 2 | DMF | 61 |
| 3 | THF | 39 |
| 4 | CH3CN | 15 |
| 5 | 1,4-Dioxane | 10 |
| 6 | MeOH | 16 |
| 7 | Acetone | 27 |
| 8 | Toluene | 44 |
a Reaction conditions: 1a (0.20 mmol), t-BuOK (5 equiv.), solvent (2 mL), 12 h. b Yield was determined by high-performance liquid chromatography using pure product 2a as an external standard. |
表4 反应温度优化aTable 4 Optimization of reaction temperature |
| Entry | Temperature/℃ | Yieldb/% 2a |
|---|---|---|
| 1 | 40 | 74 |
| 2 | 60 | 88 |
| 3 | 80 | 62 |
| 4 | 100 | 58 |
| 5c | 60 | 70 |
| 6d | 60 | 78 |
a Reaction conditions: 1a (0.20 mmol), t-BuOK (5 equiv.), DMSO (2 mL), 12 h. b Yield was determined by high-performance liquid chromatography using pure product 2a as an external standard. c t-BuOK (4 equiv.). d t-BuOK (4.5 equiv.). |
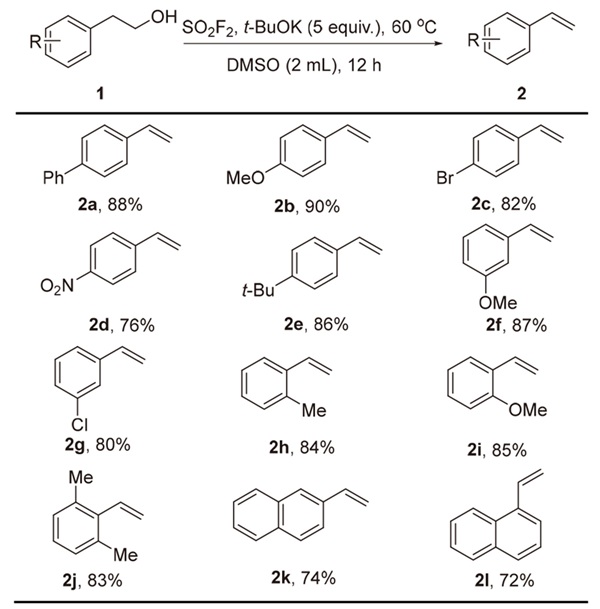
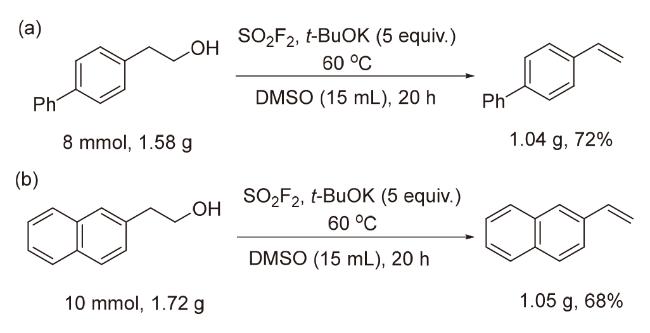
2.2 底物拓展
表5 底物拓展aTable 5 Substrate scope |
| |