1 引言
2 硫酸铁钠的性质
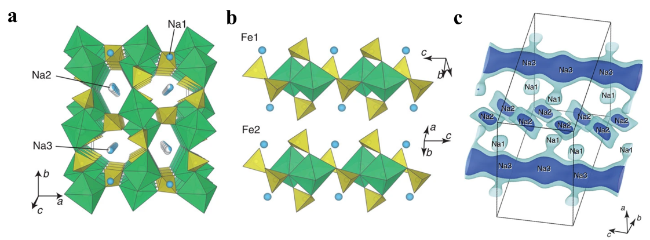
2.1 晶体结构
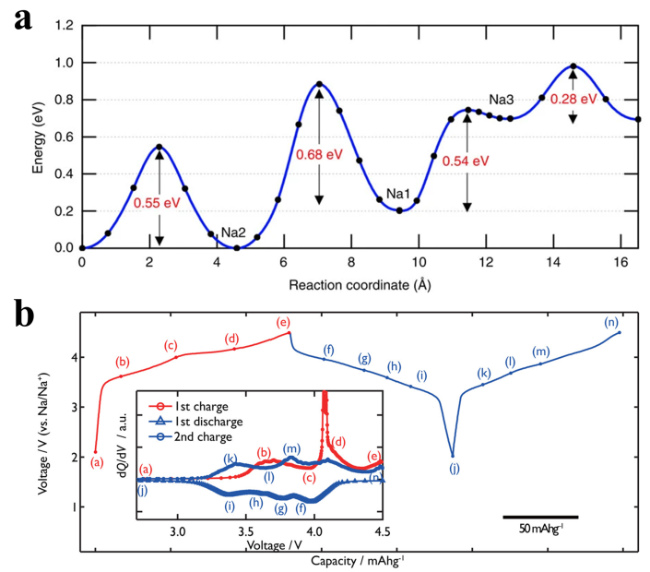
2.2 钠离子脱嵌机制
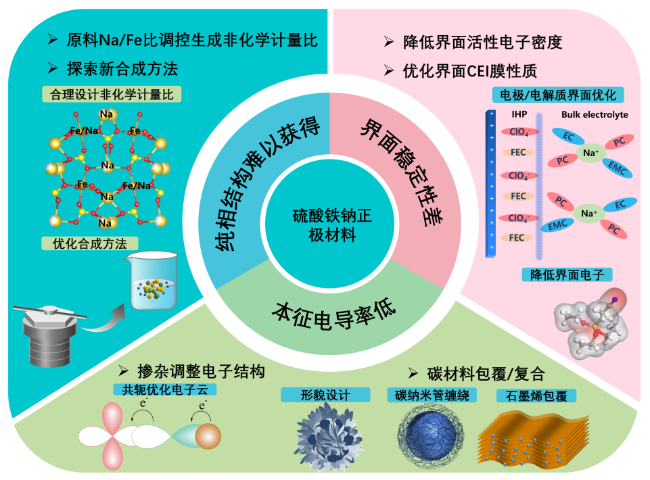
3 硫酸铁钠正极材料面临的问题
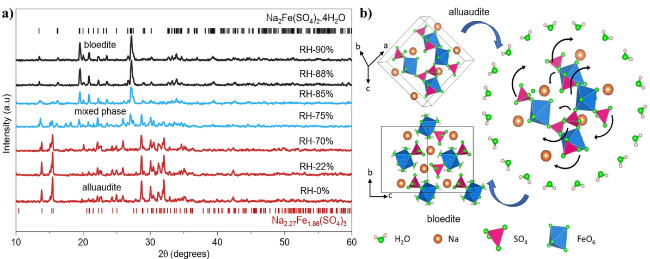
3.1 纯相结构难以获得
3.2 本征电导率低
3.3 界面稳定性差
4 硫酸铁钠材料的合成方法
4.1 固相法
4.2 液相法
4.3 其他合成方法
5 硫酸铁钠正极材料的改性手段
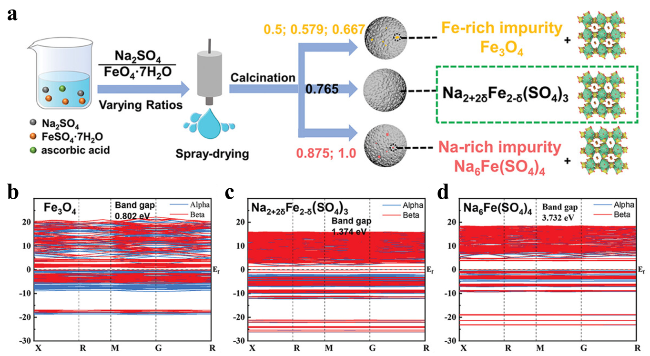
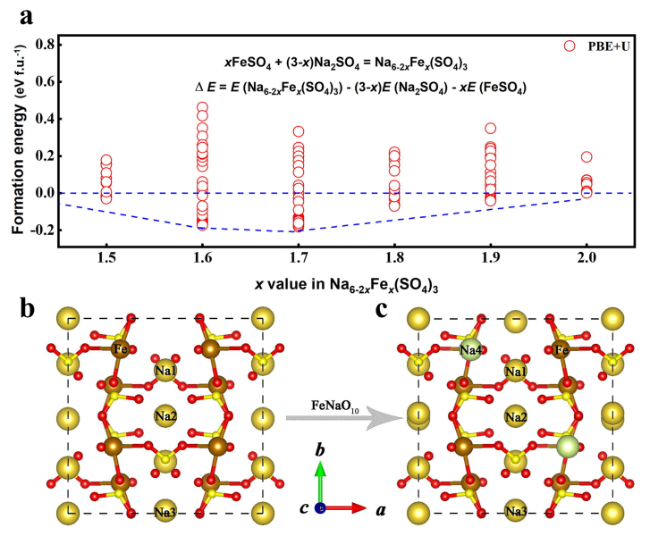
5.1 非化学计量比设计
5.2 元素掺杂
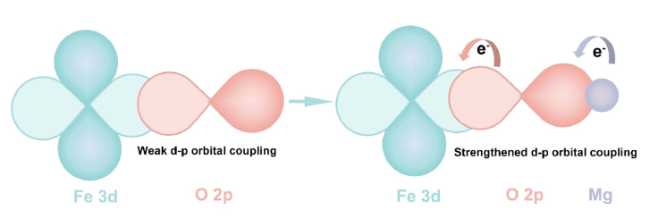
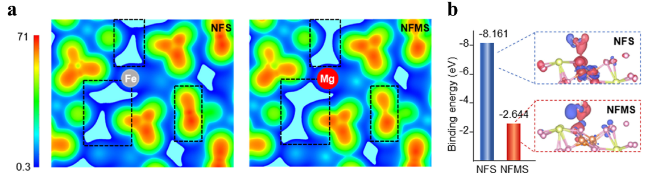
5.2.1 阳离子掺杂
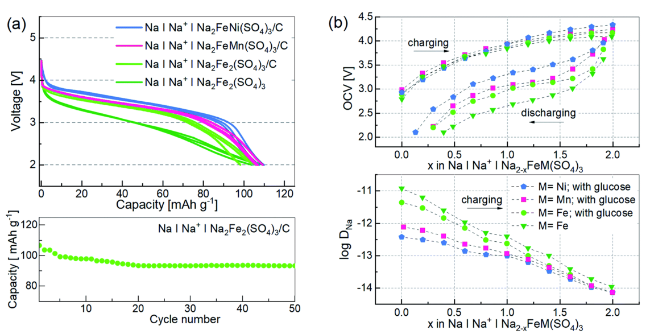
图8 (a) Na2FeM(SO4)3的前三圈的放电曲线以及NFS的循环性能; (b)充电/放电期间测量的开路电压(电流速率C/50)和第一次充电期间的钠离子扩散系数[58]Figure 8 Discharge curves for the first three cycles of Na2FeM(SO4)3 and cycling performance of NFS. (b) Open circuit voltage measured during charging/discharging (current rate C/50) and the sodium ion diffusion coefficient during the first charging[58] |
5.2.2 阴离子掺杂
5.3 碳包覆技术
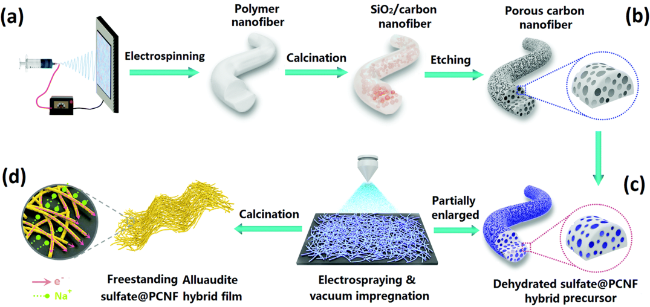
5.4 形貌/微观结构设计
5.5 多尺度界面工程
6 硫酸铁钠材料产业化
6.1 硫酸铁钠材料产业化挑战
表1 不同设计策略的硫酸铁钠性能对比表Table 1 Performance comparison table of sodium iron sulphate with different design strategies |
| 化学式 | 改性策略 | 合成方法 | 倍率及循环性能 | 参考文献 |
|---|---|---|---|---|
| Na2+2xFe2-x(SO4)3 | 非化学计量比设计 | 喷雾干燥法 | 0.1 C, 93.8 mAh/g 20 C, 67.84 mAh/g 10 C, 1000圈, 71.1% | [41] |
| Na2.4Fe1.6Mg0.02(SO4)3 | 阳离子掺杂 | 喷雾干燥法 | 0.1 C, 96.2 mAh/g 20 C, 62.7 mAh/g 5 C, 2000圈, 86% | [52] |
| Na2.9Fe1.7(SO4)2.7(PO4)0.3 | 阴离子掺杂 | 固相球磨法 | 0.1 C, 100.4 mAh/g 30 C, 86.7 mAh/g 30 C, 6000圈, 85.5% | [65] |
| Na2.2Fe1.75(SO3.9F0.1)3 | 阴离子掺杂 | 固相球磨法 | 0.1 C, 121.5 mAh/g 5 C, 86.4 mAh/g 5 C, 1000圈, 78.8% | [66] |
| Na2+2xFe2-x(SO4)3@C@2%CNTs | 碳包覆 | 喷雾干燥法 | 0.05 C, 95.9 mAh/g 2 C, 80 mAh/g 1 C, 100圈, 96.1% | [84] |
| Na2.4Fe1.8(SO4)3@rGO | 碳包覆 | 喷雾干燥法 | 0.05 C, 100 mAh/g 50 C, 45 mAh/g 10 C, 10000圈, 58% | [87] |
| Na2+2xFe2-x(SO4)3@RHC | 碳包覆 | 固相球磨法 | 0.1 C, 96.8 mAh/g 20 C, 30 mAh/g 0.1 C, 100圈, 83.9% | [91] |
| Na2Fe2(SO4)3@C@GO | 微观结构设计 | 冷冻干燥法 | 0.1 C, 107.9 mAh/g 10 C, 75.1 mAh/g 5 C, 800圈, 80.1% | [37] |
| Na2+2xFe2-x(SO4)3@SWNT | 微观结构设计 | 静电纺丝法 | 0.05 C, 90.8 mAh/g 10 C, 74.9 mAh/g 5 C, 100圈, 92% | [94] |
| Na2.26Fe1.87(SO4)3/Na6Fe(SO4)4 | 多尺度界面工程 | 冷冻干燥法 | 6 mA/g, 101.3 mAh/g 1200 mA/g, 73.5 mAh/g 60 mA/g, 1300圈, 80.69% | [95] |
6.2 硫酸铁钠材料产业化现状
表2 硫酸铁钠材料代表性专利申请统计表Table 2 Patent landscape analysis of sodium iron sulfate materials |
| 申请公司 | 发明名称 | 针对问题 | 创新点 | 参考专利 |
|---|---|---|---|---|
| 三一红象电池有限公司 | 一种碳复合硫酸铁钠正极材料及其制备方法和应用 | 压实密度低 | 混料方式: 砂磨 | [98] |
| 一种制备碳包覆硫酸铁钠材料的方法、碳包覆硫酸铁钠材料和电池 | 无机碳源包覆不均匀 | 引入分散剂: 十六烷基三甲基溴化铵 | [96] | |
| 一种制备碳包覆硫酸铁钠材料的方法、碳包覆硫酸铁钠材料和电池 | 无机碳源包覆不均匀 | 球磨预分散无机碳源 | [100] | |
| 深圳先进研究院 | 一种硫酸铁钠复合材料及其制备方法与应用 | 比容量偏低 | 与类普鲁士蓝材料复合 | [101] |
| 一种双掺杂硫酸铁钠正极材料及其制备方法和应用 | 本征电导率低 | 阴阳离子双掺杂 | [102] | |
| 一种硫酸铁钠材料及其制备方法和应用 | 空气稳定性差 | 非晶硫酸铁钠表面包覆 | [103] | |
| 一种硫酸铁钠及其制备方法和应用 | 振实密度 | 微波溶剂热反应 | [104] | |
| 一种自支撑正极及其制备方法和应用 | 本征电导率低 | 自支撑电极设计 | [105] | |
| 深圳市津工能源有限公司 | 一种碳包覆钾锆共掺杂的硫酸铁钠正极材料及其制备方法和应用 | 本征电导率低 | 多阳离子共掺杂 | [106] |
| 江苏众钠能源科技有限公司 | 一种复合正极材料、正极片及二次电池 | 比容量偏低、高温循环稳定性差 | 碳包覆磷酸焦磷酸铁钠材料包覆 | [107] |
| 一种复合钠离子正极材料、制备方法及钠离子电池 | 易生成杂质、本征电导率低 | 分层式结构设计 | [108] | |
| 一种碳包裹的硫酸铁钠正极材料及其制备方法 | 本征电导率低 | 氮化碳基材料包覆 | [109] | |
| 超威电源集团有限公司 | 一种表面改性的硫酸铁钠正极材料及其制备方法 | 空气稳定性差 | 疏水材料表面改性 | [97] |
| 贵州为方能源新材料科技有限公司 | 碳包覆掺杂铕的硫酸铁钠正极材料及其制备方法、钠离子电池和用电设备 | 本征电导率低 | 阳离子掺杂 | [110] |
| 格林美(无锡)能源材料有限公司 | 一种硫酸铁钠正极材料及其制备方法 | 本征电导率低 | 阳离子掺杂 | [111] |