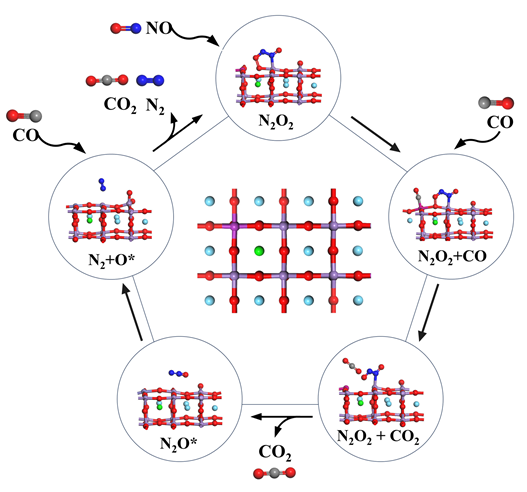
1 引言
2 结果与讨论
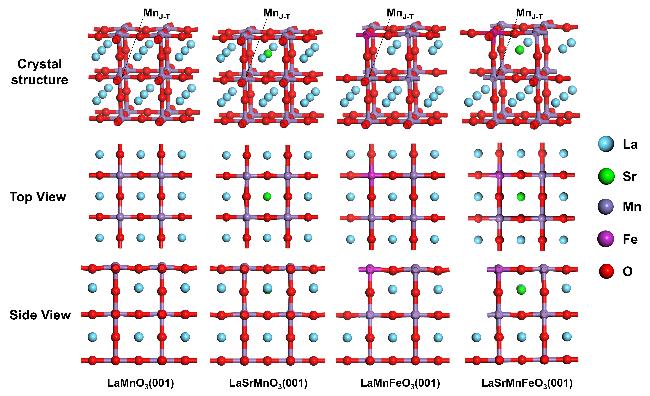
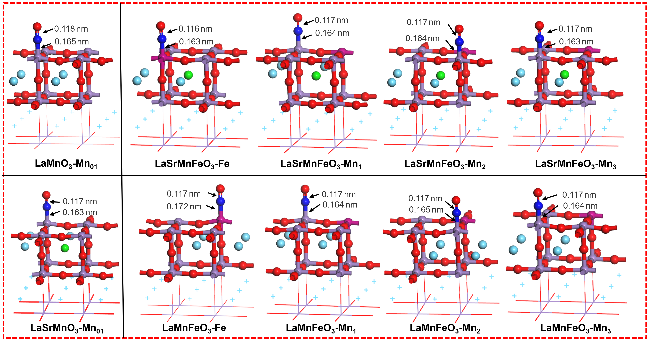
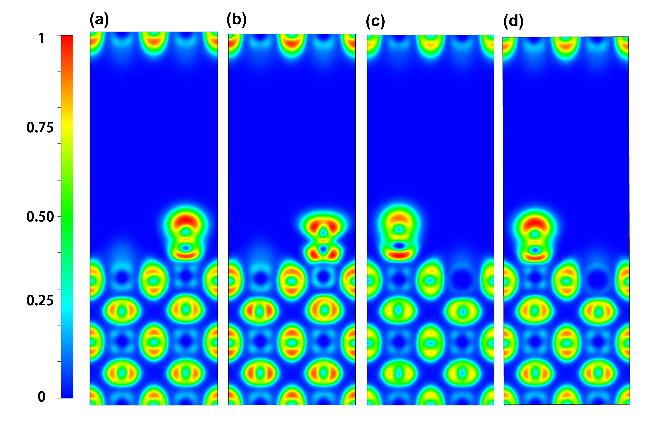
2.1 Sr/Fe掺杂体系计算模型的构建
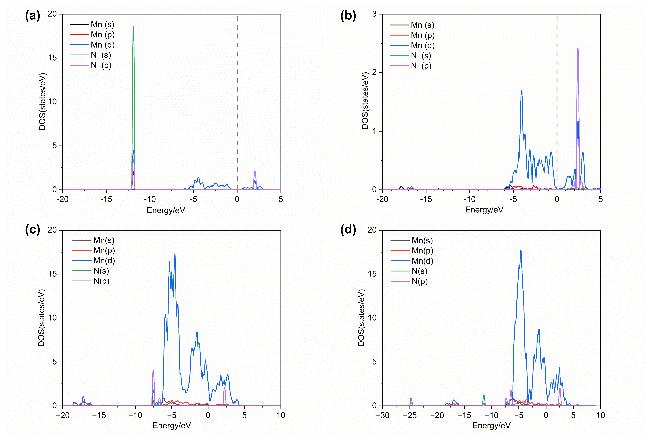
2.2 Sr/Fe掺杂对LaMnO3结构的影响
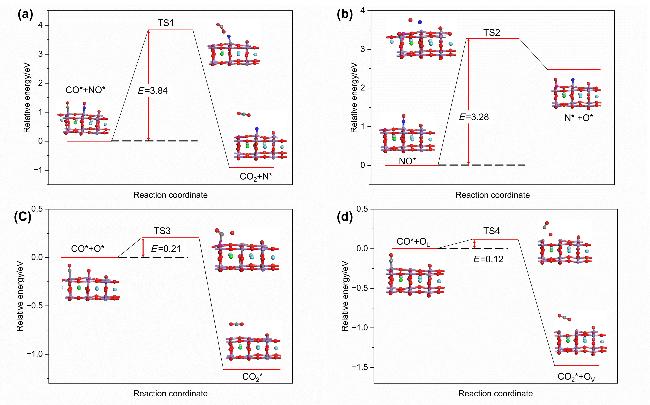
2.3 Sr/Fe掺杂对CO吸附性能的影响
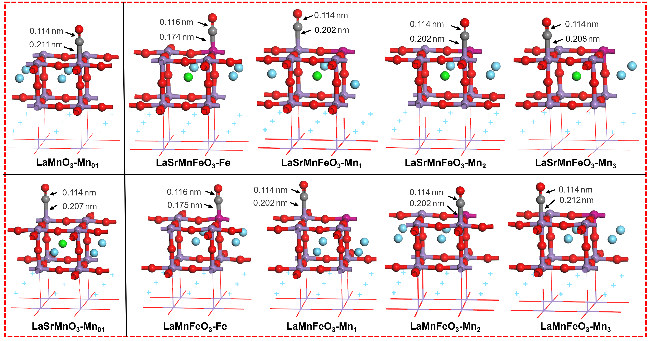
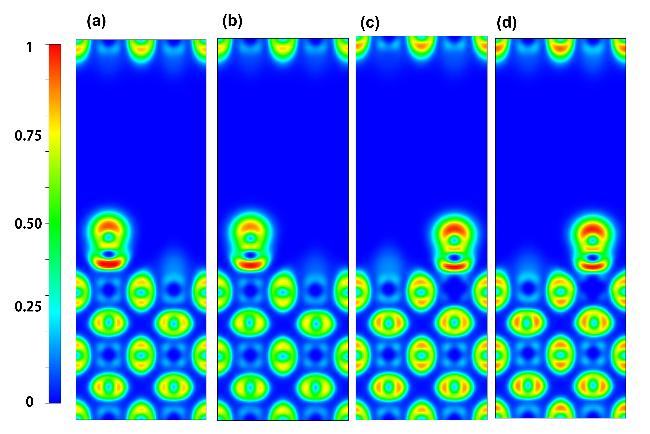
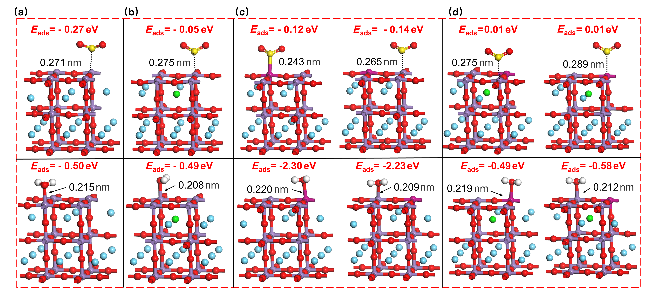
图2 CO在LaMnO3掺杂体系表面的吸附构型Figure 2 Adsorption configuration of CO on the surface of LaMnO3 doped system |
表1 CO在LaMnO3掺杂体系表面的吸附能和键长Table 1 Adsorption energy and bond length of CO on the surface of LaMnO3 doped system |
| dC-O/nm | dC-metal/nm | Eads/eV | |
|---|---|---|---|
| LaMnO3-CO-Mn01 | 0.114 | 0.211 | –0.35 |
| LaSrMnO3-CO-Mn01 | 0.114 | 0.207 | –0.44 |
| LaMnFeO3-CO-Mn1 | 0.114 | 0.202 | –0.43 |
| LaMnFeO3-CO-Mn2 | 0.114 | 0.202 | –0.43 |
| LaMnFeO3-CO-Mn3 | 0.114 | 0.212 | –0.30 |
| LaMnFeO3-CO-Fe | 0.116 | 0.175 | –0.85 |
| LaSrMnFeO3-CO-Mn1 | 0.114 | 0.202 | –0.49 |
| LaSrMnFeO3-CO-Mn2 | 0.114 | 0.202 | –0.41 |
| LaSrMnFeO3-CO-Mn3 | 0.114 | 0.208 | –0.31 |
| LaSrMnFeO3-CO-Fe | 0.116 | 0.174 | –0.63 |
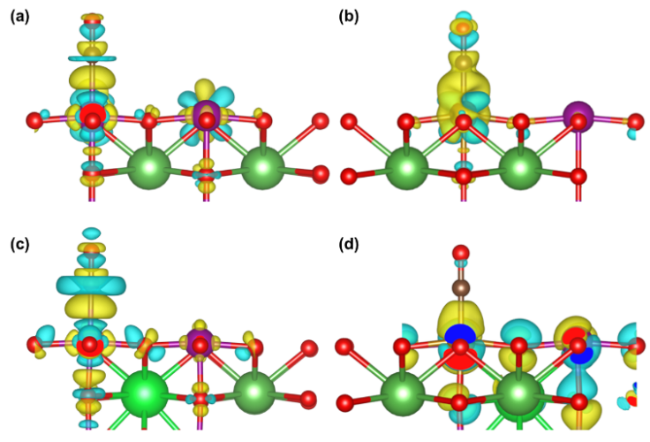
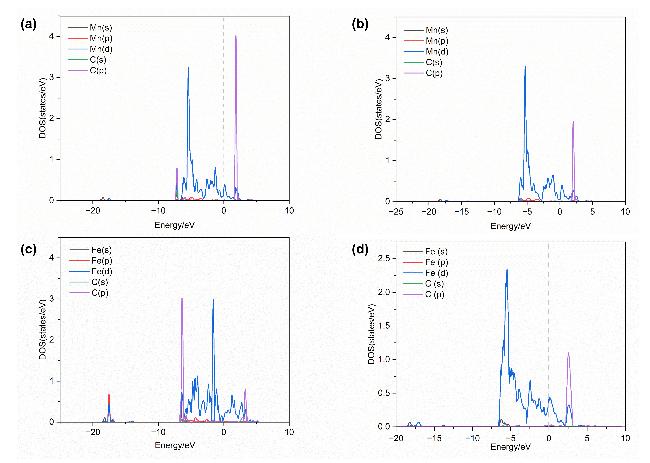
表2 LaMnO3掺杂体系最佳CO吸附构型的Bader电荷Table 2 Bader charge for optimal CO adsorption configuration of LaMnO3 doping system |
| Q(Sr)/e | Q(Fe)/e | Q(C)/e | Q(O)/e | Q(Mn/Fe)/e | ΔQCO/e | |
|---|---|---|---|---|---|---|
| LaMnO3-CO | — | — | –0.292 | 0.246 | –1.659 | –0.046 |
| LaSrMnO3-CO | –1.659 | — | –0.061 | 0.022 | –1.710 | –0.039 |
| LaMnFeO3-CO | — | –1.364 | –0.120 | 0.238 | –1.544 | 0.118 |
| LaSrMnFeO3-CO | –1.660 | –1.436 | –0.126 | 0.236 | –1.608 | 0.110 |
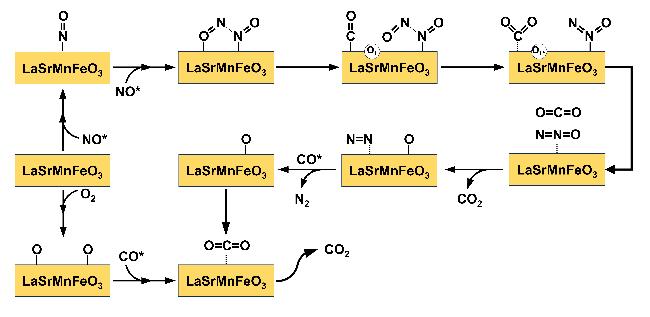
2.4 Sr/Fe掺杂对NO吸附性能的影响
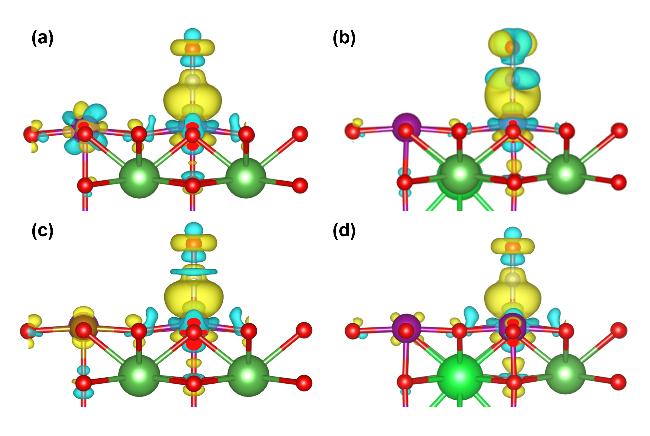
图6 NO在LaMnO3掺杂体系表面的吸附构型Figure 6 Adsorption configuration of NO on the surface of LaMnO3 doped system (a) LaMnO3, (b) LaSrMnO3, (c) LaMnFeO3, (d) LaSrMnFeO3. |
表3 NO在LaMnO3掺杂体系表面的吸附能和键长Table 3 Adsorption energy and bond length of NO on the surface of LaMnO3 doped system |
| dN-O/nm | dN-metal/nm | Eads/eV | |
|---|---|---|---|
| LaMnO3-NO-Mn01 | 0.118 | 0.165 | –1.88 |
| LaSrMnO3-NO-Mn01 | 0.117 | 0.163 | –1.76 |
| LaMnFeO3-NO-Mn1 | 0.117 | 0.164 | –1.93 |
| LaMnFeO3-NO-Mn2 | 0.117 | 0.165 | –1.93 |
| LaMnFeO3-NO-Mn3 | 0.117 | 0.164 | –1.83 |
| LaMnFeO3-NO-Fe | 0.117 | 0.172 | –1.85 |
| LaSrMnFeO3-NO-Mn1 | 0.117 | 0.164 | –1.79 |
| LaSrMnFeO3-NO-Mn2 | 0.117 | 0.164 | –1.78 |
| LaSrMnFeO3-NO-Mn3 | 0.117 | 0.163 | –1.74 |
| LaSrMnFeO3-NO-Fe | 0.116 | 0.163 | –1.54 |
表4 LaMnO3掺杂体系最佳NO吸附构型的Bader电荷Table 4 Bader charge for optimal NO adsorption configuration of LaMnO3 doping system |
| Q(Sr)/e | Q(Fe)/e | Q(N)/e | Q(O)/e | Q(Mn)/e | ΔQNO/e | |
|---|---|---|---|---|---|---|
| LaMnO3-NO | — | — | 0.112 | 0.135 | –1.636 | 0.245 |
| LaSrMnO3-NO | –1.664 | — | 0.106 | 0.126 | –1.634 | 0.226 |
| LaMnFeO3-NO | — | –1.601 | 0.110 | 0.146 | –1.641 | 0.256 |
| LaSrMnFeO3-NO | –1.658 | –1.591 | 0.148 | 0.101 | –1.698 | 0.249 |