

Application of Michael/Aldol Cascade Cyclization Reactions in Natural Product Synthesis
Received date: 2025-07-05
Online published: 2025-08-25
Supported by
Shanghai Science and Technology Plan Project(22YS1401000)
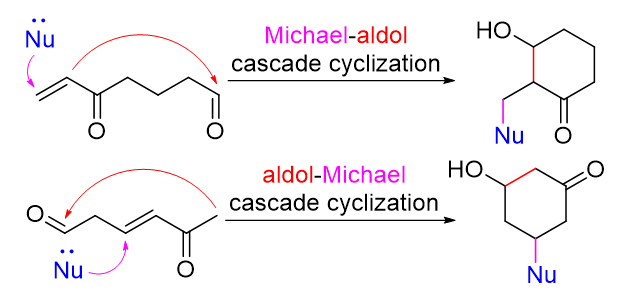
In modern natural product synthesis, chemists are often able to execute two or even multiple chemical reactions to occur in one pot by designing substrate structures and screening reaction conditions, thus to synthesize target molecules in a concise and efficient manner. Such a reaction sequence is termed a cascade reaction. Michael addition and aldol reaction are the two most applied classic reactions in organic synthesis. By regulating the reaction conditions and designing the substrates, they can occur successively in the same system to form complex cyclic systems. This cascade reaction is termed Michael/aldol cascade cyclization reaction, which can effectively improve the atomic and step economy of a synthesis. This review comprises more than 40 reported studies on natural product synthesis as examples to summarize nine common types of Michael/aldol cascade cyclization reactions, to demonstrate their applications as key steps in complex natural product synthesis, and to outlook on the direction of further developments of this methodology.
Zhao Yachen , Yu Biao . Application of Michael/Aldol Cascade Cyclization Reactions in Natural Product Synthesis[J]. Acta Chimica Sinica, 2025 , 83(11) : 1397 -1413 . DOI: 10.6023/A25070247
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
(张明美, 沙风, 伍新燕, 有机化学, 2025, 45, 1369.)
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
(何倩, 李杰, 喻思佳, 吴东坪, 叶剑良, 黄培强, 化学学报, 2023, 81, 1265.)
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
(代义华, 申艳芳, 高栓虎, 有机化学, 2018, 38, 1608.)
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
/
| 〈 |
|
〉 |