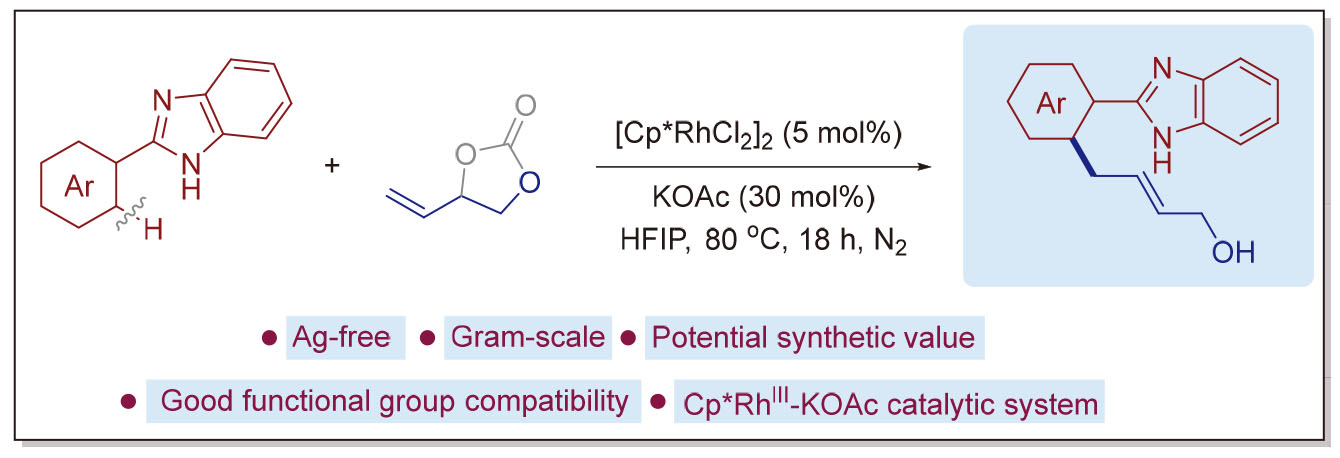
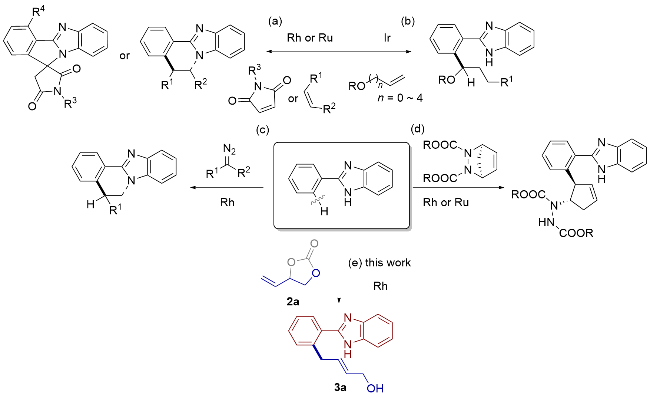
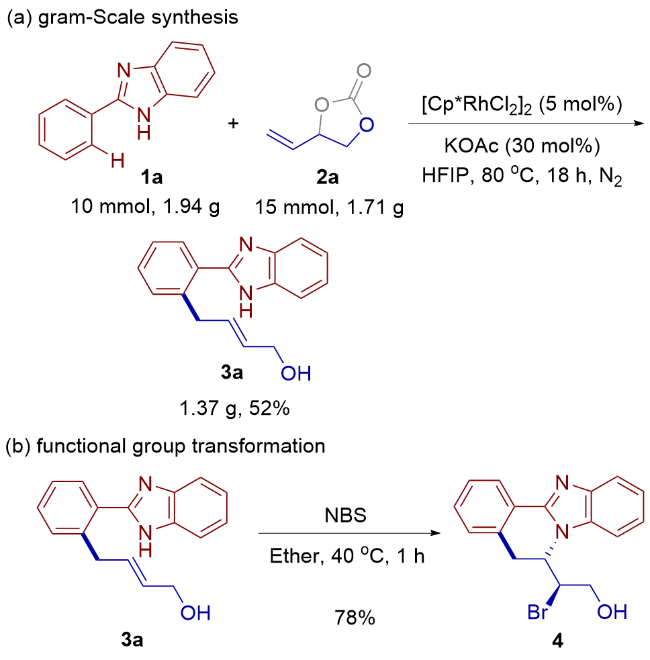
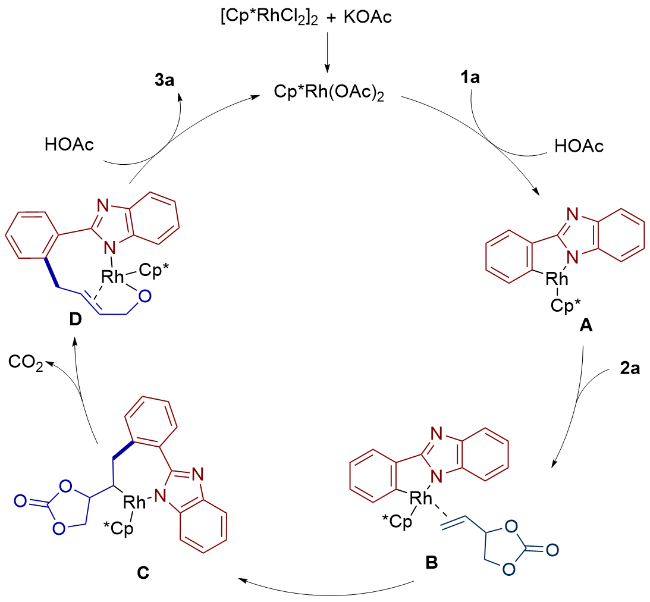
1 引言
2 结果与讨论
2.1 反应条件优化
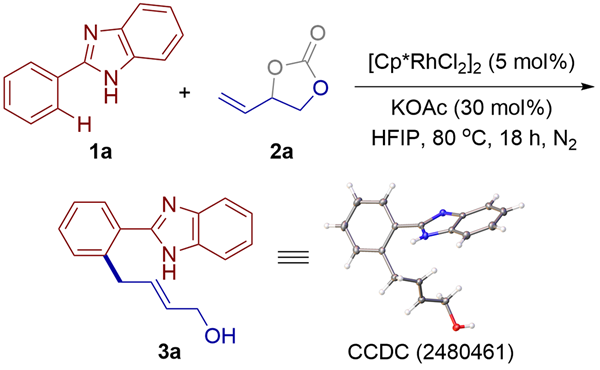
表1 反应条件的筛选aTable 1 Screening reaction conditons a |
| Entry | Deviation from optimal conditons | Yieldb/% |
|---|---|---|
| 1 | none | 61 |
| 2 | [Ru(p-cymene)Cl2]2 instead of [Cp*RhCl2]2 | 0 |
| 3 | HOAc or Na2CO3 instead of KOAc | 0 |
| 4 | NaOtBu instead of KOAc | 35 |
| 5 | K2CO3 instead of KOAc | 38 |
| 6 | Toluene or DMSO instead of HFIP | 0 |
| 7 | CH3CN instead of HFIP | 11 |
| 8 | THF instead of HFIP | 11 |
| 9 | 40 ℃ | 28 |
| 10 | 120 ℃ | 50 |
| 11 | under air | 50 |
| 12 | without [Cp*RhCl2]2 or KOAc | 0 |
a Reaction conditions: 1a (0.2 mmol), 2a (0.3 mmol), catalyst (5.0 mol%), KOAc (30 mol%), HFIP (1.5 mL), 18 h under N2; b Isolated yields. |
2.2 反应底物拓展
表2 底物范围aTable 2 Substrate scope a |
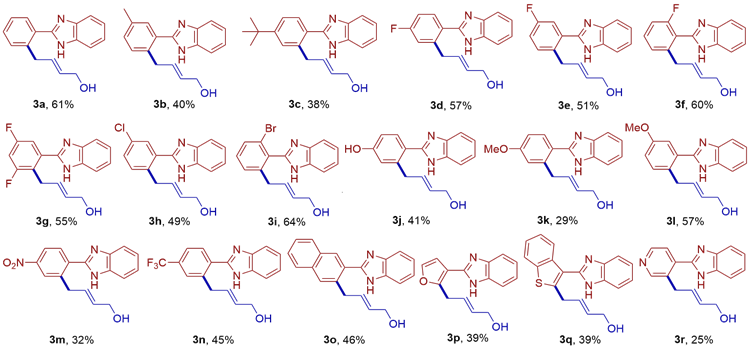 |
a Reaction conditions: 1 (0.2 mmol), 2 (0.3 mmol), catalyst (5.0 mol%), KOAc (30 mol%), HFIP (1.5 mL), 18 h under N2; Isolated yields. |