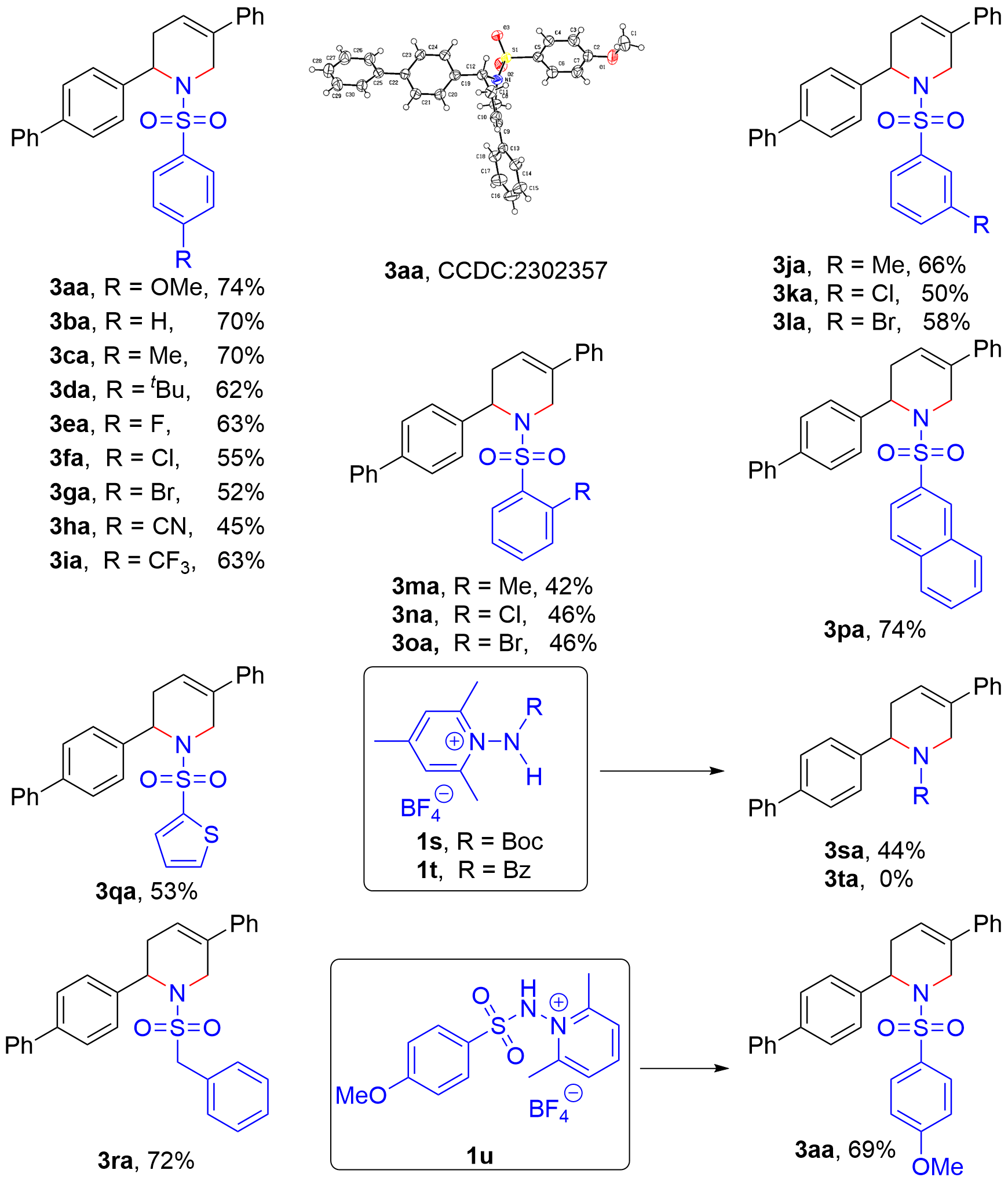
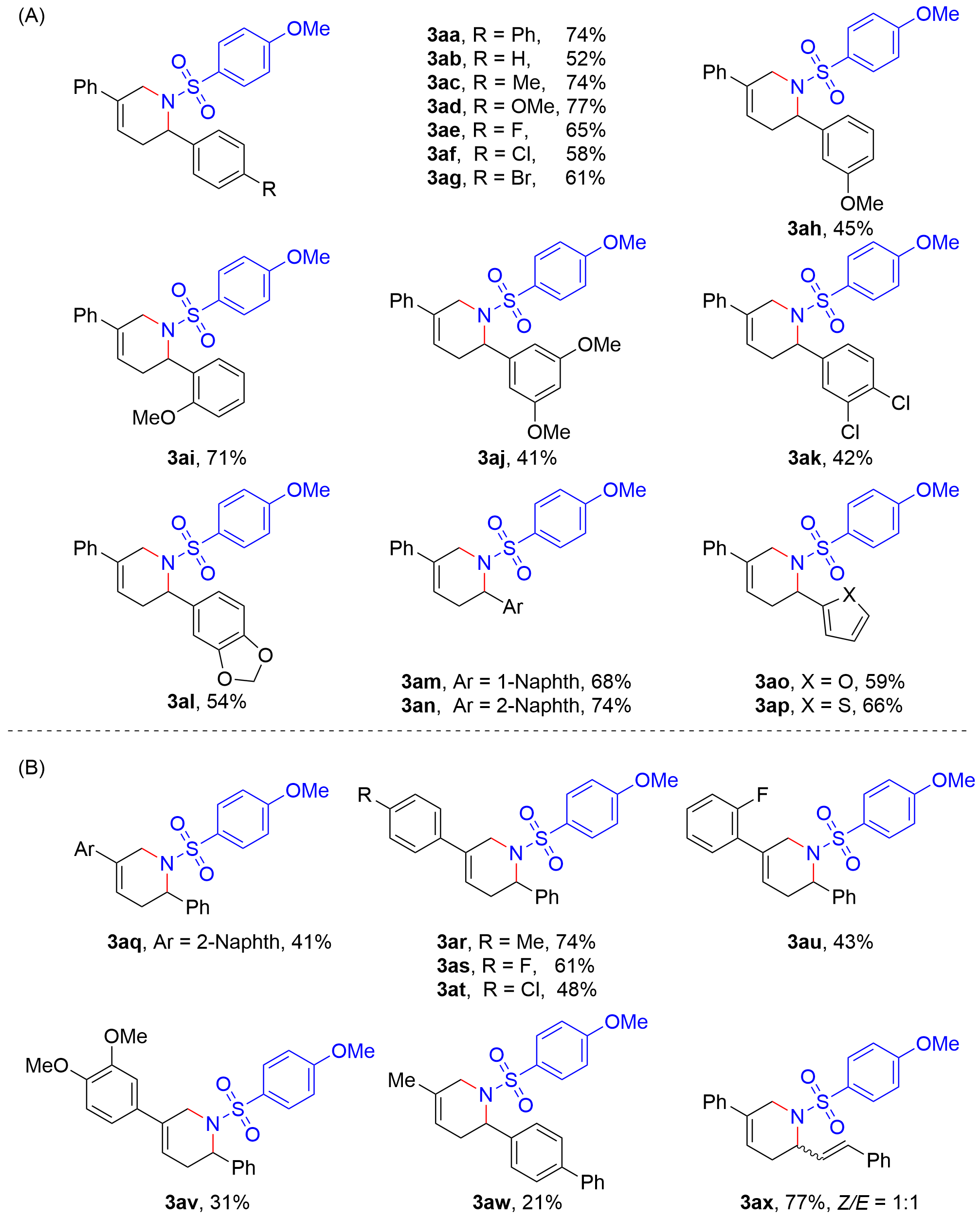
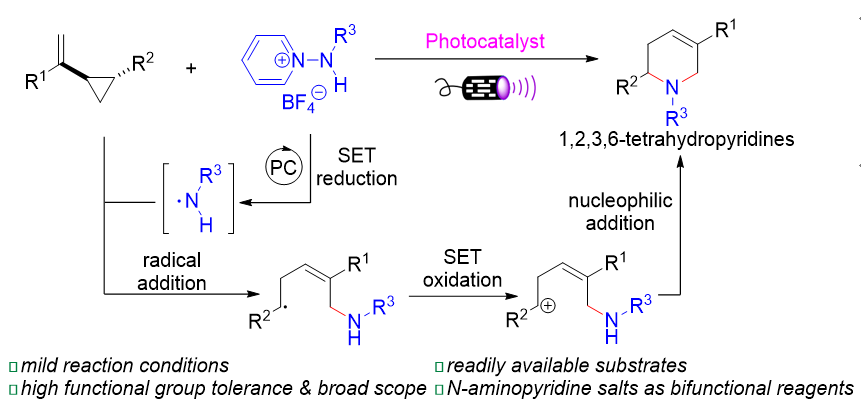
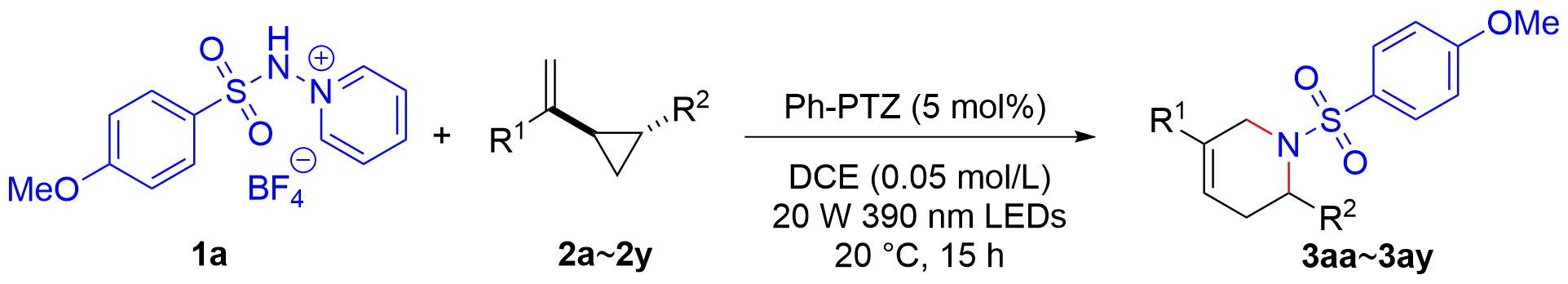| [8] |
(a) Zhao Y.; Xing T.-T.; Duan Y.-R.; Zhao Q.-Q. Acta Chim. Sinica 2025, 83, 773 (in Chinese).
DOI
(赵瑜, 邢彤彤, 段玉荣, 赵全庆, 化学学报, 2025, 83, 773.)
DOI
(b) Zhang G.-H.; Yu R.-X.; Chen Y.-G. Chin. J. Org. Chem. 2025, 45, 1548 (in Chinese).
DOI
(张艮红, 余若曦, 陈跃刚, 有机化学, 2025, 45, 1548.)
DOI
(c) Wang C.-R.; Zhang W.-Y.; Yu C.; Li Y.; Li J.-H. Chin. J. Chem. 2025, 43, 3676.
DOI
(d) Jiang X.; Han X.; Lu F.-D.; Lu L.-Q.; Zuo Z.; Xiao W.-J. CCS Chem. 2025, 7, 1567.
DOI
(e) Romero N. A.; Nicewicz D. A. Chem. Rev. 2016, 116, 10075.
DOI
(f) Peng Q.-H.; Peng J.; Cai Y.-L.; Wang Z.-L.; Yi R.-N.; Shen C.; He W.-M. Acta Chim. Sinica 2025, 83, 1013 (in Chinese).
DOI
(彭琼慧, 彭佳, 蔡迎丽, 王祖利, 易荣楠, 沈超, 何卫民, 化学学报, 2025, 83, 1013.)
DOI
(g) Li W.-J.; Yang L.-Y.; Guan L.; Zhang X.-J.; You J.; Shen S.-Y.; Zhao Y.-Q.; Duan C. Acta Chim. Sinica 2025, 83, 596 (in Chinese).
DOI
(李文静, 杨黎燕, 关丽, 张雪娇, 尤静, 沈思语, 赵钰琦, 段琛, 化学学报, 2025, 83, 596.)
DOI
(h) Wang W.-S.; Liu Y.; Qiu G.-H.; Krylov I. B.; Terent’ev A. O.; Cao S.-X.; Sun K.; Chen X.-L.; Qu L.-B.; Yu B. Chin. J. Chem. 2025, 43, 1664.
DOI
(i) Yang L.; Pan Y.; Zhang P.; Shi L.-P.; Huang S.; Shu Y.-J.; Zhang Z.-J.; Gong Y.-M.; Wang L.; Lau K.-C.; Fu Q. Chin. J. Chem. 2025, 43, 1129.
DOI
(j) Xin C.; Jiang J.; Deng Z.-W.; Ou L.-J.; He W.-M. Acta Chim. Sinica 2024, 82, 1109 (in Chinese).
DOI
(辛翠, 蒋俊, 邓紫微, 欧丽娟, 何卫民, 化学学报, 2024, 82, 1109.)
DOI
(k) Gui Q.-W.; Teng F.; Li Z.-C.; Xiong Z.-Y.; Jin X.-F.; Lin Y.-W.; Cao Z.; He W.-M. Chin. Chem. Lett. 2021, 32, 1907.
DOI
(l) Ji H.-T.; Wang K.-L.; Ouyang W.-T.; Luo Q.-X.; Li H.-X.; He W.-M. Green Chem. 2023, 25, 7983.
DOI
|