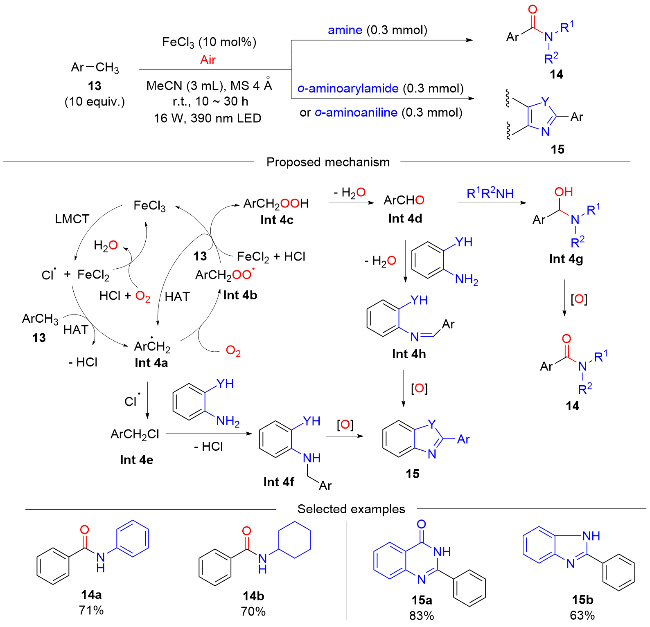
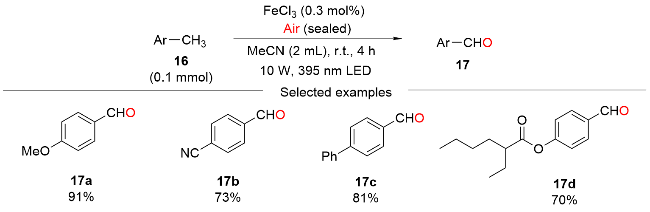
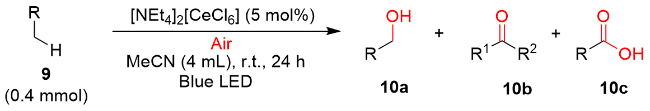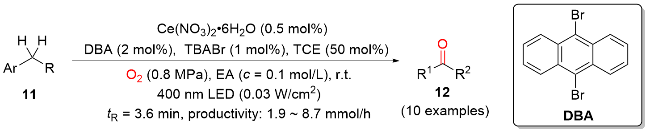1 过渡金属配合物光催化剂催化的HAT介导C(sp3)—H键氧化反应
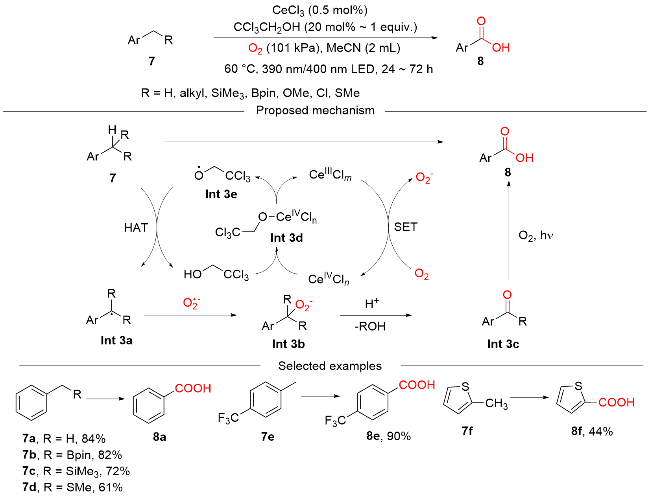
图式3 CeCl3光催化HAT介导苄基C(sp3)—H键氧化反应Scheme 3 Photocatalytic HAT-mediated benzylic C(sp3)—H oxidation using CeCl3 as a photocatalyst |
图式4 [NEt4]2[CeCl6]光催化HAT介导苄基C(sp3)—H键氧化反应Scheme 4 Photocatalytic HAT-mediated benzylic C(sp3)—H oxidation using [NEt4]2[CeCl6] as a photocatalyst |
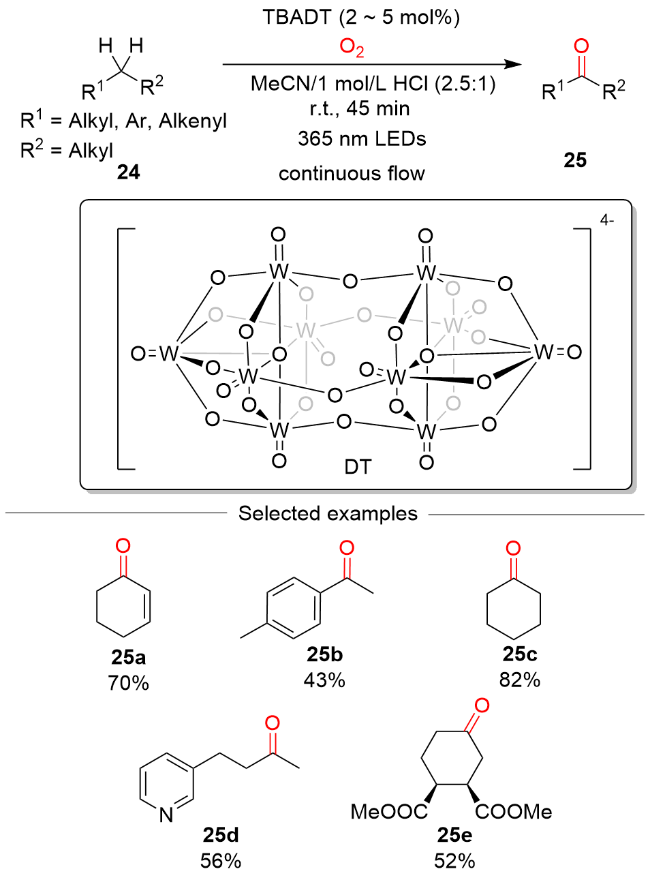
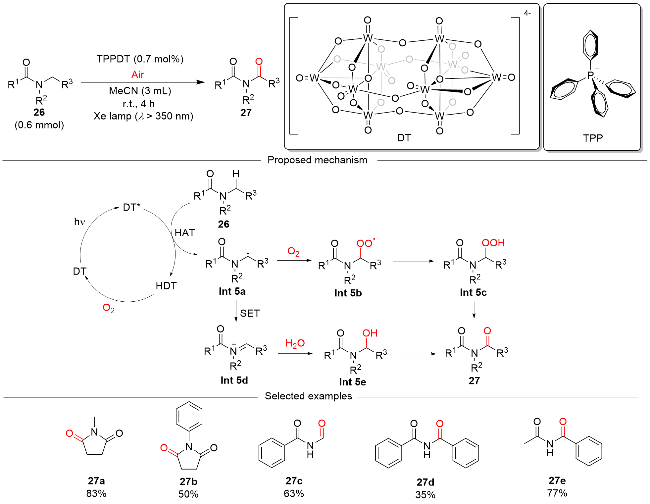
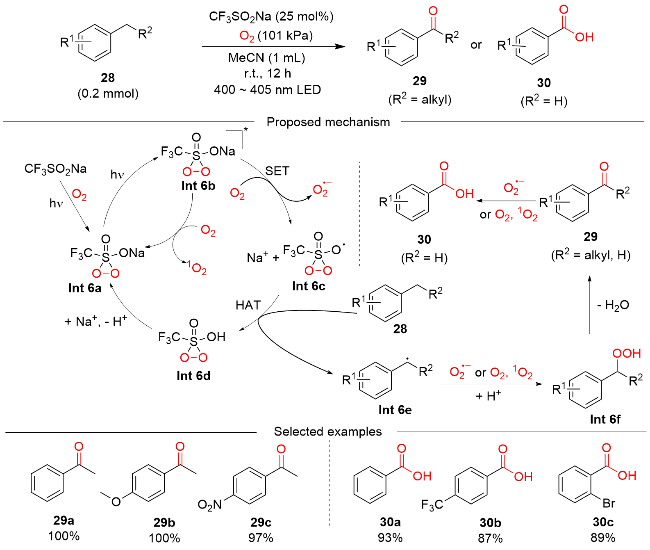
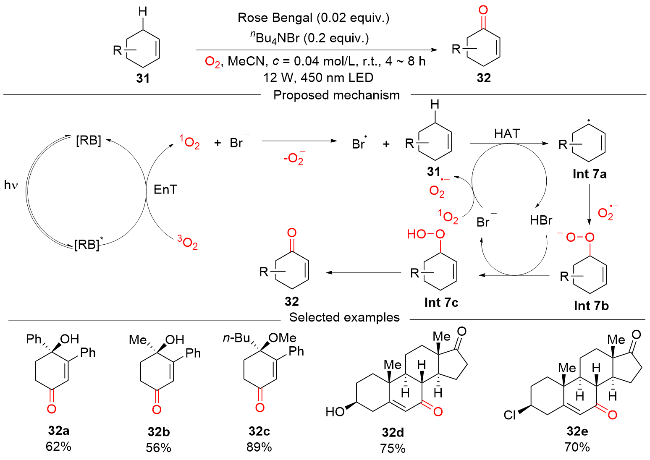
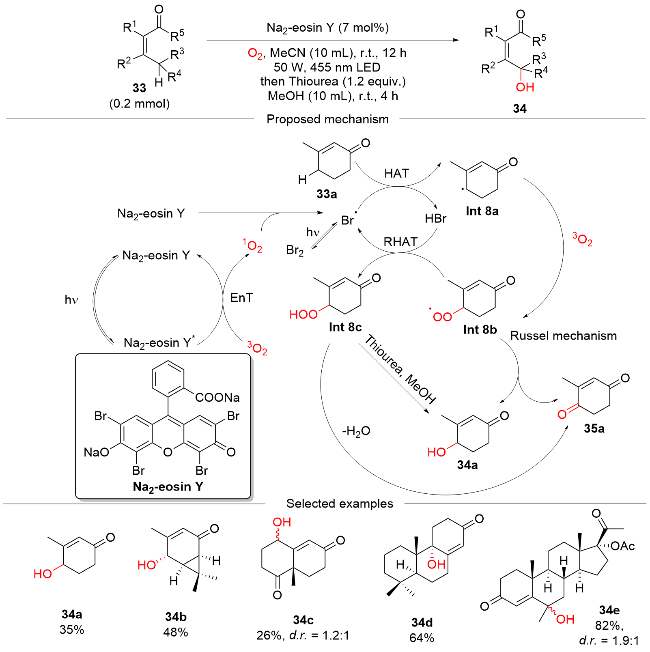
图式9 DT催化的可见光介导烯丙基、苄基和非活化 C(sp3)—H键氧化反应Scheme 9 DT-catalyzed visible light-mediated oxidation of allylic, benzylic, and unactivated C(sp3)—H bonds |
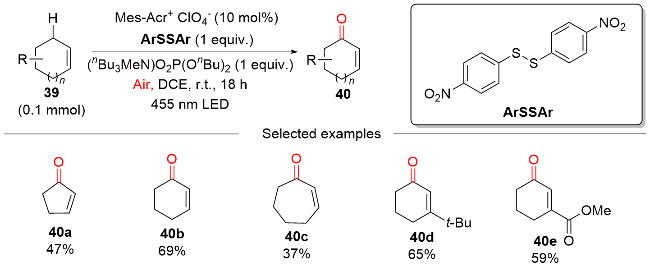
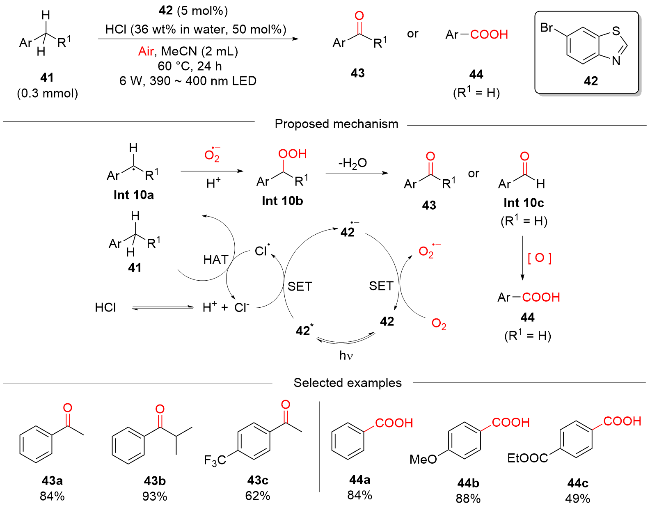
2 非金属光催化剂催化的HAT介导C(sp3)—H键氧化反应
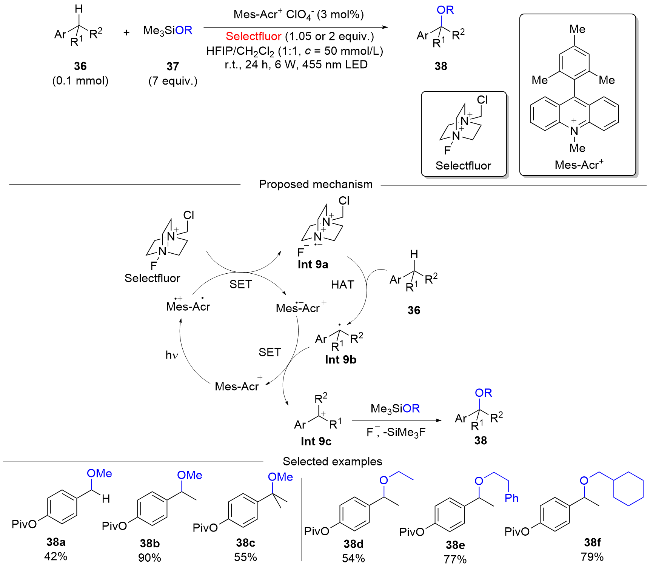
图式14 Mes-Acr+ClO4-光催化HAT介导苄基C(sp3)—H键的烷氧基化反应Scheme 14 Photocatalytic HAT-mediated alkoxylation of benzylic C(sp3)—H bonds using Mes-Acr+ClO4- as a photocatalyst |