1 引言
2 结果与讨论
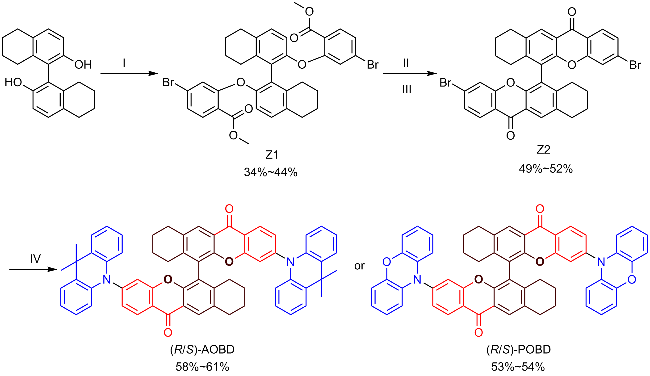
2.1 合成与表征
图1 AOBD和POBD的合成路线Figure 1 Synthetic routes of AOBD and POBD (I) Methyl 4-bromo-2-fluorobenzoate, dimethylformamide, K2CO3, 110 ℃, N2, 12 h; (II) KOH, 4-dioxane, r.t., 12 h; (III) Trifluoroacetic acid, Trifluoroacetic anhydride, r.t., 12 h; (IV) Phenoxazine or 9,10-dihydro-9,9-dimethylacridine, t-BuOK, Pd(OAc)2, t-Bu3PHBF4, toluene, 110 ℃, N2, 12 h. |
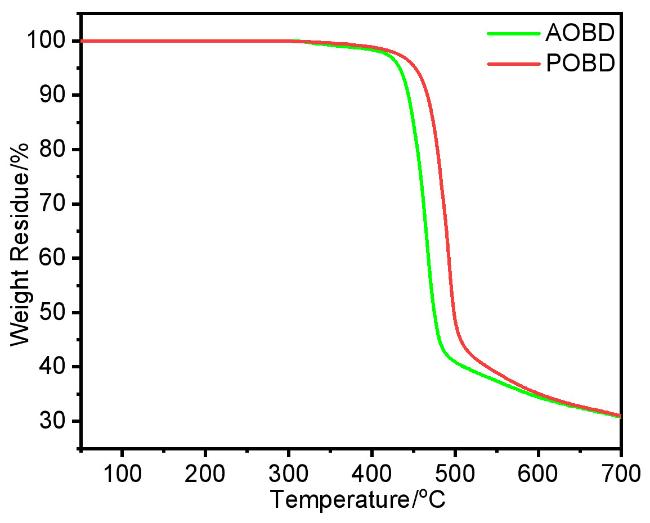
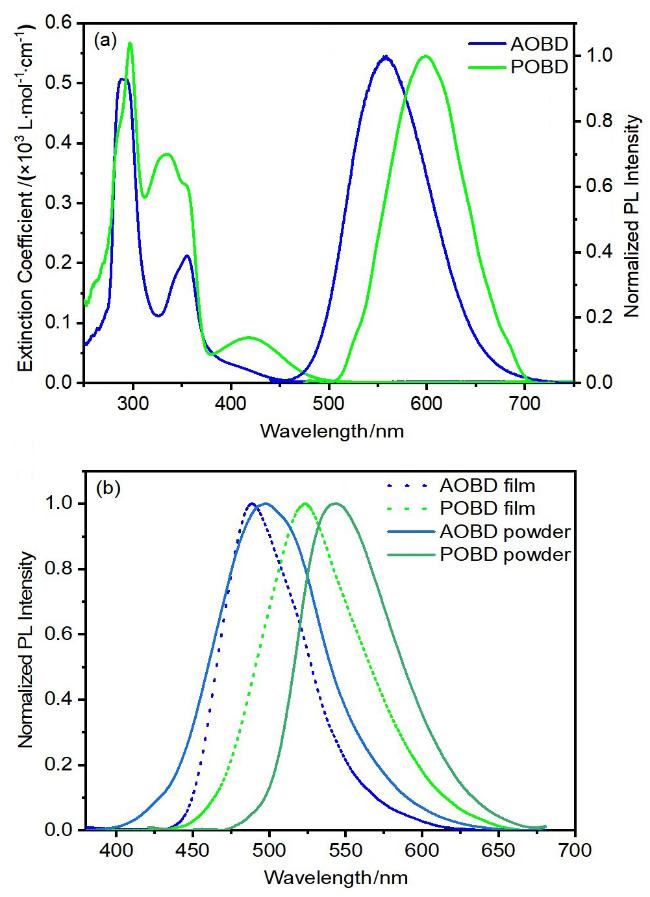
2.2 热物理性质和光物理性质
图3 AOBD和POBD的紫外-可见吸收和光致发光光谱: (a) CH2Cl2中AOBD和POBD紫外-可见吸收光谱图; (b)固体和1% (w) PMMA膜的光致发光光谱Figure 3 UV-Vis absorption and photoluminescence spectra of AOBD and POBD: (a) UV-Vis absorption spectra of AOBD and POBD in CH2Cl2; (b) Photoluminescence spectra of solid and 1% (w) PMMA films |
表1 AOBD和POBD的物理特性Table 1 Physical characteristics of AOBD and POBD |
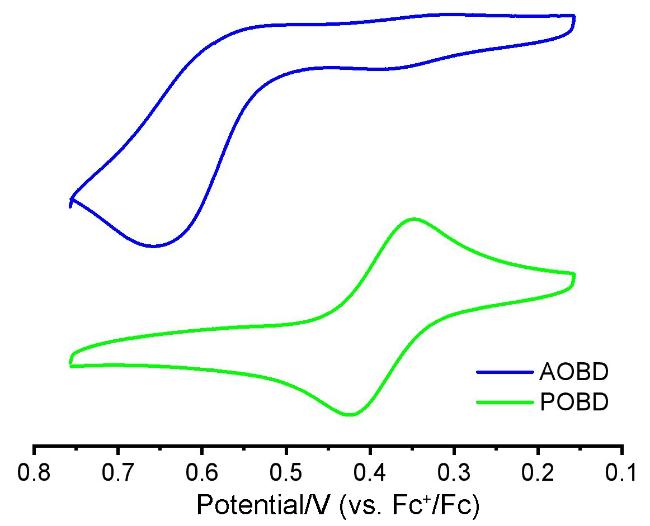
| Sample | λema/nm | Φb/% | τpromptb/μs | τdelayedb/ns | Rdelayedb/% | ∆EST c/eV | E1/2ox d/V | HOMOe/eV | LUMOf/eV | (Td/Tg)/℃ |
|---|---|---|---|---|---|---|---|---|---|---|
| R-AOBD | 559 (489) | 34 | 0.38 | 24.0 | 15 | 0.051 | 0.559 | –5.359 | –2.743 | 433/152 |
| R-POBD | 599 (524) | 43 | 1.14 | 29.8 | 30 | 0.056 | 0.386 | –5.186 | –2.755 | 452/258 |
a PL spectra were recorded in CH2Cl2 (PMMA films at a conc. of 1% (w)) at r.t. b Quantum yields and lifetime were recorded in PMMA films at a conc. of 1% (w) at r.t. c Measured at 77 K. d E1/2ox refers to [(Epa+Epc)/2], where Epc and Epa are the cathodic and anodic peak potentials referenced to the Fc+/Fc couple in CH2Cl2. e HOMO=–4.8–E1/2ox. f LUMO=HOMO+Egopt. Egopt was estimated from the absorption edge. |
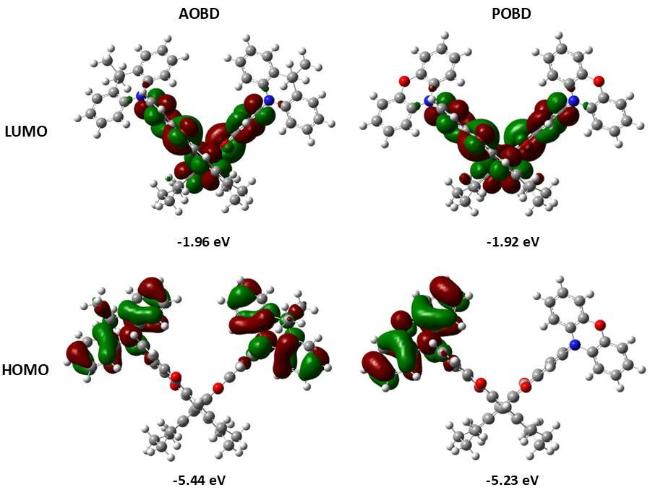
2.3 电化学性质和理论计算
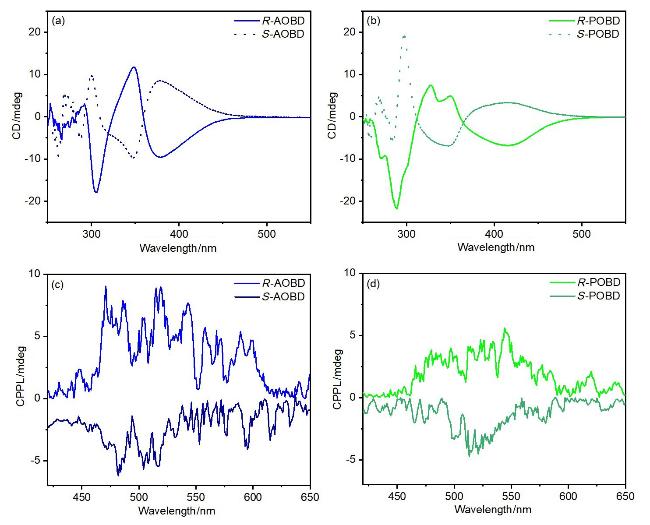
2.4 手性发光性质
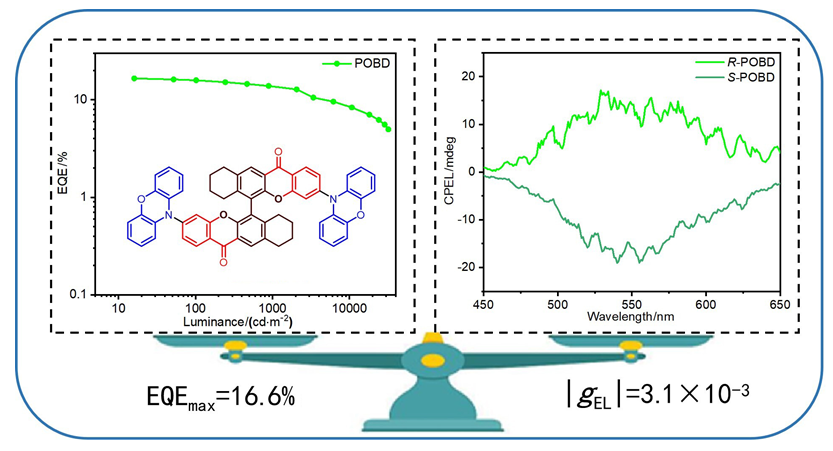
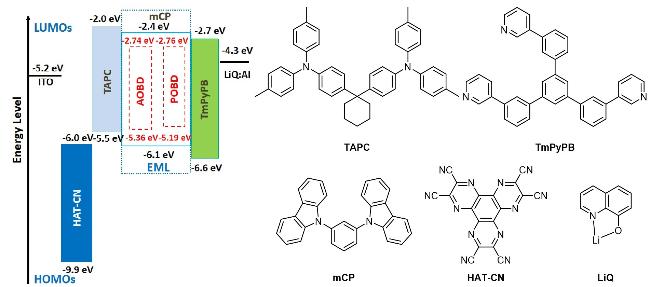
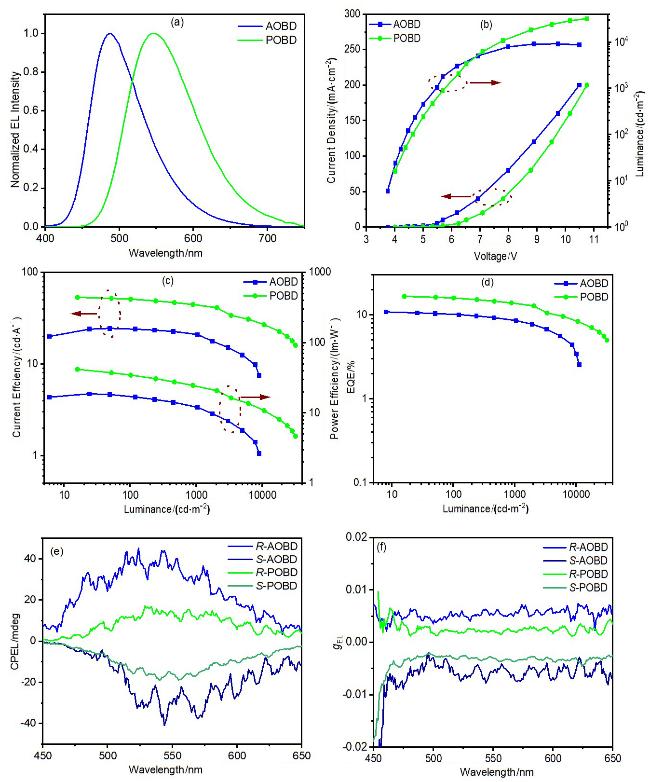
2.5 电致发光特性
图8 AOBD和POBD器件DA (AOBD)和DP (POBD)的特性曲线: (a)电致发光光谱; (b)电流密度-电压-亮度曲线; (c)电流效率-亮度-功率效率曲线; (d) EQE-亮度曲线; (e) CPEL光谱; (f) gEL值-波长曲线Figure 8 Character curves of AOBD and POBD devices DA (AOBD) and DP (POBD): (a) Electroluminescent spectra; (b) Current density-voltage- luminance curves; (c) Current efficiency-luminance-power efficiency curves; (d) EQE-luminance curves; (e) CPEL spectra; (f) gEL values-wavelength curves |
表2 AOBD和POBD器件发光和效率数据Table 2 AOBD and POBD device luminescence and efficiency data |
| Device (dopant) | λEL/nm | Vona/V | Lb/(cd•m-2) | CEc/(cd•A-1) | PEc/(lm•W-1) | EQEc/% | CIEd (x, y) |
|---|---|---|---|---|---|---|---|
| DA (AOBD) | 488 | 3.8 | 9118 | 24.5 (21.4) | 18.7 (12.3) | 10.6 (8.6) | (0.22, 0.42) |
| DP (POBD) | 548 | 4.0 | 32010 | 53.3 (44.1) | 41.7 (24.3) | 16.6 (13.7) | (0.41, 0.55) |
a Turn on voltages at 1 cd•m-2; b Maximum luminance. c Maximum efficiency (efficiency at 1000 cd•m-2); d CIE coordinates at 7 V. |