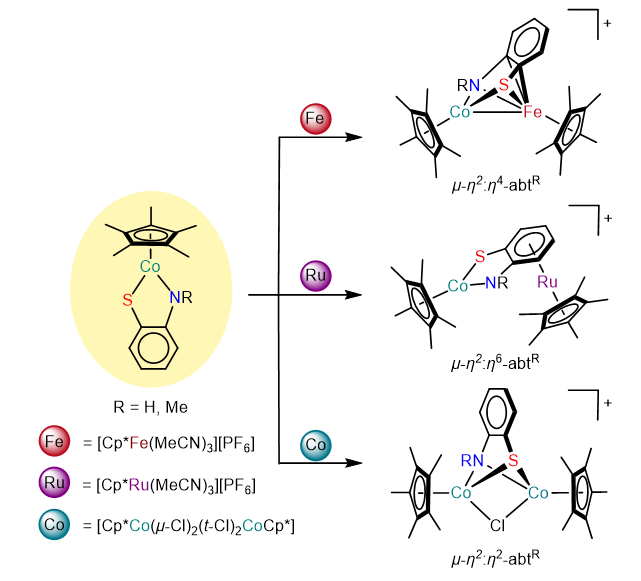
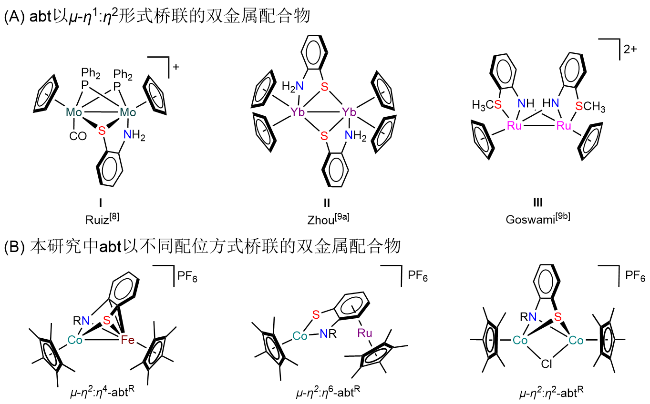
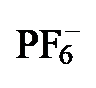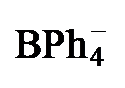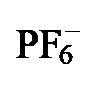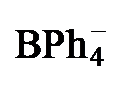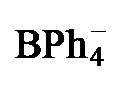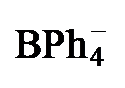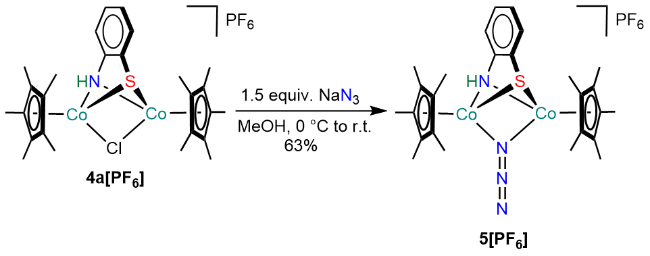1 引言
2 结果与讨论
2.1 邻氨基苯硫酚桥联双核配合物的合成与表征
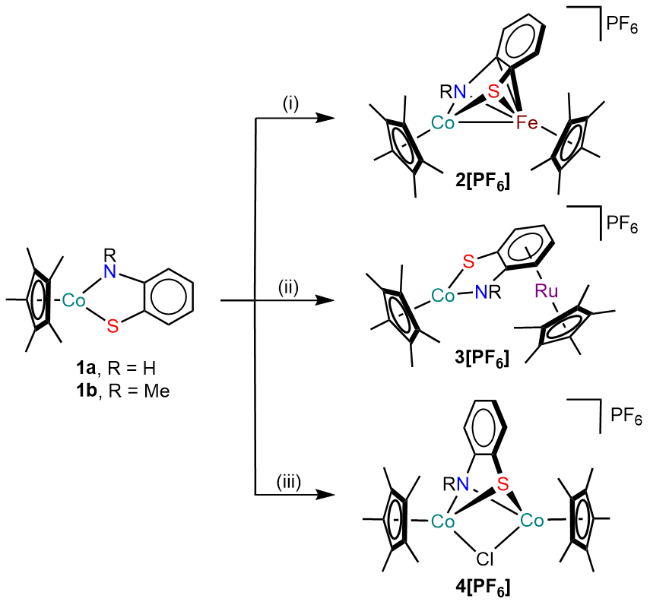
图2 配合物2[PF6]、3[PF6]和4[PF6]的合成aFigure 2 Synthesis of complexes 2[PF6], 3[PF6] and 4[PF6]a a Reaction conditions: (i) 1 equiv. [Cp*Fe(MeCN)3][PF6], CH2Cl2, -78 ℃ to r.t., 91% for 2a[PF6] and 92% for 2b[PF6]; (ii) 1 equiv. [Cp*Ru(MeCN)3]- [PF6], CH2Cl2, -78 ℃ to r.t., 98% for 3a[PF6] and 95% for 3b[PF6]; (iii) 1 equiv. [Cp*Co(μ-Cl)2(t-Cl)2CoCp*], 1 equiv. KPF6, MeOH, -78 ℃ to r.t., 82% for 4a[PF6] and 94% for 4b[PF6] |
2.1.1 异核配合物的合成与表征
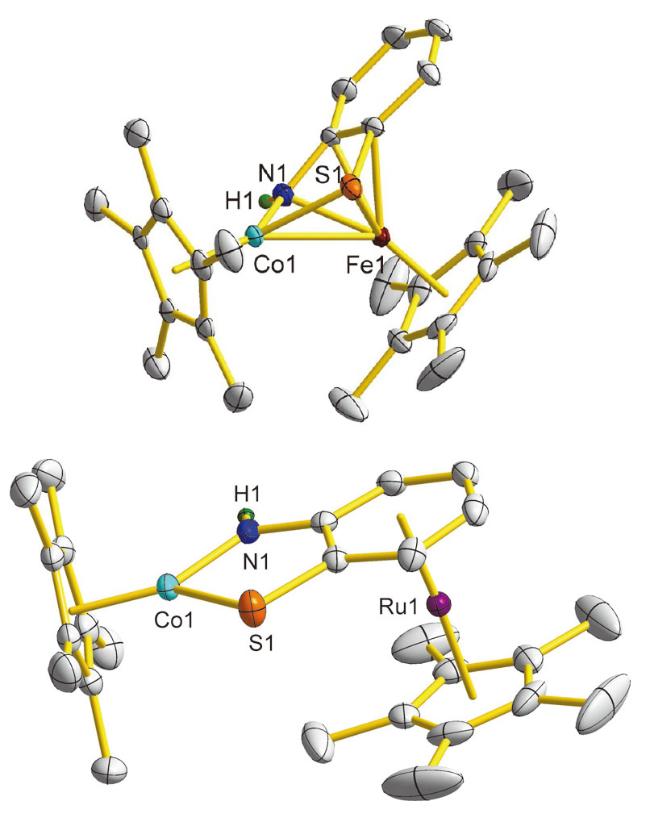
表1 配合物2[PF6]和3[BPh4]的主要结构数据Table 1 Main structural data of complexes 2[PF6] and 3[BPh4] |
| 2a[PF6] | 2b[PF6] | 3a[BPh4] | 3b[BPh4] | |
|---|---|---|---|---|
| 距离/nm | ||||
| Co…Fe | 0.25925(9) | 0.26156(6) | — | — |
| Co—N | 0.1872(5) | 0.1903(2) | 0.1858(3) | 0.1757(8) |
| Co—S | 0.2157(2) | 0.21589(8) | 0.2157(1) | 0.2191(3) |
| Co—Cp* | 0.16693(7) | 0.16807(5) | 0.16485(4) | 0.16763(7) |
| Fe/Ru—Cp* | 0.16869(7) | 0.16921(6) | 0.18099(4) | 0.18011(5) |
| 二面角/(°) | ||||
| Cp*1∠Cp*2 | 59.9(3) | 56.8(1) | 87.6(2) | 87.8(6) |
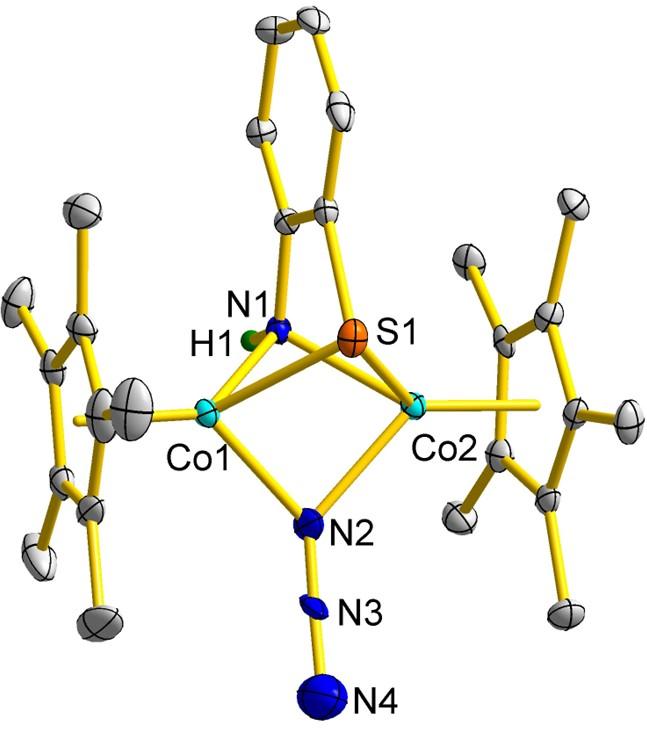
2.1.2 同核配合物的合成与表征
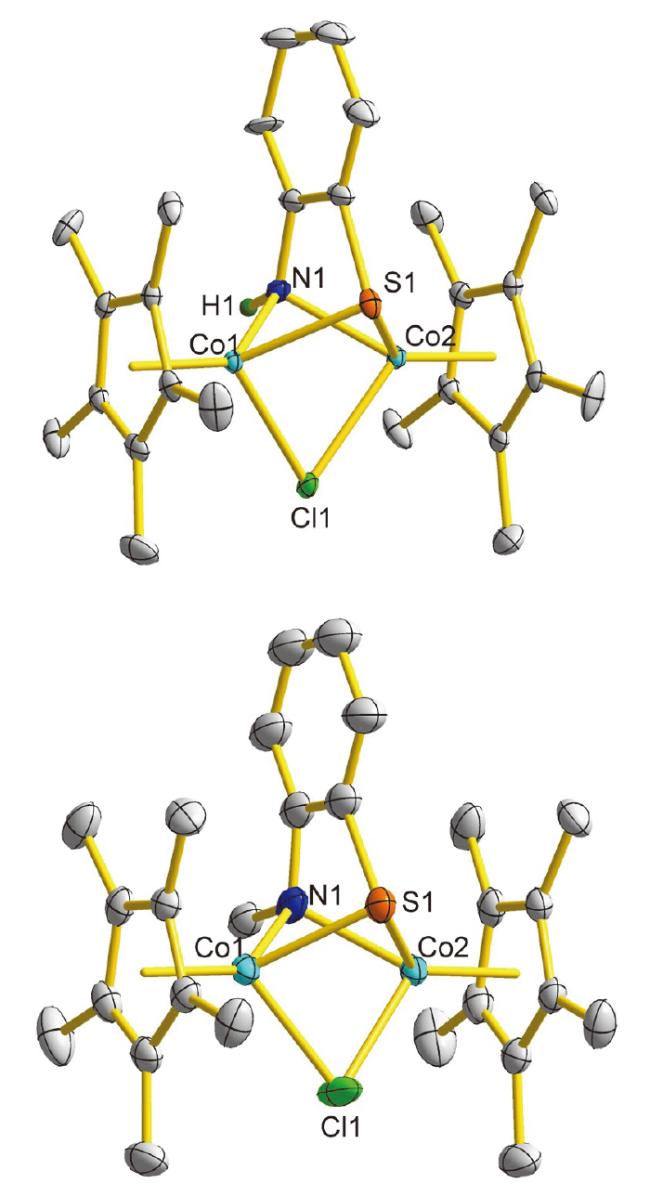
表2 配合物4a[BPh4]和4b[BPh4]的主要结构数据Table 2 Main structural data of complexes 4a[BPh4] and 4b[BPh4] |
| 4a[BPh4] | 4b[BPh4] | |
|---|---|---|
| 距离/nm | ||
| Co…Co | 0.27839(7) | 0.2805(1) |
| Co—N | 0.1992(3) | 0.204(1) |
| Co—S | 0.2298(1) | 0.2277(6) |
| Co—Cl | 0.2337(1) | 0.2276(2) |
| Co—Cp* | 0.16769(3) | 0.16875(6) |
| 二面角/(°) | ||
| Cp*1∠Cp*2 | 6.0(3) | 1.9(3) |