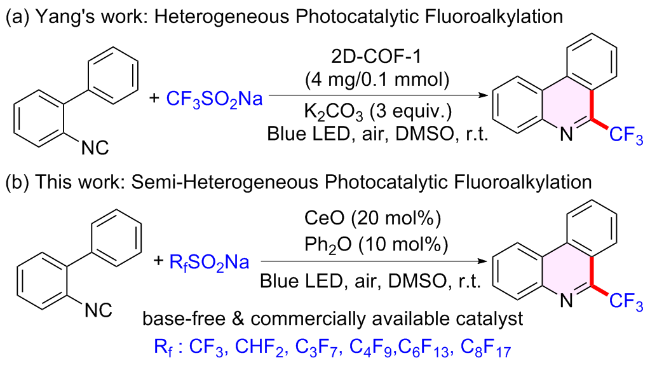
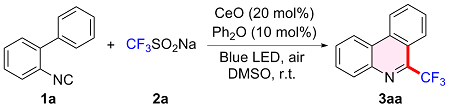
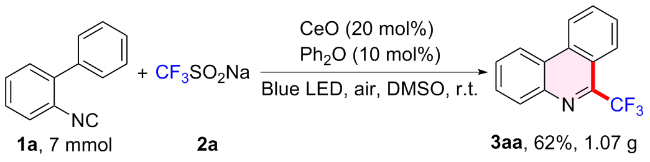1 引言
2 结果与讨论
2.1 二苯醚介导氧化铈半多相光催化2-异腈基联苯氟烷基化反应
2.1.1 条件优化
表1 反应条件优化aTable 1 Optimization of reaction conditionsa |
| Entry | Varying from the standard conditions | Yieldb/% |
|---|---|---|
| 1 | None | 73 |
| 2 | g-C3N4, Fe2O3, BiVO4 instead of CeO2 | 36, 45, 32 |
| 3 | CdO, MoO2, ZnO instead of CeO2 | 41, 34, 38 |
| 4 | Without semiconductor photocatalyst | N.R. |
| 5 | NHPI, Cp2Fe, Ph3N instead of Ph2O | 41, 28, 31 |
| 6 | Without redox catalyst | 33 |
| 7 | Purple LED instead of blue LED | 39 |
| 8 | Green LED instead of blue LED | N.R. |
| 9 | White LED instead of blue LED | N.R. |
| 10 | LED (12 W), LED (8 W) instead of LED (10 W) | 72, 63 |
| 11 | Acetone, EtOAc, DMF instead of DMSO | 21, trace, 50 |
| 12 | Without air or light | N.R. |
a Condition: 1a (0.1 mmol), 2a (0.2 mmol), CeO2 (20 mol%), Ph2O (10 mol%), DMSO (2 mL), air, blue LED (10 W), 24 h under room temperature. b Estimated by GC using dodecane as an internal reference. |
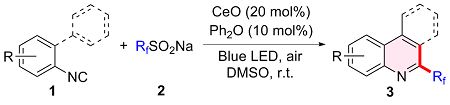
2.1.2 底物扩展
表2 2-异腈基联苯范围aTable 2 Scope of 2-isocyanobiaryla |
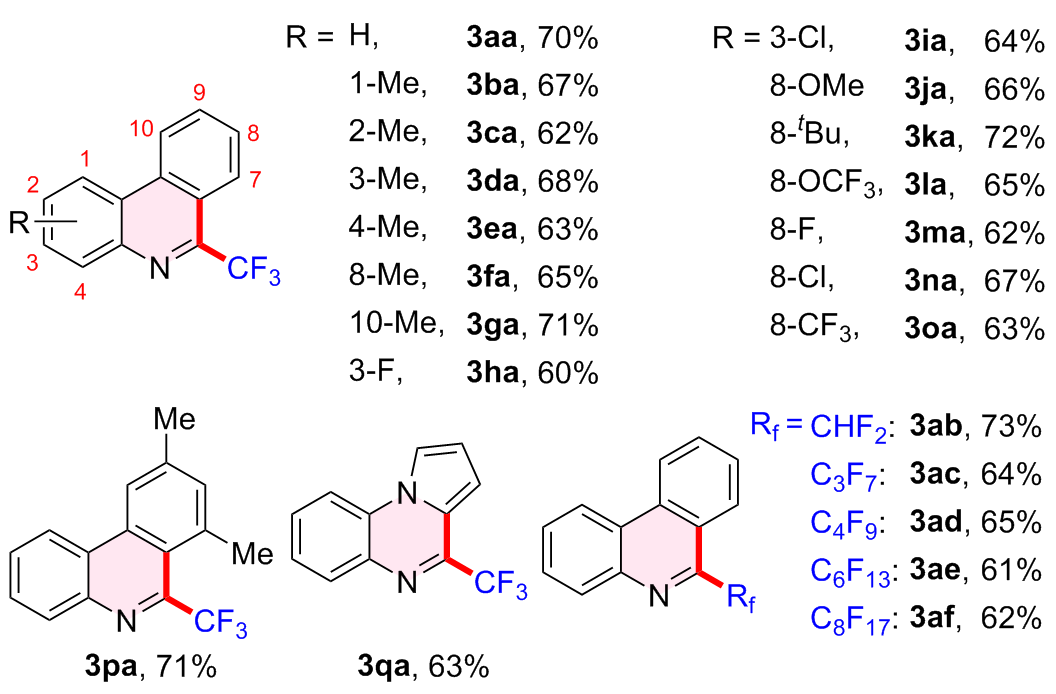 |
a Condition: 1 (0.2 mmol), 2 (0.4 mmol), Ce2O (20 mol%), Ph2O (10 mol%), DMSO (2 mL), air, blue LED (10 W), 24 h under room temperature. |