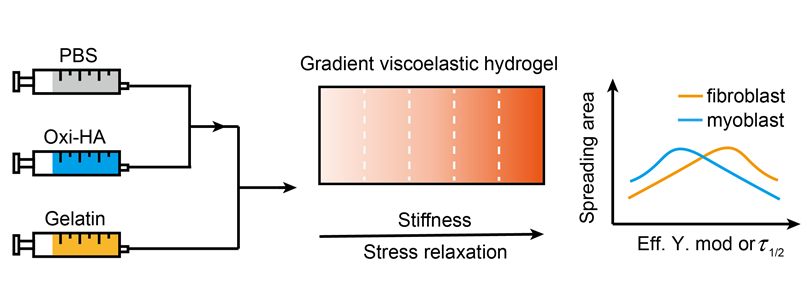
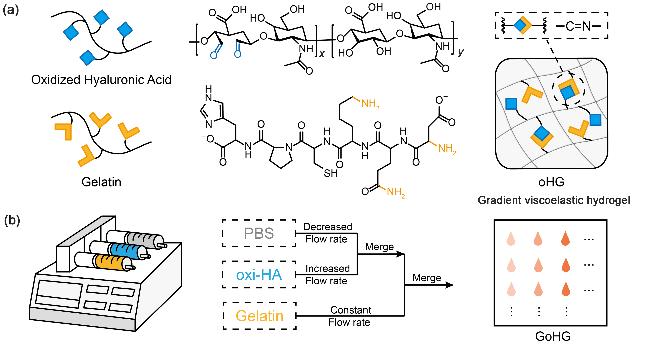
1 引言
2 结果与讨论
2.1 天然聚合物改性及oHG水凝胶黏弹性调控
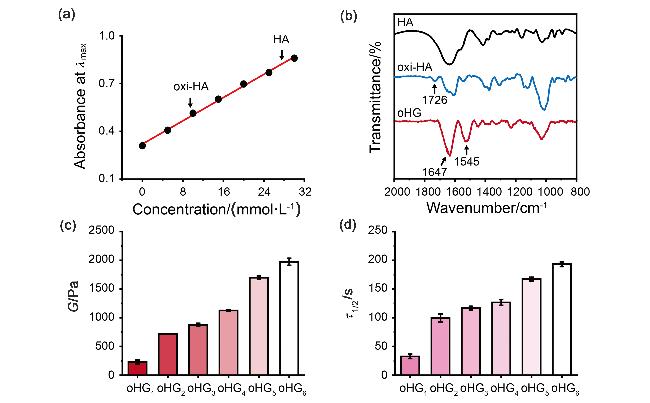
图2 (a) t-BC (0~30 mmol/L)和TNBS (0.1% V/V)的标准曲线. (b) HA, oxi-HA和oHG水凝胶的FT-IR图谱. (c) oHG水凝胶的储存模量(每组n=3)的流变测试(strain=0.1%). (d) oHG水凝胶的应力松弛时间(每组n=3)的流变测试(strain=0.08%)Figure 2 (a) The standard calibration curve of t-BC (0~30 mmol/L) and TNBS (0.1% V/V). (b) FT-IR spectra of HA, oxi-HA and oHG hydrogels. (c) Rheological test of storage modulus (n=3 for each group) of oHG hydrogels (strain=0.1%). (d) Rheological test of stress relaxation time (n=3 for each group) of oHG hydrogels (strain=0.08%) |
表1 oHG水凝胶的制备参数aTable 1 Process parameters for oHG hydrogels |
| woxi-HA/% | wgelatin /% | νoxi-HA/ (mL•min-1) | νPBS/ (mL•min-1) | νgelatin / (mL•min-1) | |
|---|---|---|---|---|---|
| oHG1 | 20.0 | 10.0 | 0.05 | 0.55 | 0.60 |
| oHG2 | 20.0 | 10.0 | 0.10 | 0.50 | 0.60 |
| oHG3 | 20.0 | 10.0 | 0.15 | 0.45 | 0.60 |
| oHG4 | 20.0 | 10.0 | 0.20 | 0.40 | 0.60 |
| oHG5 | 20.0 | 10.0 | 0.25 | 0.35 | 0.60 |
| oHG6 | 20.0 | 10.0 | 0.30 | 0.30 | 0.60 |
a Where w represents the mass fraction of the solution, and ν represents the flow rate of the solution. |
2.2 GoHG水凝胶的制备与黏弹性梯度表征
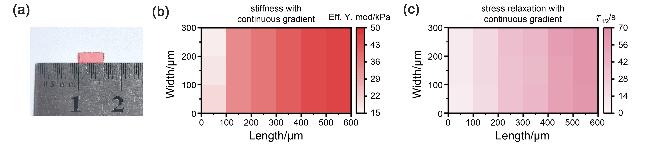
图3 GoHG水凝胶的黏弹性梯度的表征. (a) GoHG水凝胶的实物图. (b) GoHG水凝胶刚度梯度的纳米压痕表征. (c) GoHG水凝胶应力松弛梯度的纳米压痕表征Figure 3 Characterization of the viscoelastic gradient of GoHG hydrogel. (a) Picture of GoHG hydrogel. (b) Nanoindentation characterization of stiffness gradient of GoHG hydrogel. (c) Nanoindentation characterization of stress relaxation gradient of GoHG hydrogel |
2.3 oHG水凝胶黏弹性变化影响细胞行为
2.3.1 oHG水凝胶的生物相容性
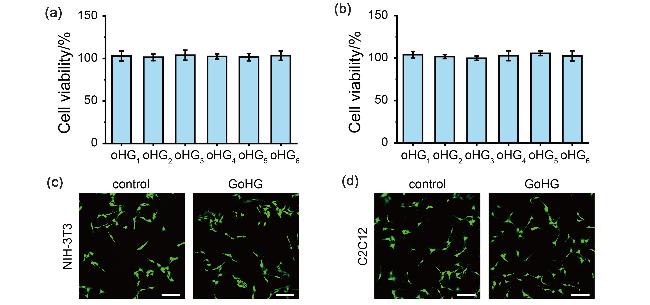
图4 oHG水凝胶的生物相容性. (a) NIH-3T3细胞和(b) C2C12细胞暴露于oHG水凝胶提取物72 h后的细胞存活率. 活/死细胞染色检测培养在DMEM和GoHG水凝胶中的(c) NIH-3T3细胞和(d) C2C12细胞的活性. 比例尺为100 μm. 绿色: 活细胞. 红色: 死细胞Figure 4 Biocompatibility of oHG hydrogel. Cell viability of (a) NIH-3T3 cells and (b) C2C12 cells exposed to oHG hydrogel extract for 72 h. Live/dead cells detected to show the viability of (c) NIH-3T3 cells and (d) C2C12 cells cultured in DMEM and GoHG hydrogel. Scale bar=100 μm. Green: live cells. Red: dead cells |
2.3.2 oHG黏弹性影响细胞铺展行为
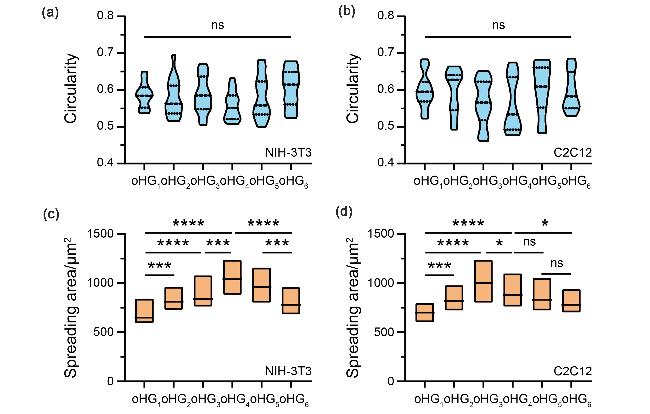
图5 NIH-3T3细胞和C2C12细胞在不同黏弹性环境中的铺展行为. (a) NIH-3T3细胞和(b) C2C12细胞在GoHG水凝胶中培养48 h的细胞圆度定量分析. 数据分析采用普通单因素方差分析: ns, 不显著; n=15个细胞. (c) NIH-3T3细胞和(d) C2C12细胞在GoHG水凝胶中培养48 h的铺展面积定量分析. 数据分析采用普通单因素方差分析: ns, 不显著, *p<0.05, ***p<0.001, ****p<0.0001; n=15个细胞Figure 5 Spreading behavior of NIH-3T3 cells and C2C12 cells in different viscoelastic environments. Quantitative analysis of (a) NIH-3T3 cells and (b) C2C12 cells circularity at 48 h culture in GoHG hydrogel. Ordinary one-way ANOVA was used for analysis of the data: ns, not significant; n=15 cells. Quantitative analysis of (c) NIH-3T3 cells and (d) C2C12 cells spreading area at 48 h culture in GoHG hydrogel. Ordinary one-way ANOVA was used for analysis of the data: ns, not significant, *p<0.05, ***p<0.001, ****p<0.0001; n=15 cells |