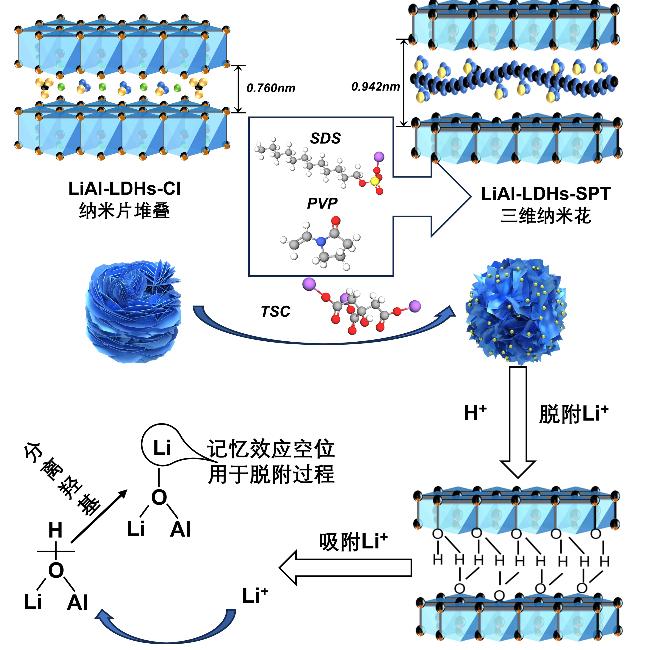
1 引言
2 结果与讨论
2.1 吸附剂的结构表征
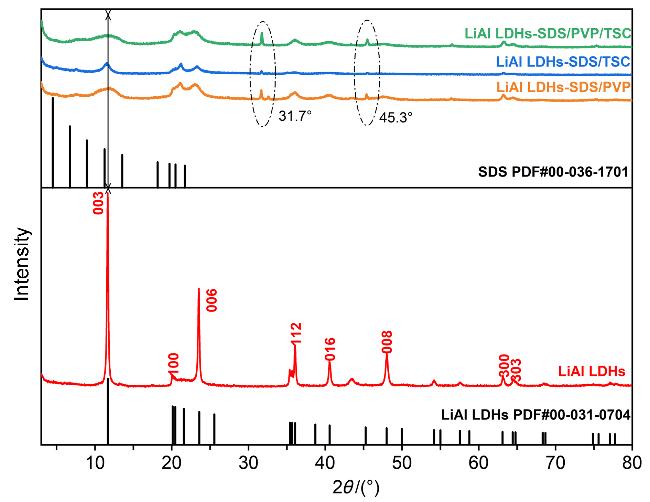
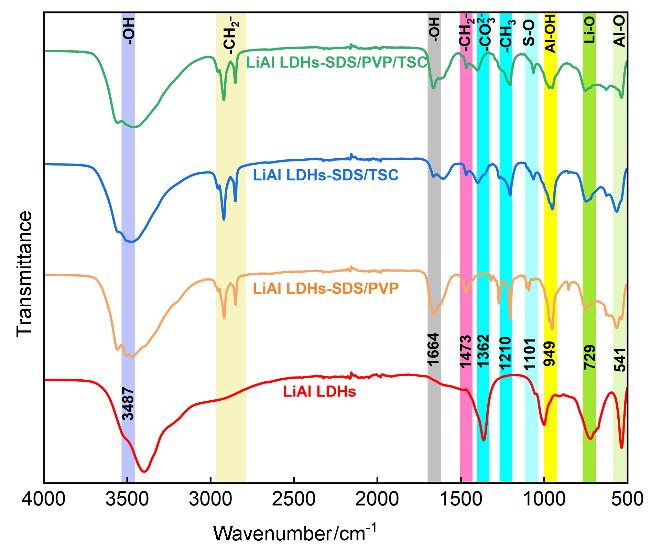
2.1.1 X射线衍射(XRD)与傅里叶变换红外光谱(FT-IR)分析
2.1.2 扫描电镜(SEM)与透射电镜(TEM)分析
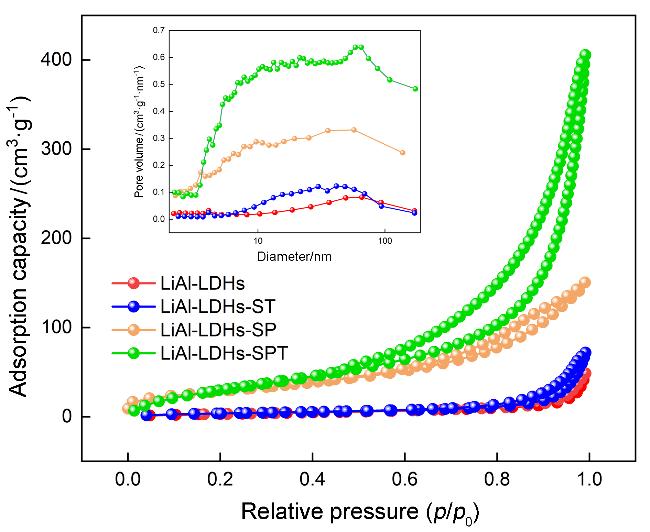
2.1.3 N2吸脱附分析
图5 吸附剂的N2吸附-脱附等温线及孔径分布图Figure 5 N2 adsorption-desorption isotherm and pore size distribution of adsorbents |
表1 吸附剂的比表面积、孔体积和平均孔径数据Table 1 Surface area, pore volume and average pore diameter data of adsorbents |
| Sample | Surface area/ (m2•g−1) | Pore volume/ (cm3•g−1•nm−1) | Pore diameter/nm |
|---|---|---|---|
| LiAl-LDHs | 14.03 | 0.071 | 20.141 |
| LiAl-LDHs-ST | 15.51 | 0.107 | 8.844 |
| LiAl-LDHs-SP | 105.03 | 0.340 | 28.272 |
| LiAl-LDHs-SPT | 130.28 | 0.637 | 19.218 |
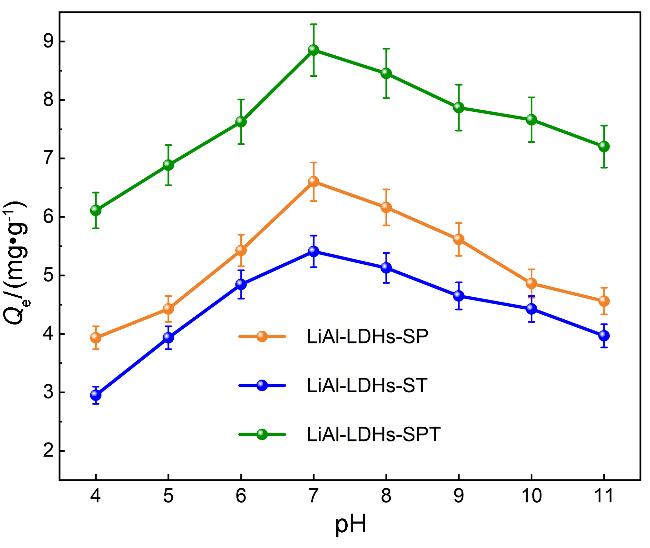
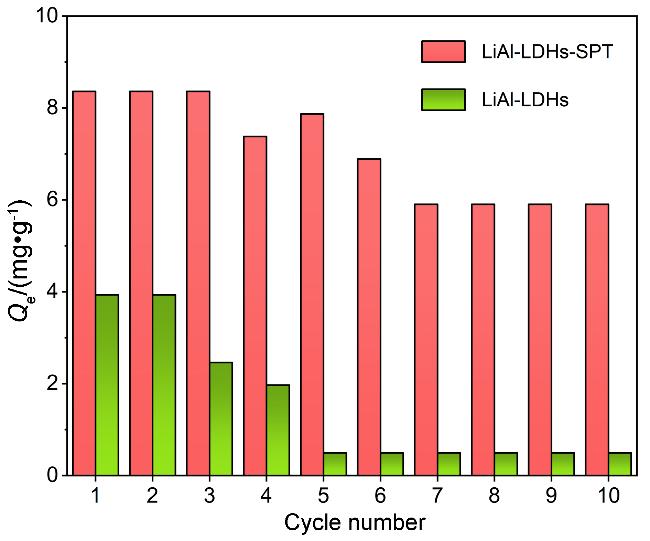
2.2 吸附剂的性能分析
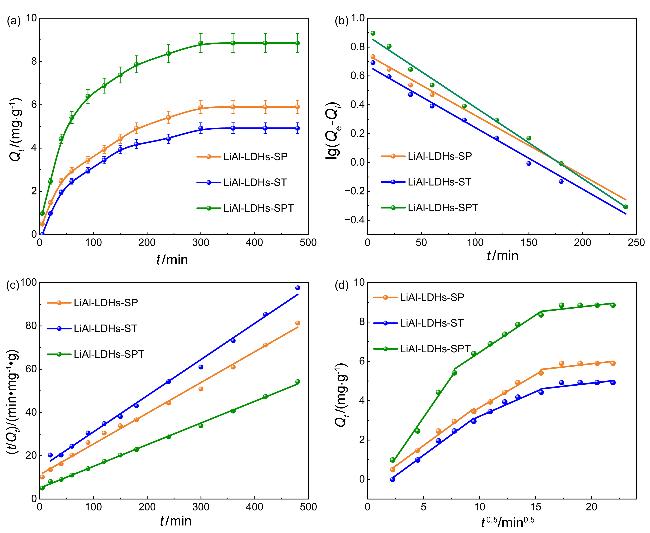
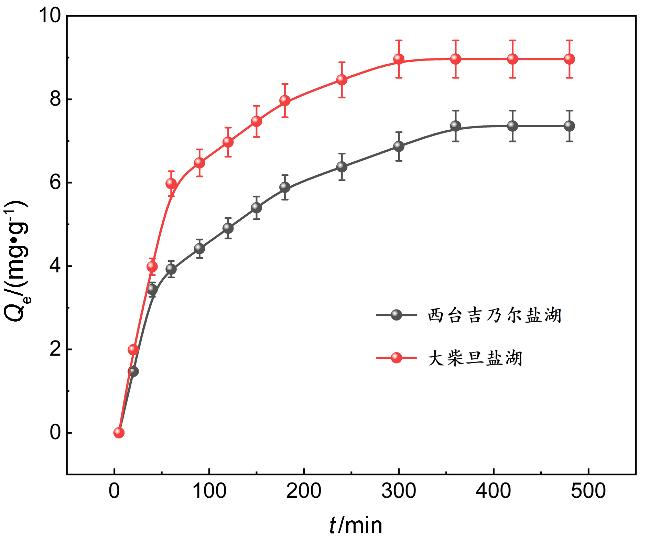
2.2.1 吸附动力学分析
表2 吸附剂的准一级动力学拟合模型参数Table 2 Quasi-first-order kinetic parameters of adsorbents |
| Sample | Qe/(mg•g−1) | $Q_{e}^{*}$/(mg•g−1) | k1/min−1 | R2 |
|---|---|---|---|---|
| LiAl-LDHs-ST | 5.902 | 5.558 | 0.00418 | 0.986 |
| LiAl-LDHs-SP | 4.918 | 4.678 | 0.00427 | 0.990 |
| LiAl-LDHs-SPT | 8.852 | 7.883 | 0.00494 | 0.992 |
表3 吸附剂的准二级动力学拟合模型参数Table 3 Quasi-second-order kinetic parameters of adsorbents |
| Sample | Qe/(mg•g−1) | $Q_{e}^{*}$/(mg•g−1) | k2/(g•mg−1•min−1) | R2 |
|---|---|---|---|---|
| LiAl-LDHs-ST | 5.902 | 6.887 | 0.00188 | 0.994 |
| LiAl-LDHs-SP | 4.918 | 5.848 | 0.00206 | 0.995 |
| LiAl-LDHs-SPT | 8.852 | 9.855 | 0.00203 | 0.998 |
表4 吸附剂的颗粒内扩散拟合模型参数Table 4 Intra-particle diffusion parameters of adsorbents |
| Sample | K1a | K2a | K3a | $R_{1}^{2}$ | $R_{2}^{2}$ | $R_{3}^{2}$ |
|---|---|---|---|---|---|---|
| LiAl-LDHs-ST | 0.417 | 0.336 | 0.064 | 0.983 | 0.986 | 0.393 |
| LiAl-LDHs-SP | 0.417 | 0.250 | 0.064 | 0.983 | 0.922 | 0.393 |
| LiAl-LDHs-SPT | 0.827 | 0.379 | 0.064 | 0.986 | 0.976 | 0.393 |
a K1, K2和K3单位是mg•g−1•h−0.5. |
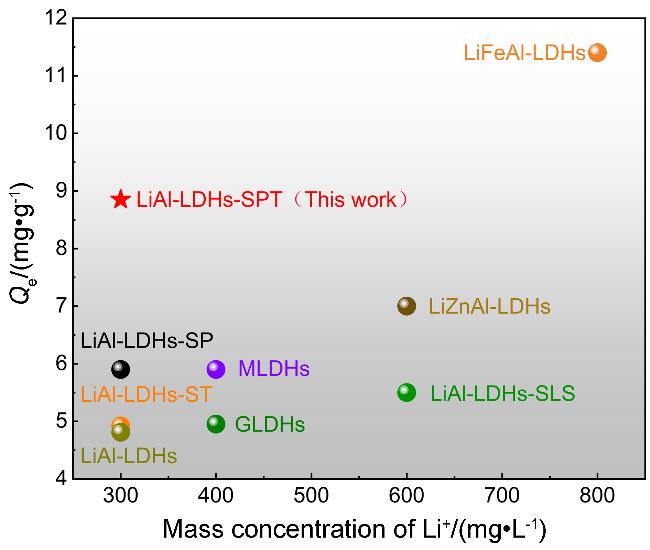
2.2.2 等温吸附线分析
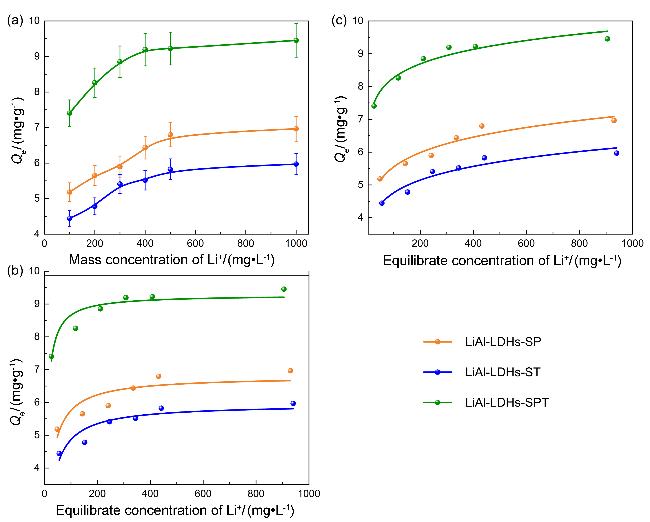
图7 吸附剂的(a)等温吸附线, (b) Langmuir等温吸附拟合模型和(c) Freundlich等温吸附拟合模型Figure 7 (a) Isothermal adsorption line, (b) Langmuir isothermal adsorption fitting model and (c) Freundlich isothermal adsorption fitting model of adsorbents |
表5 吸附剂的Langmuir等温吸附拟合模型参数Table 5 Langmuir isothermal adsorption fitting model parameters for adsorbents |
| Sample | Qm/(mg•g−1) | KL/min−1 | R2 |
|---|---|---|---|
| LiAl-LDHs-ST | 6.796 | 0.055 | 0.716 |
| LiAl-LDHs-SP | 5.947 | 0.045 | 0.815 |
| LiAl-LDHs-SPT | 9.281 | 0.139 | 0.850 |
表6 吸附剂的Freundlich等温吸附拟合模型参数Table 6 Freundlich isothermal adsorption fitting model parameters for adsorbents |
| Sample | KF/min−1 | n | R2 |
|---|---|---|---|
| LiAl-LDHs-ST | 3.352 | 13.93 | 0.914 |
| LiAl-LDHs-SP | 2.834 | 9.14 | 0.909 |
| LiAl-LDHs-SPT | 5.941 | 8.88 | 0.937 |