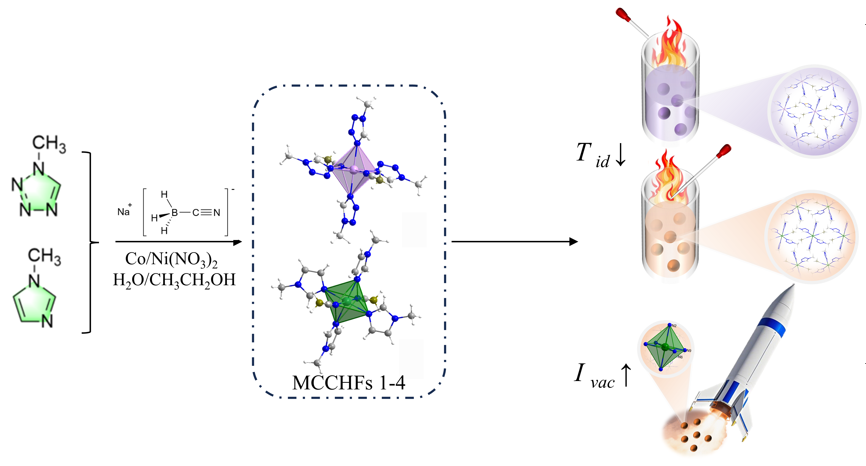
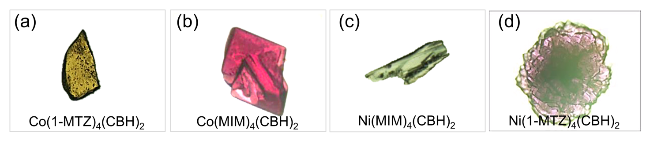
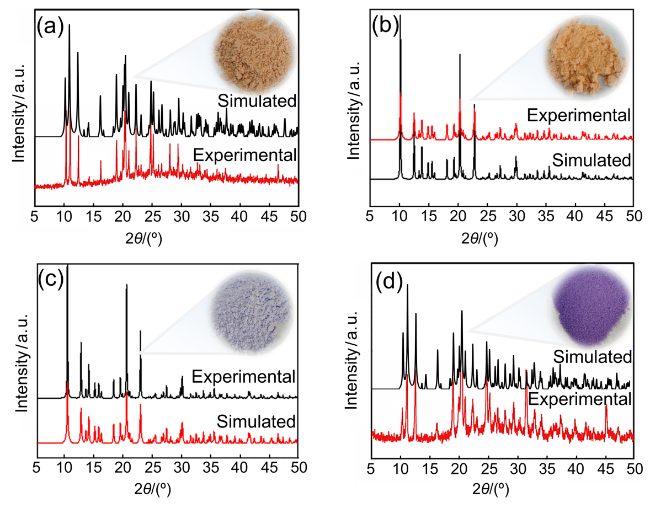
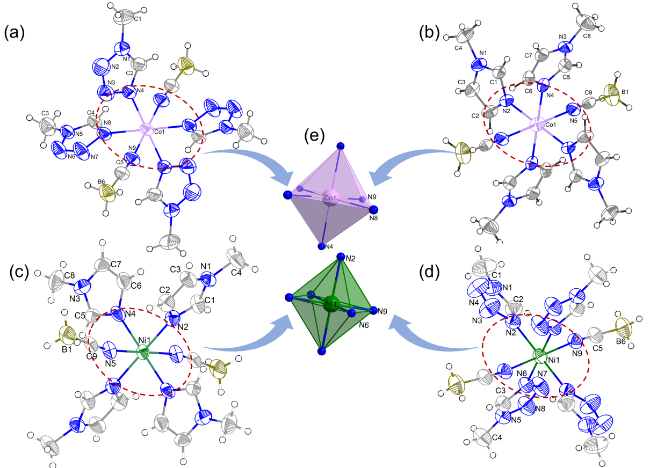
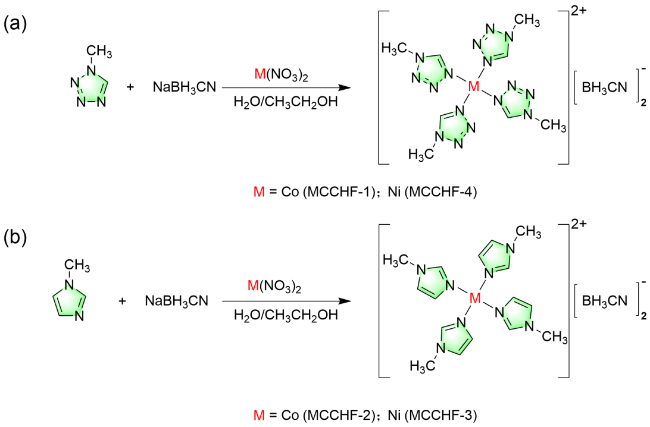
1 引言
2 结果与讨论
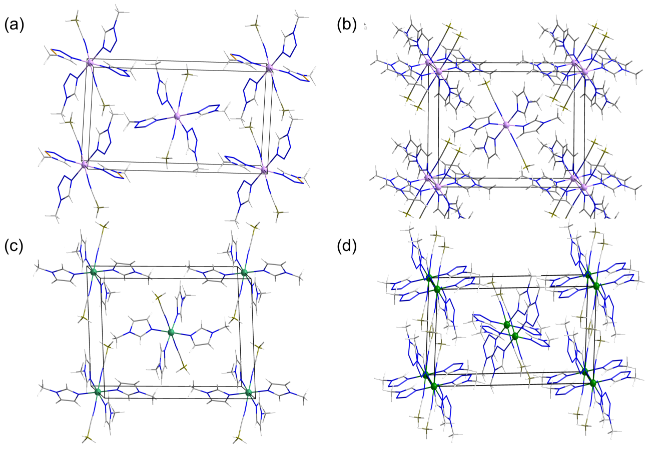
2.1 晶体结构
表1 MCCHFs 1~4的晶体学参数Table 1 Crystallographic parameters of MCCHFs 1~4 |
| Item No. | MCCHF-1 | MCCHF-2 | MCCHF-3 | MCCHF-4 |
|---|---|---|---|---|
| compounds | Co(1-MTZ)4(CBH)2 | Co(MIM)4(CBH)2 | Ni(MIM)4(CBH)2 | Ni(1-MTZ)4(CBH)2 |
| formula | C10H22B2N18Co | C18H30B2N10Co | C18H30B2N10Ni | C10H22B2N18Ni |
| form. mass | 475.01 | 467.07 | 466.85 | 474.79 |
| T/K | 296.15 | 293(2) | 293(2) | 296(2) |
| crystal system | Monoclinic | Monoclinic | Monoclinic | Monoclinic |
| space group | P21/c | P21/n | P21/c | P21/c |
| a/nm | 0.74388(4) | 0.78597(7) | 0.78521(7) | 0.7377 |
| b/nm | 1.69365(10) | 1.10832(11) | 1.10513(11) | 1.6947 |
| c/nm | 0.94913(5) | 1.41131(13) | 1.56381(14) | 0.9412 |
| α/(°) | 90.00 | 90 | 90 | 90.00 |
| β/(°) | 108.7460(10) | 94.484(2) | 115.738(5) | 108.58 |
| γ/(°) | 90.00 | 90 | 90 | 90.00 |
| V/nm3 | 1.13235(11) | 1.2256(2) | 1.2224(2) | 1.1154 |
| Z | 2 | 2 | 2 | 2 |
| ρcalcd/(g•cm−3) | 1.393 | 1.266 | 1.268 | 1.414 |
| μ/mm−1 | 0.796 | 0.725 | 0.819 | 0.908 |
| F(000) | 490 | 490 | 492 | 492 |
| Goodness-of-fit on F2 | 1.050 | 1.034 | 1.042 | 1.165 |
| Final R indexes [I≥2σ(I)] | R1=0.0413, wR2=0.0842 | R1=0.0954, wR2=0.1554 | R1=0.0895, wR2=0.1861 | R1=0.0732, wR2=0.1662 |
| Final R indexes [all data] | R1=0.0640, wR2=0.0952 | R1=0.2156, wR2=0.1814 | R1=0.1928, wR2=0.2109 | R1=0.1196, wR2=0.1828 |
| CCDC | 2240151 | 2451525 | 2451527 | 2240152 |
2.2 基础物理化学性质
表2 MCCHFs 1~4的物理化学性质Table 2 Physicochemical properties of MCCHFs 1~4 |
| MCCHF-1 | MCCHF-2 | MCCHF-3 | MCCHF-4 | |
|---|---|---|---|---|
| Ma/(g•mol−1) | 475.01 | 467.07 | 466.85 | 474.79 |
| ρb/(g•cm−3) | 1.393 | 1.266 | 1.268 | 1.414 |
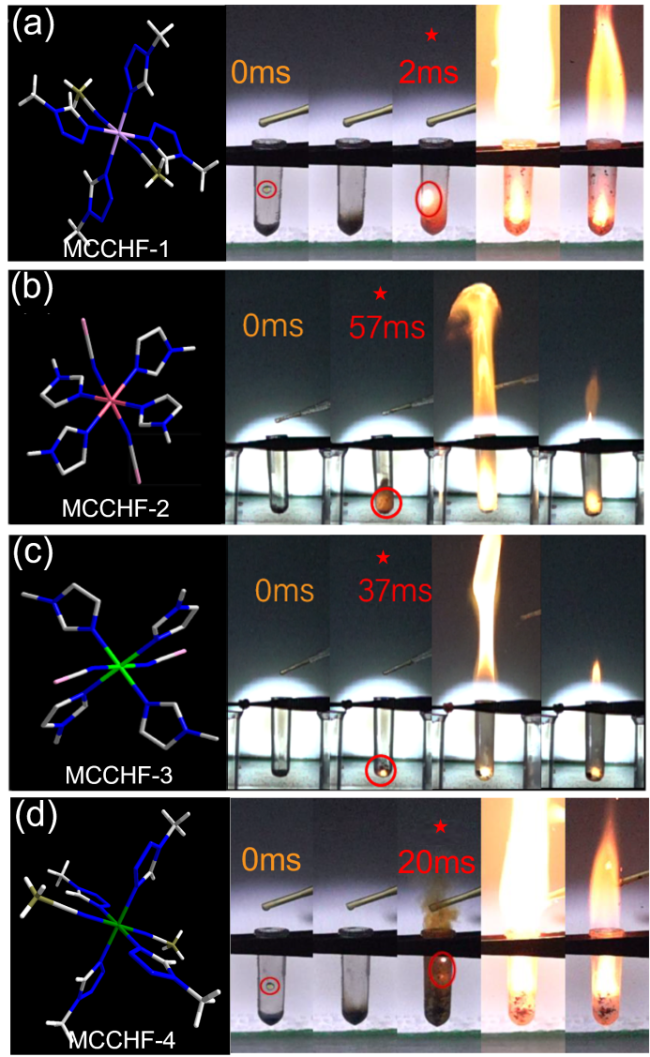
| tidc/ms | 2 | 20 | 57 | 37 |
| Tp d/℃ | 152.4 | 176.3 | 171.8 | 168.8 |
| Eg e/(kJ•g−1) | 20.44 | 25.41 | 23.77 | 18.36 |
| Ev f/(kJ•cm−3) | 28.47 | 32.17 | 30.14 | 25.97 |
| ISg/J | 8 | >40 | >40 | 17 |
| FSh/N | 288 | >360 | >360 | 216 |
| ΔUc i/(J•g−1) | -20433.05 | -25434.78 | -23746.10 | -18367.83 |
| ΔHc j/(kJ•mol−1) | -9709.2 | -11868.24 | -11097.02 | -8717.14 |
| ΔHf k/(kJ•mol−1) | 1051.95 | -1080.41 | -1786.25 | 125.27 |
a Molar mass; b Density; c Ignition delay time; d Peak decomposition temperature; e Mass energy density; f Volumetric energy density; g Impact sensitivity; h Friction sensitivity; i Heat of combustion; j Standard enthalpy of combustion; k Enthalpy of formation. |
2.3 非等温动力学
表3 MCCHFs 1~4物质的热分解峰温和非等温动力学参数Table 3 Thermal decomposition peak temperature and non-isothermal kinetic parameters of MCCHFs 1~4 substances |
| 参数 | MCCHF-1 | MCCHF-2 | MCCHF-3 | MCCHF-4 | |
|---|---|---|---|---|---|
| β/(℃•min−1) | 5 | 173.5 | 200.2 | 209.6 | 172.8 |
| 10 | 177.7 | 203.5 | 213.3 | 177.6 | |
| 15 | 180.5 | 206.4 | 216.2 | 179.8 | |
| 20 | 182.4 | 209.5 | 218.5 | 181.7 | |
| Kissinger法 | EK/(kJ•mol−1) | 255.3 | 274.7 | 299.3 | 256.3 |
| lg AK | 27.97 | 28.44 | 30.51 | 28.21 | |
| RK | -0.9996 | -0.9836 | -0.9957 | -0.9986 | |
| Ozawa法 | EO/(kJ•mol−1) | 249.9 | 268.8 | 292.3 | 250.8 |
| RO | -0.9997 | -0.9845 | -0.9959 | -0.9986 | |
| Ea/(kJ•mol−1) | 256.2 | 271.7 | 295.8 | 253.5 | |
| Tpo a/℃ | 167.40 | 195.90 | 204.90 | 163.10 | |
| Tb b/℃ | 173.91 | 202.75 | 211.42 | 169.45 | |
| ΔS≠ c/(J•K−1•mol−1) | 287.29 | 295.77 | 335.24 | 291.97 | |
| ΔH≠ d/(kJ•mol−1) | 251.64 | 270.80 | 295.33 | 252.67 | |
| ΔG≠ e/(kJ•mol−1) | 126.07 | 132.07 | 135.06 | 125.30 | |
a Peak exothermic value when the rate of warming tends to zero. b Thermal explosion critical temperature. c Entropy of activation. d Enthalpy of activation. e Gibbs free energy. |
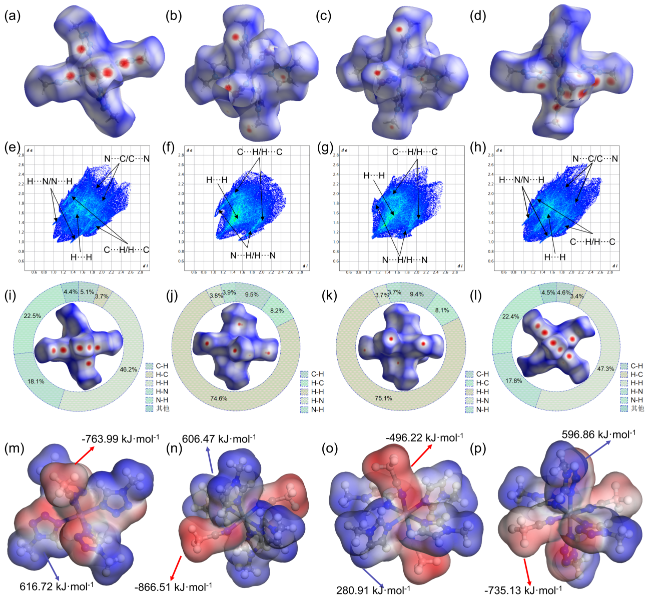
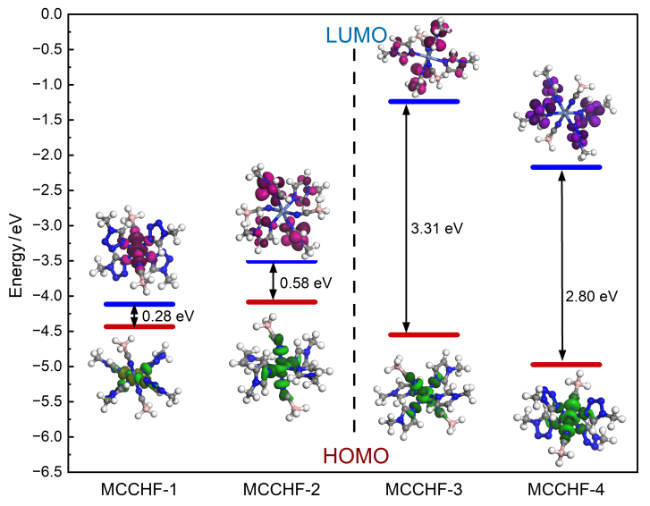
2.4 分子间作用力
2.5 自燃点火延迟时间
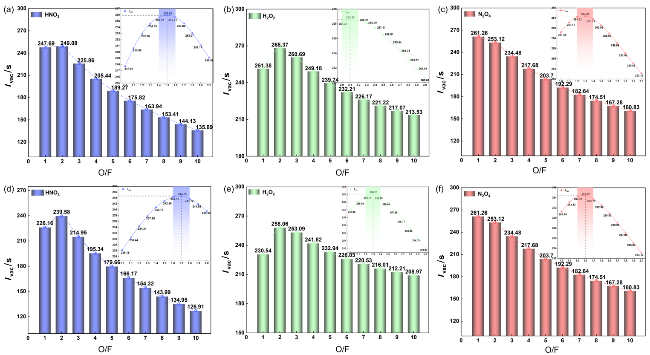
2.6 理论比冲
表4 NASA-CEA输入参数表Table 4 NASA-CEA Input Parameter Table |
| 输入参数 | 来源 | |
|---|---|---|
| 燃料 | MCCHF-1 (C10H22B2N18Co) MCCHF-4 (C10H22B2N18Ni) | 实验室自制 |
| 氧化剂 | HNO3/H2O2/N2O4 | NASA-CEA默认数据库 |
| 氧燃比 | 1.0~10.0 | 参数化研究 |
| 生成焓(ΔHf) | MCCHF-1: 1051.95 kJ•mol−1 MCCHF-4: 125.27 kJ•mol−1 | 氧弹量热仪实测 |
| 燃烧室压力(Pc) | 2.533 MPa | 文献[51] |
| 喷管出口压力(Pe) | 0.1013 MPa | |
| 喷管面积比(Ae/At) | 4 | |
| 流动模型 | IAC模型 | |
表5 自燃燃料在最佳氧燃比下的性能参数Table 5 Performance parameters of pyrophoric fuel at the optimal oxygen-fuel ratio |
| Hypergolic-fuels | MCCHF-1 | MCCHF-4 | MMH[2] | UDMH[2] | |||||
|---|---|---|---|---|---|---|---|---|---|
| HNO3 | N2O4 | H2O2 | HNO3 | N2O4 | H2O2 | ||||
| O/F | 1.5 | 1.3 | 2.1 | 1.7 | 1.4 | 2.3 | 2.5 | 3 | |
| Ivac/s | 255.92 | 264.43 | 268.57 | 244.65 | 252.77 | 260.05 | 260 | 258 | |
| Isp/s | 225.76 | 237.73 | 236.07 | 215.44 | 222.48 | 229.11 | — — | ||
| 燃烧室温度/K | 3079.93 | 3338.88 | 2963.39 | 2933.77 | 3162.48 | 2842.46 | |||
| 特征速度/(m•s−1) | 1544.4 | 1595.4 | 1619.2 | 1474.3 | 1522.5 | 1567.8 | |||
| 燃烧产物的摩尔质量/(kg•kmol−1) | 26.60 | 26.86 | 23.38 | 27.89 | 27.96 | 23.92 | |||