有机化学 ›› 2023, Vol. 43 ›› Issue (7): 2304-2312.DOI: 10.6023/cjoc202301010 上一篇 下一篇
所属专题: 有机氟化学虚拟合辑
综述与进展
收稿日期:2023-01-09
修回日期:2023-02-03
发布日期:2023-03-07
通讯作者:
吴小锋
Da-Lie Ana,b, Zhi-Peng Baoa, Xiao-Feng Wua,b( )
)
Received:2023-01-09
Revised:2023-02-03
Published:2023-03-07
Contact:
Xiao-Feng Wu
文章分享
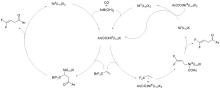
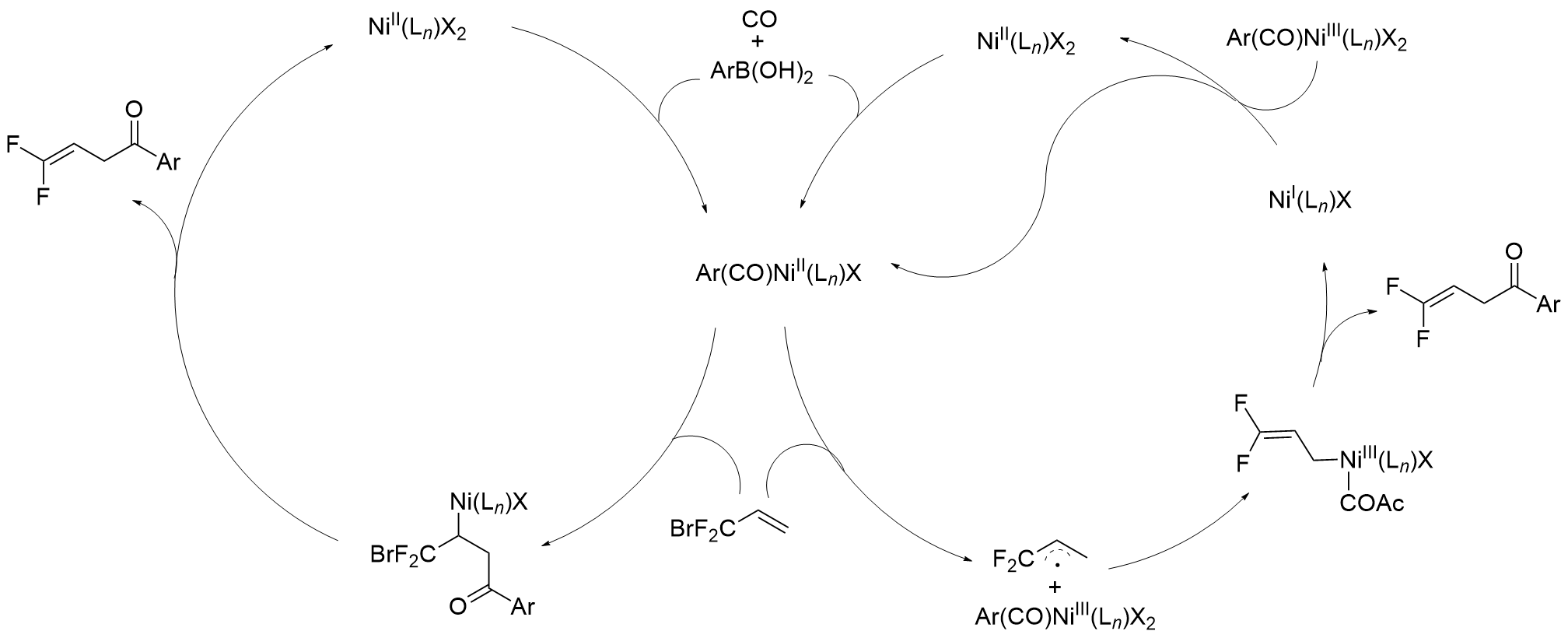
含氟有机分子的合成和转化已蓬勃发展成为氟化学重要的前沿课题之一, 它深刻地影响着生命科学和材料科学. 其中碳氟化合物参与的羰基化反应是近几年发展起来的一类羰基化反应, 它拥有诸多的挑战. 介绍了过渡金属钯、镍和铜催化的碳氟化合物参与的羰基化反应研究进展. 为了理解这些反应的历程, 也选择了一些具有代表性的反应介绍其反应机理.
安大列, 包志鹏, 吴小锋. 含碳氟类底物参与的羰基化反应研究进展[J]. 有机化学, 2023, 43(7): 2304-2312.
Da-Lie An, Zhi-Peng Bao, Xiao-Feng Wu. Progresses on Fluorocarbon-Containing Substrates Involved Carbonylation Reactions[J]. Chinese Journal of Organic Chemistry, 2023, 43(7): 2304-2312.
| [1] |
(a) Hagmann, W. K. J. Med. Chem. 2008, 51, 4359.
doi: 10.1021/jm800219f |
|
(b) Muller, K.; Faeh, C.; Diederich, F. Science 2007, 317, 1881.
doi: 10.1126/science.1131943 |
|
|
(c) Liang, T.; Neumann, C. N.; Ritter, T. Angew. Chem., Int. Ed. 2013, 52, 8214.
doi: 10.1002/anie.v52.32 |
|
| [2] |
(a) Furuya, T.; Kamlet, A. S.; Ritter, T. Nature 2011, 473, 470.
doi: 10.1038/nature10108 pmid: 21456523 |
|
(b) Tomashenko, O. A.; Grushin, V. V. Chem. Rev. 2011, 111, 4475.
doi: 10.1021/cr1004293 pmid: 21456523 |
|
|
(c) Besset, T.; Schneider, C.; Cahard, D. Angew. Chem., Int. Ed. 2012, 51, 5048.
doi: 10.1002/anie.201201012 pmid: 21456523 |
|
|
(d) Belhomme, M.-C.; Besset, T.; Poisson, T.; Pannecoucke, X. Chem.-Eur. J. 2015, 21, 12836.
doi: 10.1002/chem.201501475 pmid: 21456523 |
|
|
(e) Feng, Z.; Xiao, Y.-L.; Zhang, X. Acc. Chem. Res. 2018, 51, 2264.
doi: 10.1021/acs.accounts.8b00230 pmid: 21456523 |
|
|
(f) Gao, X.; He, X.; Zhang, X. Chin. J. Org. Chem.. 2019, 39, 215 (in Chinese).
doi: 10.6023/cjoc201808014 pmid: 21456523 |
|
|
(高兴, 何旭, 张新刚, 有机化学, 2019, 39, 215.)
doi: 10.6023/cjoc201808014 pmid: 21456523 |
|
|
(g) Cheng, R.; Xu, C.; Zhang, X. Chin. J. Org. Chem. 2020, 40, 3307 (in Chinese).
doi: 10.6023/cjoc202005082 pmid: 21456523 |
|
|
(程然, 徐畅, 张新刚, 有机化学, 2020, 40, 3307.)
doi: 10.6023/cjoc202005082 pmid: 21456523 |
|
| [3] |
(a) Schoenberg, A.; Bartoletti, I.; Heck, R. F. J. Org. Chem. 1974, 39, 3318.
doi: 10.1021/jo00937a003 |
|
(b) Schoenberg, A.; Heck, R. F. J. Org. Chem. 1974, 39, 3327.
doi: 10.1021/jo00937a004 |
|
|
(c) Schoenberg, A.; Heck, R. F. J. Am. Chem. Soc. 1974, 96, 7761.
doi: 10.1021/ja00832a024 |
|
| [4] |
(a) Brennfîhrer, A.; Neumann, H.; Beller, M. Angew. Chem., Int. Ed. 2009, 48, 4114.
doi: 10.1002/anie.v48:23 |
|
(b) Grigg, R.; Mutton, S. P. Tetrahedron 2010, 66, 5515.
doi: 10.1016/j.tet.2010.03.090 |
|
|
(c) Wu, X.-F.; Neumann, H.; Beller, M. Chem. Soc. Rev. 2011, 40, 4986.
doi: 10.1039/c1cs15109f |
|
|
(d) Wu, X.-F.; Neumann, H.; Beller, M. Chem. Rev. 2013, 113, 1.
doi: 10.1021/cr300100s |
|
| [5] |
(a) King, R. B.; Stafford, S. L.; Treichel, P. M.; Stone, F. G. A. J. Am. Chem. Soc. 1961, 83, 3604.
doi: 10.1021/ja01478a016 pmid: 14601984 |
|
(b) Klabunde, K. J.; Campostrini, R. J. Fluorine Chem. 1989, 42, 93.
doi: 10.1016/S0022-1139(00)83971-8 pmid: 14601984 |
|
|
(c) Cordaro, J. G.; Bergman, R. G. J. Am. Chem. Soc. 2004, 126, 16912.
pmid: 14601984 |
|
|
(d) Fuchikami, T.; Yamanouchi, A.; Ojima, I. Synthesis 1984, 766.
pmid: 14601984 |
|
|
(e) Amii, H.; Kishikawa, Y.; Kageyama, K.; Uneyama, K. J. Org. Chem. 2000, 65, 3404.
pmid: 14601984 |
|
|
(f) Kobayashi, T.; Nakagawa, T.; Amii, H.; Uneyama, K. Org. Lett. 2003, 5, 4297.
pmid: 14601984 |
|
| [6] |
(a) McClelian, W. R. J. Am. Chem. Soc. 1961, 83, 598.
|
|
(b) Kin, R. B.; Bisnette, M. B. J. Organomet. Chem. 1964, 2, 15.
doi: 10.1016/S0022-328X(00)87596-8 |
|
|
(c) Brothers, P. J.; Burrell, A. K.; Clark, G. R.; Rickard, C. E. F.; Roper, W. R. J. Organomet. Chem. 1990, 394, 615.
doi: 10.1016/0022-328X(90)87258-F |
|
|
(d) Huang, H.; Hughes, R. P.; Rheingold, A. L. Organometallics 2010, 29, 1948.
doi: 10.1021/om1001183 |
|
| [7] |
(a) Zhao, H.-Y.; Feng, Z.; Luo, Z.; Zhang, X. Angew. Chem., Int. Ed. 2016, 55, 10401.
doi: 10.1002/anie.201605380 pmid: 27346239 |
|
(b) Andersen, T. L.; Frederiksen, M. W.; Domino, K.; Skrydstrup, T. Angew. Chem., Int. Ed. 2016, 55, 10396.
doi: 10.1002/anie.201604152 pmid: 27346239 |
|
| [8] |
Yin, H.; Kumke, J.-J.; Domino, K.; Skrydstrup, T. ACS Catal. 2018, 8, 3853.
doi: 10.1021/acscatal.8b00420 |
| [9] |
Zhao, H.-Y.; Zhou, M.; Zhang, X. Org. Lett. 2021, 23, 9106.
doi: 10.1021/acs.orglett.1c03396 |
| [10] |
(a) Wang, Q.; He, Y.-T.; Zhao, J.-H.; Qiu, Y.-F.; Zheng, L.; Hu, J.-Y.; Yang, Y.-C.; Liu, X.-Y.; Liang, Y.-M. Org. Lett. 2016, 18, 2664.
doi: 10.1021/acs.orglett.6b01038 |
|
(b) Wang, Q.; Zheng, L.; He, Y.-T.; Liang, Y.-M. Chem. Commun. 2017, 53, 2814.
doi: 10.1039/C7CC00259A |
|
|
(c) Wang, Q.; Jin, J.-N.; Chen, X.; Wang, X.-G.; Zhang, B.-S.; Ma, J.-W.; Liang, Y.-M. J. Org. Chem. 2018, 83, 14626.
doi: 10.1021/acs.joc.8b02440 |
|
| [11] |
(a) Bao, Z.-P.; Zhang, Y.; Wu, X.-F. Chem. Sci. 2022, 13, 9387.
doi: 10.1039/D2SC02665A |
|
(b) Bao, Z.-P.; Zhang, Y.; Wu, X.-F. J. Catal. 2022, 41, 163.
|
|
|
(c) Bao, Z.-P.; Zhang, Y.; Wang, L.-C.; Wu, X.-F. Sci. China: Chem. 2023, 66, 139.
|
|
| [12] |
Qi, X.; Yu, F.; Chen, P.; Liu, G. Angew. Chem., Int. Ed. 2017, 56, 12692.
doi: 10.1002/anie.v56.41 |
| [13] |
(a) Zhang, Y.; Geng, H.-Q.; Wu, X.-F. Angew. Chem., Int. Ed. 2021, 60, 24292.
doi: 10.1002/anie.v60.45 |
|
(b) Zhang, Y.; Geng, H.-Q.; Wu, X.-F. Chem.-Eur. J. 2021, 27, 17682.
doi: 10.1002/chem.v27.70 |
|
| [14] |
Zhang, Y.; Bao, Z.-P.; Xu, J.-X.; Wu, X.-F. Org. Lett. 2022, 24, 6845.
doi: 10.1021/acs.orglett.2c02779 |
| [15] |
Liu, J.; Yang, J.; Ferretti, F.; Jackstell, R.; Beller, M. Angew. Chem., Int. Ed. 2019, 58, 4690.
doi: 10.1002/anie.v58.14 |
| [16] |
Wu, F.-P.; Yuan, Y.; Liu, J.; Wu, X.-F. Angew. Chem., Int. Ed. 2021, 60, 8818.
doi: 10.1002/anie.v60.16 |
| [17] |
Li, Y.; Zhang, C.-L.; Huang, W.-H.; Sun, N.; Hao, M.; Neumann, H.; Beller, M. Chem. Sci. 2021, 12, 10467.
doi: 10.1039/D1SC02212A |
| [18] |
(a) Feng, Z.; Min, Q.-Q.; Zhang, X. Org. Lett. 2016, 18, 44.
doi: 10.1021/acs.orglett.5b03206 pmid: 32391697 |
|
(b) Feng, Z.; Min, Q.-Q.; Fu, X.-P.; An, L.; Zhang, X. Nat. Chem. 2017, 9, 918.
doi: 10.1038/nchem.2746 pmid: 32391697 |
|
|
(c) Fu, X.-P.; Xue, X.-S.; Zhang, X.-Y.; Xiao, Y.-L.; Zhang, S.; Guo, Y.-L.; Leng, X.; Houk , K.-N.; Zhang, X. Nat. Chem. 2019, 11, 948.
doi: 10.1038/s41557-019-0331-9 pmid: 32391697 |
|
|
(d) Zhu, F.; Yang, G.; Zhou, S.; Wu, X.-F. RSC Adv. 2016, 6, 57070.
doi: 10.1039/C6RA12287F pmid: 32391697 |
|
|
(e) Johansen, M. B.; Gedde, O. R.; Mayer, T. S.; Skrydstrup, T. Org. Lett. 2020, 22, 4068.
doi: 10.1021/acs.orglett.0c01117 pmid: 32391697 |
|
| [19] |
Zhao, H.-Y.; Gao, X.; Zhang, S.; Zhang, X. Org. Lett. 2019, 21, 1031.
doi: 10.1021/acs.orglett.8b04070 |
| [20] |
Zhou, M.; Zhao, H.-Y.; Zhang, S.; Zhang, Y.; Zhang, X. J. Am. Chem. Soc. 2020, 142, 18191.
doi: 10.1021/jacs.0c08708 |
| [21] |
Cheng, R.; Zhao, H.-Y.; Zhang, S.; Zhang, X. ACS Catal. 2020, 10, 36.
doi: 10.1021/acscatal.9b04038 |
| [22] |
Cheng, R.; Sang, Y.; Gao, X.; Zhang, S.; Xue, X.-S.; Zhang, X. Angew. Chem., Int. Ed. 2021, 60, 12386.
doi: 10.1002/anie.v60.22 |
| [23] |
Wu, F.-P.; Yuan, Y.; Wu, X.-F. Angew. Chem., Int. Ed. 2021, 60, 25787.
doi: 10.1002/anie.v60.49 |
| [24] |
Zhang, Y.; Yuan, Y.; Geng, H.-Q.; Xu, J.-X.; Wu, X.-F. J. Catal. 2022, 413, 214.
doi: 10.1016/j.jcat.2022.06.033 |
| [1] | 郭广青, 练仲. 硅基羧酸在有机合成中的应用进展[J]. 有机化学, 2023, 43(10): 3580-3589. |
| [2] | 叶青青, 张梦帆, 刘耀宗, 杨震. 3-去羟基Phomonol的合成[J]. 有机化学, 2019, 39(9): 2671-2675. |
| [3] | 谢叶香, 李金恒, 尹笃林, 江焕峰. 超临界二氧化碳介质中钯催化炔烃羰基化反应[J]. 有机化学, 2004, 24(2): 169-172. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||