

以NH4 +/ N, N-二甲基甲酰胺组合为氰源Ag/Cu介导芳基羧酸的脱羧氰化反应
收稿日期: 2020-06-17
修回日期: 2020-07-27
网络出版日期: 2020-08-27
基金资助
国家自然科学基金(21761021); 国家自然科学基金(21861026)
Ag/Cu-Mediated Decarboxylative Cyanation of Arene Carboxylic Acids Using NH4 +/N,N-Dimethylformamide as Combined Cyanide Source
Received date: 2020-06-17
Revised date: 2020-07-27
Online published: 2020-08-27
Supported by
the National Natural Science Foundation of China(21761021); the National Natural Science Foundation of China(21861026)
付拯江 , 郝广果 , 石泉清 , 周金琪 , 姜李高 , 汪水亮 , 郭生梅 , 蔡琥 . 以NH4 +/ N, N-二甲基甲酰胺组合为氰源Ag/Cu介导芳基羧酸的脱羧氰化反应[J]. 有机化学, 2021 , 41(1) : 333 -340 . DOI: 10.6023/cjoc202006031
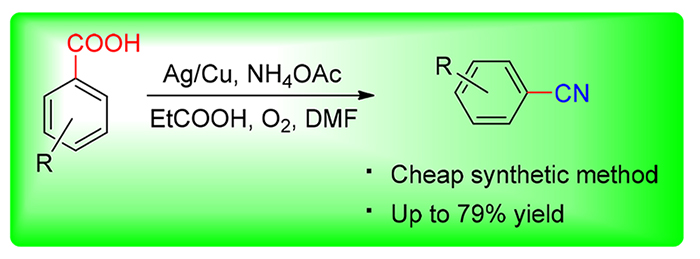
A Ag/Cu-mediated decarboxylative cyanation of aryl carboxylic acids has been well established using NH4OAc/ N, N-dimethylformamide (DMF) as a combined cyanide source under aerobic conditions, and the synthesis of perampanel was further realized with this method as the key step. Preliminary mechanistic investigation indicated the “CN” of desired products was from the combination of DMF and ammonium salt. Cu in the catalytic system was essential for the process, whereas Ag was beneficial for the transformation.
Key words: decarboxylation; aryl nitrile; aerobic conditions
| [1] | (a) Zhang Y.-F. ; Shi Z.-J. Acc. Chem. Res. 2019, 52, 161. |
| [1] | (b) Petrone D.A. ; Ye J. ; Lautens M. Chem. Rev. 2016, 116, 8003. |
| [1] | (c) Yan G. ; Wu X. ; Yang M. Org. Biomol. Chem. 2013, 11, 5558. |
| [1] | (d) Kumar R. ; Eycken E.V.V. Chem. Soc. Rev. 2013, 42, 1121. |
| [1] | (e) Song L.-R. ; Fana Z. ; Zhang A. Org. Biomol. Chem. 2019, 17, 1351. |
| [1] | (f) Bariwalab J. ; Eycken E.V. Chem. Soc. Rev. 2013, 42, 9283. |
| [2] | (a) Zhou M. ; Qin P. ; Jing L. ; Sun J. ; Du H. Chin. J. Org. Chem. 2020, 40, 598. (in Chinese) |
| [2] | ( 周明东, 覃丕涛, 经理珂, 孙京, 杜海武, 有机化学, 2020, 40, 598.). |
| [2] | (b) Yin X. ; Li W. ; Zhao B. ; Cheng K. Chin. J. Org. Chem. 2018, 38, 2879. (in Chinese) |
| [2] | ( 殷晓婷, 李文炅, 赵保丽, 程凯, 有机化学, 2018, 38, 2879.). |
| [2] | (c) Dai J. ; Wang G. ; Xu X. ; Xu H. Chin. J. Org. Chem. 2013, 33, 2460. (in Chinese) |
| [2] | ( 戴建军, 王光祖, 徐小岚, 许华建, 有机化学, 2013, 33, 2460.). |
| [2] | (d) Perry G.J.P. ; Larrosa I. Eur. J. Org. Chem. 2017, 3517. |
| [2] | (e) Wei Y. ; Hu P. ; Zhang M. ; Su W. Chem. Rev. 2017, 117, 8864. |
| [2] | (f) Dzik W.I. ; Lange P.P. ; Gooßen L.J. Chem. Sci. 2012, 3, 2671. |
| [2] | (g) Fu Z. ; Li Z. ; Xiong Q. ; Cai H. Chin. J. Org. Chem. 2015, 35, 984. (in Chinese) |
| [2] | ( 付拯江, 李兆杰, 熊起恒, 蔡琥, 有机化学, 2015, 35, 984.). |
| [3] | (a) Bouazzaoui O. ; Rousée K. ; Mulengi J.K. ; Pannecoucke X. ; Bouillon J.-P. ; Couve-Bonnaire S. Eur. J. Org. Chem. 201 8, 3705. |
| [3] | (b) Koy M. ; Sandfort F. ; Tlahuext-Aca A. ; Quach L. ; Daniliuc C.G. ; Glorius F. Chem.-Eur. J. 2018, 24, 1. |
| [3] | (c) Edwards J.T. ; Merchant R.R. ; McClymont K.S. ; Knouse K.W. ; Qin T. ; Malins L.R. ; Vokits B. ; Shaw S.A. ; Bao D.-H. ; Wei F.-L. ; Zhou T. ; Eastgate M.D. ; Baran P.S. Nature 2017, 545, 213. |
| [3] | (d) Zou J.P. ; Wu D.D. ; Luo J. ; Xing Q.J. ; Luo X.B. ; Dong W.H. ; Luo S.L. ; Du H.M. ; Suib S.L. ACS Catal. 2016, 6, 6861. |
| [3] | (e) Fu Z. ; Huang S. ; Su W. ; Hong M. Org. Lett. 2010, 12, 4992. |
| [3] | (f) Fu Z. ; Huang S. ; Kan J. ; Su W. ; Hong M. Dalton Trans. 2010, 39, 11317. |
| [4] | (a) Liu X. ; Wang Z. ; Cheng X. ; Li C. J. Am. Chem. Soc. 2012, 134, 14330. |
| [4] | (b) Huang L. ; Olivares A.M. ; Weix D.J. Angew. Chem., Int. Ed . 2017, 56, 11901. |
| [4] | (c) Yu Y. ; Chen X. ; Wu Q. ; Liu D. ; Hu L. ; Yu L. ; Tan Z. ; Gui Q. ; Zhu G. J. Org. Chem. 2018, 83, 8556. |
| [4] | (d) Jiang Q. ; Li H. ; Zhang X. ; Xu B. ; Su W. Org. Lett. 2018, 20, 2424. |
| [4] | (e) Hossian A. ; Manna K. ; Das P. ; Jana R. ChemistrySelect 2018, 3, 4315. |
| [5] | (a) Marcote D.C. ; Dauncey R.E. ; Douglas J.J. ; Ruffoni A. ; Leonori D. Org. Biomol. Chem. 2019, 17, 1839. |
| [5] | (b) Zhu Y. ; Li X. ; Wang X. ; Huang X. ; Shen T. ; Zhang Y. ; Sun X. ; Zou M. ; Song S. ; Jiao N. Org. Lett. 2015, 17, 4702. |
| [5] | (c) Liu C. ; Wang X. ; Li Z. ; Cui L. ; Li C. J. Am. Chem. Soc. 2015, 137, 9820. |
| [5] | (d) Wang Y. ; Liu R. ; Gao J. ; Jia Y. Chin. J. Org. Chem. 2017, 37, 691. (in Chinese) |
| [5] | ( 王永刚, 刘人荣, 高建荣, 贾义霞, 有机化学, 2017, 37, 691.). |
| [6] | (a) Yue H. ; Guo L. ; Liao H.-H. ; Cai Y. ; Zhu C. ; Rueping M. Angew. Chem., Int. Ed. 2017, 56, 1. |
| [6] | (b) Xu X.-L. ; Xu W.-T. ; Wu J.-W. ; He J.-B. ; Xu H.-J. Org. Biomol. Chem. 2016, 14, 9970. |
| [6] | (c) Kiyokawa K. ; Watanabe T. ; Fra L. ; Kojima T. ; Minakata S. J. Org. Chem. 2017, 82, 11711. |
| [6] | (d) Shen L. ; Zhang J. ; Xie J. Chin. J. Org. Chem. 2019, 39, 1153. (in Chinese) |
| [6] | ( 沈丽, 张洁, 谢建伟, 有机化学, 2019, 39, 1153.). |
| [7] | (a) Goossen L.J. ; Deng G. ; Levy L.M. Science 2006, 313, 662. |
| [7] | (b) Goossen L.J. ; Rodríguez N. ; Melzer B. ; Linder C. ; Deng G. ; Levy L.M. J. Am. Chem. Soc. 2007, 129, 4824. |
| [7] | (c) Tang J. ; Biafora A. ; Goossen L.J. Angew. Chem., Int. Ed. 2015, 54, 13130. |
| [7] | (d) Wang C. ; Piel I. ; Glorius F. J. Am. Chem. Soc. 2009, 131, 4194. |
| [7] | (e) Zhang F. ; Greaney M.F. Angew. Chem., Int. Ed. 2010, 49, 2768. |
| [7] | (f) Fang P. ; Li M. ; Ge H. J. Am. Chem. Soc. 2010, 132, 11898. |
| [7] | (g) Shang R. ; Ji D.-S. ; Chu L. ; Fu Y. ; Liu L. Angew. Chem., Int. Ed. 2011, 50, 4470. |
| [7] | (h) Dong W.H. ; Wu D.D. ; Luo J.M. ; Xing Q.J. ; Liu H. ; Zou J.P. ; Luo X.B. ; Min X.B. ; Liu H.L. ; Luo S.L. ; Au C.T. J. Catal. 2017, 349, 218. |
| [7] | (i) Pan F. ; Lei Z.-Q. ; Wang H. ; Li H. ; Sun J. ; Shi Z.-J. Angew. Chem., Int. Ed. 2013, 52, 2063. |
| [7] | (j) Kan J. ; Huang S. ; Lin J. ; Zhang M. ; Su W. Angew. Chem., Int. Ed. 2015, 54, 2199. |
| [8] | (a) Quibell J.M. ; Perry G.J.P. ; Cannas D.M. ; Larrosa I. Chem. Sci. 2018, 9, 3860. |
| [8] | (b) Tan X. ; Song T. ; Wang Z. ; Chen H. ; Cui L. ; Li C. Org. Lett. 2017, 19, 1634. |
| [8] | (c) Wang Z. ; Zhu L. ; Yin F. ; Su Z. ; Li Z. ; Li C. J. Am. Chem. Soc. 2012, 134, 4258. |
| [8] | (d) Perry G.J.P. ; Quibell J.M. ; Panigrahi A. ; Larrosa I. J. Am. Chem. Soc. 2017, 139, 11527. |
| [8] | (e) Song X.R. ; Li R. ; Ding H. ; Yang R. ; Xiao Q. ; Liang Y.M. Tetrahedron Lett. 2016, 57, 4519. |
| [8] | (f) Li Z. ; Wang K. ; Liu Z.-Q. Synlett 2014, 25, 2508. |
| [8] | (g) Kulbitski K. ; Nisnevich G. ; Gandelman M. Adv. Synth. Catal. 2011, 353, 1438. |
| [8] | (h) Wang D. ; Yuan Z. ; Liu Q. ; Chen P. ; Liu G. Chin. J. Chem. 2018, 36, 507. |
| [9] | (a) Tan X. ; Liu Z. ; Shen H. ; Zhang P. ; Zhang Z. ; Li C. J. Am. Chem. Soc. 2017, 139, 12430. |
| [9] | (b) Li Z. ; Cui Z. ; Liu Z.-Q. Org. Lett. 2013, 15, 406. |
| [9] | (c) Xu P. ; Abdukader A. ; Hu K. ; Cheng Y. ; Zhu C. Chem. Commun. 2014, 50, 2308. |
| [9] | (d) He Z. ; Zhang R. ; Hu M. ; Li L. ; Ni C. ; Hu J. Chem. Sci. 2013, 4, 3478. |
| [9] | (e) Hu F. ; Shao X. ; Zhu D. ; Lu L. ; Shen Q. Angew. Chem., Int. Ed. 2014, 53, 6105. |
| [9] | (f) Pan S. ; Huang Y. ; Qing F.-L. Chem.-Asian J. 2016, 11, 2854. |
| [9] | (h) Li M. ; Petersen J.L. ; Hoover J.M. Org. Lett. 2017, 19, 638. |
| [10] | (a) Candish L. ; Teders M. ; Glorius F. J. Am. Chem. Soc. 2017, 139, 7440. |
| [10] | (b) Jiang Y. ; Pan S. ; Zhang Y. ; Yu J. ; Liu H. Eur. J. Org. Chem. 2014, 2027. |
| [10] | (c) Li R. ; Chen X. ; Song X.R. ; Ding H. ; Wang P. ; Xiao Q. ; Liang Y.M. Adv. Synth. Catal. 2017, 359, 3962. |
| [10] | (d) Manna S. ; Jana S. ; Saboo T. ; Maji A. ; Maiti D. Chem. Commun. 2013, 49, 5286. |
| [10] | (e) Wang J. ; Li H. ; Leng T. ; Liu M. ; Ding J. ; Huang X. ; Wu H. ; Gao W. ; Wu G. Org. Biomol. Chem. 2017, 15, 9718. |
| [10] | (f) Qiao H. ; Sun S. ; Kang J. ; Yang F. ; Wu Y. ; Wu Y. Chin. J. Org. Chem. 2018, 38, 86. (in Chinese) |
| [10] | ( 乔辉杰, 孙素颜, 康建勋, 杨帆, 吴豫生, 吴养洁, 有机化学, 2018, 38, 86.). |
| [11] | Fu Z. ; Jiang Y. ; Wang S. ; Song Y. ; Guo S. ; Cai H. Org. Lett. 2019, 21, 3003. |
| [12] | Wang S. ; Fu Z. ; Huang Z. ; Jiang Y. ; Guo S. ; Cai H. Chin. Chem. Lett. 2019, 30, 1173. |
| [13] | Fu Z. ; Li Z. ; Xiong Q. ; Cai H. Eur. J. Org. Chem. 2014, 7798. |
| [14] | Fu Z. ; Li Z. ; Xiong Q. ; Cai H. RSC Adv. 2015, 5, 52101. |
| [15] | Li Z. ; Fu Z. ; Zhang H. ; Long J. ; Song Y. ; Cai H. New J. Chem. 2016, 40, 3014. |
| [16] | (a) Fu Z. ; Li Z. ; Song Y. ; Yang R. ; Liu Y. ; Cai H. J. Org. Chem. 2016, 81, 2794. |
| [16] | (b) Fu Z. ; Jiang L. ; Zuo Q. ; Li Z. ; Liu Y. ; Wei Z. ; Cai H. Org. Biomol. Chem. 2018, 16, 5416. |
| [16] | (c) Fu Z. ; Jiang Y. ; Jiang L. ; Li Z. ; Guo S. ; Cai H. Tetrahedron Lett. 2018, 59, 4458. |
| [16] | (d) Fu Z. ; Jiang L. ; Li Z. ; Jiang Y. ; Cai H. Synth.Commun. 2019, 49, 917. |
| [16] | (e) Fu Z. ; Cao X. ; Wang S. ; Guo S. ; Cai H. Org. Biomol. Chem. 2020, 18, 8381. |
| [17] | (a) Yan G. ; Zhang Y. ; Wang J. Adv. Synth. Catal. 2017, 359, 4068. |
| [17] | (b) Wen Q. ; Jin J. ; Zhang L. ; Luo Y. ; Lu P. ; Wang Y. Tetrahedron Lett. 2014, 55, 1271. |
| [18] | (a) Galli C. Chem. Rev. 1988, 88, 765. |
| [18] | (b) Lindley J. Tetrahedron 1984, 40, 1433. |
| [19] | (a) Ma L. ; Placzek M.S. ; Hooker J.M. ; Vasdev N. ; Liang S.H. Chem. Commun. 2017, 53, 6597. |
| [19] | (b) Shi S. ; Szostak M. Org. Lett. 2017, 19, 3095. |
| [19] | (c) Bag S. ; Jayarajan R. ; Dutta U. ; Chowdhury R. ; Mondal R. ; Maiti D. Angew. Chem., Int. Ed. 2017, 56, 12538. |
| [20] | (a) Kou X. ; Fan J. ; Tong X. ; Shen Z. Chin. J. Org. Chem. 2013, 33, 1407. (in Chinese) |
| [20] | ( 寇学振, 范佳骏, 童晓峰, 沈增明, 有机化学, 2013, 33, 1407.). |
| [20] | (b) Zhang W. ; Hu C. ; Zhou X. Chin. J. Org. Chem. 2017, 37, 1246. (in Chinese) |
| [20] | ( 张伟, 胡晨旭, 周向葛, 有机化学, 2017, 37, 1246.). |
| [20] | (c) Kou X. ; Zhao M. ; Qiao X. ; Zhu Y. ; Tong X. ; Shen Z. Chem. -Eur. J. 2013, 19, 16880. |
| [20] | (d) Pawar A.B. ; Chang S. Org. Lett. 2015, 17, 660. |
| [20] | (e) Malapit C.A. ; Reeves J.T. ; Busacca C.A. ; Howell A.R. ; Senanayake C.H. Angew. Chem., Int. Ed. 2016, 55, 326. |
| [20] | (f) Li X. ; Golz C. ; Alcarazo M. Angew. Chem., Int. Ed. 2019, 58, 9496. |
| [20] | (g) Chaitanya M. ; Anbarasan P. Org. Biomol. Chem. 2018, 16, 7084. |
| [21] | (a) Chen X. ; Hao X.-S. ; Goodhue C.E. ; Yu J.-Q. J. Am. Chem. Soc. 2006, 128, 6790. |
| [21] | (b) Ding S. ; Jiao N. J. Am. Chem. Soc. 2011, 133, 12374. |
| [21] | (c) Xu H. ; Liu P.-T. ; Li Y.-H. ; Han F.-S. Org. Lett. 2013, 15, 3354. |
| [22] | (a) Kim J. ; Chang S. J. Am. Chem. Soc. 2010, 132, 10272. |
| [22] | (b) Kim J. ; Choi J. ; Shin K. ; Chang S. J. Am. Chem. Soc. 2012, 134, 2528. |
| [22] | (c) Xu S. ; Teng J. ; Yu J.-T. ; Sun S. ; Cheng J. Org. Lett. 2019, 21, 9919. |
| [22] | (d) Zhang G. ; Ren X. ; Chen J. ; Hu M. ; Cheng J. Org. Lett. 2011, 13, 5004. |
| [22] | (e) Ren X. ; Chen J. ; Chen F. ; Cheng J. Chem. Commun. 2011, 47, 6725. |
| [23] | Grainger R. ; Cornella J. ; Blakemore D.C. ; Larrosa I. ; Campanera J.M. Chem.-Eur. J. 2014, 20, 16680. |
| [24] | McElhinny C.J. , Jr; Carroll, F.I.; Lewin, A.H. Synthesis 2012, 44, 57. |
| [25] | Chong D.J. ; Lerman A.M. Curr. Neurol. Neurosci. Rep. 2016, 16, 39. |
| [26] | Lu H.-T. ; Geng Z.-Y. ; Zou D.-P. ; Wu Y.-S. ; Wu Y.-J. Org. Lett. 2016, 18, 2774. |
| [27] | Baur A. ; Bustin K.A. ; Auilera E. ; Petersen J.L. ; Hoover J.M. Org. Chem. Front. 2017, 4, 519. |
| [28] | (a) Li C.-J. Acc. Chem. Res. 2009, 42, 335. |
| [28] | (b) Shirakawa E. ; Uchiyama N. ; Hayashi T. J. Org. Chem. 2011, 76, 25. |
| [28] | (c) Zhang L. ; Lu P. ; Wang Y. Chem. Commun. 2015, 51, 2840. |
| [29] | Chiba S. ; Zhang L. ; Lee J.-Y. J. Am. Chem. Soc. 2010, 132, 7266. |
| [30] | Sánchez-Viesca F. ; Berros M. Heterocycles 2002, 57, 1869. |
| [31] | Queiroz M.R.P. ; Calhelhaa R.C. ; Kirsch G. Tetrahedron 2007, 63, 13000. |
| [32] | Manetsch R. ; Zheng L. ; Reymond M.T. ; Woggon W.-D. ; Reymond J.-L. Chem.-Eur. J. 2004, 10, 2487. |
| [33] | Rezaei R. ; Mohammadi M.K. ; Rastin N. Chin. J. Chem. 2010, 28, 993. |
| [34] | Hauptschein M. ; Nodiff E.A. ; Saggiomo A.J. J. Am. Chem. Soc. 1954, 76, 1051. |
| [35] | Kreimeyer A. ; Laube B. ; Sturgess M. ; Goeldner M. ; Foucaud B. J. Med. Chem. 1999, 42, 4394. |
| [36] | Miroslav P. ; Jiri J. ; Miroslav R. ; Josef P. ; Miroslav R. ; Jiri H. ; Emil S. ; Jirina M. Collect. Czech. Chem. Commun. 1986, 42, 4394. |
| [37] | Candiani I. ; D’Arasmo G. ; Heidempergher F. ; Tomasi A. Org. Process Res. Dev. 2009, 13, 456. |
/
| 〈 |
|
〉 |