

一锅两步策略高效合成3-芳基-4-(芳硫基)-1H-吡唑-5-胺衍生物
收稿日期: 2021-07-21
修回日期: 2021-08-24
网络出版日期: 2021-09-08
基金资助
国家自然科学基金(21563025)
One-Pot Two-Step Strategy for Efficient Synthesis of 3-Aryl-4-(arylthio)-1H-pyrazol-5-amines Derivatives
Received date: 2021-07-21
Revised date: 2021-08-24
Online published: 2021-09-08
Supported by
National Natural Science Foundation of China(21563025)
冯易浇 , 何静 , 韦玥婷 , 汤婷 , 李春天 , 刘平 . 一锅两步策略高效合成3-芳基-4-(芳硫基)-1H-吡唑-5-胺衍生物[J]. 有机化学, 2022 , 42(1) : 226 -234 . DOI: 10.6023/cjoc202107045
One-pot two-step reaction of 3-oxo-3-arylpropanenitriles, methyl hydrazinecarboxylate (or hydrazine hydrate), and arylsulfonyl hydrazides has been established, and a series of 3-aryl-4-(arylthio)-1H-pyrazol-5-amines were constructed by sequential cyclization, sulfenylation, and removal of COOMe group under the action of I2 and N-iodo-succininide (NIS), respectively. The method represents good atomic economy, mild reaction conditions, broad substrate scope, and gram-scale synthesis. Moreover, the further transformations of 3-aryl-4-(arylthio)-1H-pyrazol-5-amine products were also investigated.
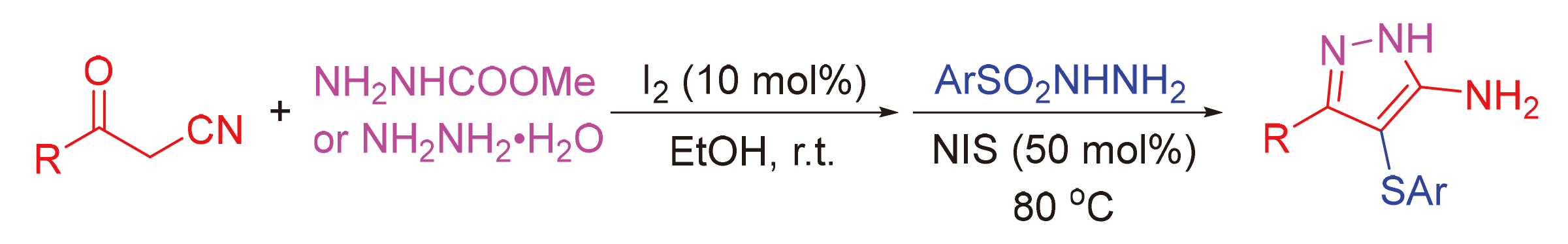
Key words: one-pot two-step; 1H-pyrazol-5-amine; cyclization; sulfenylation
| [1] | Daidone, G.; Maggio, B.; Plescia, S.; Raffa, D.; Musiu, C.; Milia, C.; Perra, G.; Marongiu, M. E. Eur. J. Med. Chem. 1998, 33, 375. |
| [2] | Penning, T. D.; Talley J. J.; S. R. Bertenshaw, S. R.; J. S. Carter, J. S.; Collins, P. R.; Docter, S.; Graneto, M. J.; Lee, L. F.; Malecha, J. W.; Miyashiro, J. M.; Rogers, R. S.; Rogier, D. S.; Yu, S. S.; Anderson, G. G.; Burton, E. G.; Cogburn, J. N.; S. A. Gregory, S. A.; Koboldt, C. M.; Perkins, W. E.; Seibert, K.; Veenhuizen, A. W.; Zhang, Y. Y.; Isakson, P. C. J. Med. Chem. 1997, 40, 1347. |
| [3] | Elvin, L. A.; John, E. C.; Leon, C. G.; John, J. L.; Harry, E. R. J. Med. Chem. 1964, 7, 259. |
| [4] | Fancelli, D.; Berta, D.; Bindi, S.; Cameron, A.; Cappella, P.; Carpinelli, P.; Catana, C.; Forte, B.; Giordano, P.; Giorgini, M. L.; Mantegani, S.; Marsiglio, A.; Meroni, M.; Moll, J.; Pittala, V.; Roletto, F.; Severino, D.; Soncini, C.; Storici, P.; Tonani, R.; Varasi, M.; Vulpetti, A.; Vianello, P. J. Med. Chem. 2005, 48, 3080. |
| [5] | (a) Pevarello, P.; Brasca, M. G.; Orsini, P.; Traquandi, G.; Longo, A.; Nesi, M.; Orzi, F.; Piutti, C.; Sansonna, P.; Varassi, M.; Cameron, A.; Vulpetti, A.; Roletto, F.; Alzani, R.; Ciomei, M.; Alanese, C.; Pastori, W.; Marsiglio, A.; Pesenti, E.; Fiorentini, F.; Bischoff, R.; Mercurio, C. J. Med. Chem. 2005, 48, 2944. |
| [5] | (b) Kuma, Y.; Sabio, G.; Bain, J.; Shpiro, N.; Márquez, R.; Cuenda, A. J. Biol. Chem. 2005, 280, 19472. |
| [6] | Bagley, M. C.; Davis, T.; Dix, M. C.; Widdowson, M. C.; Kipling, D. Org. Biomol. Chem. 2006, 4, 4158. |
| [7] | Dong, J. J.; Li, Q. S.; Wang, S. F.; Li, C. Y.; Zhao, X.; Qiu, H. Y.; Zhao, M. Y.; Zhu, H. L. Org. Biomol. Chem. 2013, 11, 6328. |
| [8] | Wang, S. F.; Yin, Y.; Zhang, Y. L.; Mi, S. W.; Zhao, M. Y.; Lv, P. C.; Wang; B. Z.; Zhu, H. L. Eur. J. Med. Chem. 2015, 93, 291. |
| [9] | (a) Allah, A. G. G.; Hefny, M. M.; Salih, El-Basiouny, M. S. Corrosion 1989, 45, 574. |
| [9] | (b) Allah, A. G.; Badawy, M. W.; Reham, H. H.; Abou-Romia, M. M. J. Appl. Electrochem. 1989, 19, 928. |
| [9] | (c) Badawy, W. A.; Hefny, M. M.; El-Egamy, S. S. Corrosion 1990, 46, 978. |
| [9] | (d) Abou-Romia, M. M.; Abd El-Rahaman, H. A.; El-Sayed, H. A. M. Bull. Electrochem. 1990, 6, 757. |
| [10] | Joshi, K. C.; Pathak, V. N.; Garg, U J. Heterocycl. Chem. 1979, 16, 1141. |
| [11] | Hanefeld, U.; Rees, C. W.; White, A. J. P. J. Chem. Soc., Perkin Trans. 1996, 1, 1545. |
| [12] | (a) Dodd, D. S.; Martinez, R. L.; Kamau, M.; Ruam, Z.; Kirk, K. V.; Cooper, C. B.; Hermsmeier, M. A.; Traeger, S. C., Poss, M. A.; J. Comb. Chem. 2005, 7, 584. |
| [12] | (b) Villemin, D.; Benalloum, A. Synth. Commun. 1991, 21, 1. |
| [13] | Ioannidou, H. A.; Koutentis, P. A. Tetrahedron 2009, 65, 7023. |
| [14] | Bagley, M. C.; Davis, T.; Dix, M. C.; Widdowson, C. S.; Kipling, D. Org. Biomol. Chem. 2006, 4, 4158. |
| [15] | Su, W. N.; Lin, T. P.; Cheng, K. M.; Sung, K. C.; Lin, S. K.; Wong, F. F. J. Heterocycl. Chem. 2010, 47, 831. |
| [16] | Kim, B. R.; Sung, G. H.; Ryu, K. E.; Lee, S. G.; Yoon, H. J.; Shin, D. S.; Yoon, Y. J. Chem. Commun. 2015, 51, 9201. |
| [17] | Zora, M.; Kivrak, A. J. Org. Chem. 2011, 76, 9379. |
| [18] | Reddy, G. J.; Latha, D.; Rao, K. S. Org. Prep. Proced. Int. 2004, 36, 494. |
| [19] | Kirkham, J. D.; Edeson, S. J.; Stokes, S.; Harrity, J. P. Org. Lett. 2012, 14, 5354. |
| [20] | Senadi, G. C.; Hu, W. P.; Lu, T. Y.; Garkhedkar, A. M.; Vandavasi, J. K.; Wang, J. J. Org. Lett. 2015, 17, 1521. |
| [21] | Ma, C.; Wen, P.; Li, J.; Han, X.; Wu, Z.; Huang, G. Adv. Synth. Catal. 2016, 358, 1073. |
| [22] | (a) Suryakiran, N.; Reddy, T. S.; Latha, K. A.; Prabhakar, P.; Yadagiri, K.; Venkateswarlu, Y. J. Mol. Catal. A: Chem. 2006, 258, 371. |
| [22] | (b) Suryakiran, N.; Ramesh, D.; Venkateswarlu, Y. Green Chem. Lett. Rev. 2007, 1, 73. |
| [22] | (c) Everson, N.; Yniguez, K.; Loop, L.; Lazaro, H.; Belanger, B.; Koch, G.; Bach, J.; Manjunath, A.; Schioldager, R.; Law, J.; Grabenauer, M.; Eagon, S. Tetrahedron Lett. 2019, 60, 72. |
| [22] | (d) Kelada, M.; Walsh, J. M. D.; Devine, R. W.; McArdle, P.; Stephens, J. C. Beilstein J. Org. Chem. 2018, 14, 1222. |
| [23] | (a) Shaabani, A.; Nazeri, M. T.; Afshari, R. Mol. Diversity 2019, 23, 751. |
| [23] | (b) Sun, K.; Li, G.; Li, Y.; Yu, J.; Zhao, Q.; Zhang, Z.; Zhang, G. Adv. Synth. Catal. 2020, 362, 1947. |
| [24] | Wang, P.; Xie, Z.; Hong, Z.; Tang, J.; Wong, O.; Lee, C. S.; Wong, N.; Lee, S. J. Mater. Chem. 2003, 13, 1894. |
| [25] | Fan, W.; Ye, Q.; Xu, H. W.; Jiang, B.; Wang, S. L.; Tu, S. J. Org. Lett. 2013, 15, 2258. |
| [26] | Jiang, B.; Fan, W.; Sun, M. Y.; Ye, Q.; Wang, S. L.; Tu, S. J.; Li, G. J. Org. Chem. 2014, 79, 5258. |
| [27] | Tu, X. J.; Hao, W. J.; Ye, Q.; Wang, S. S.; Jiang, B.; Li, G.; Tu, S. J. J. Org. Chem. 2014, 79, 11110. |
| [28] | Simpkins, N. S. In Sulfones in Organic Synthesis, Ed.: Baldwin, J. E., Pergamon Press, Oxford, UK, 1993. |
| [29] | Asai, T.; Takeuchi, T.; Diffenderfer, J.; Sibley, D. L. Antimicrob. Agents Chemother.. 2002, 46, 2393. |
| [30] | (a) Caddick, S.; Aboutayab, K.; West, R. Synlett 1993, 231. |
| [30] | (b) Wei, W.; Bao, P.; Yue, H.; Liu, S.; Wang, L.; Li, Y.; Yang, D. Org. Lett. 2018, 20, 5291. |
| [30] | (c) Sun, P.; Yang, D.; Wei, W.; Jiang, M.; Wang, Z.; Zhang, L.; Zhang, H.; Zhang, Z.; Wang, Y.; Wang, H. Green Chem. 2017, 19, 4785. |
| [31] | Ragno, R.; Coluccia, A.; La Regina, G.; De Martino, G.; Piscitelli, F.; Lavecchia, A.; Novellino, E.; Bergamini, A.; Ciaprini, C.; Sinistro, A.; Maga, G.; Crespan, E.; Artico, M.; Silvestri, R. J. Med. Chem. 2006, 49, 3172. |
| [32] | Silvestri, R.; De Martino, G.; La Regina, G.; Artico, M.; Massa, S.; Vargiu, L.; Mura, M.; Loi, A. G.; Marceddu, T.; La Colla, P. J. Med. Chem. 2003, 46, 2482. |
| [33] | Avis, I.; Martínez, A.; Tauler, J.; Zudaire, E.; Mayburd, A.; Abu- Ghazaleh, R.; Ondrey, F.; Mulshine, J. L. Cancer Res. 2005, 65, 4181. |
| [34] | De Martino, G.; La Regina, G.; Coluccia, A.; Edler, M. C.; Barbera, M. C.; Brancale, A.; Wilcox, E.; Hamel, E.; Artico, M.; Silvestri, R. J. Med. Chem. 2004, 47, 6120. |
| [35] | Funk, C. D. Nat. Rev. Drug Discovery 2005, 4, 664. |
| [36] | Kaneda, K.; Mitsudome, T. Chem. Rec. 2017, 17, 1. |
| [37] | Shen, C.; Zhang, P.; Sun, Q.; Bai, S.; Hor, T. A.; Liu, X. Chem. Soc. Rev. 2015, 44, 291. |
| [38] | Qiu, G.; Zhou, K.; Wu, J. Chem. Commun. 2018, 54, 12561. |
| [39] | Dong, D. Q.; Hao, S. H.; Yang, D. S.; Li, L. X.; Wang, Z. L. Eur. J. Org. Chem. 2017, 45, 6576. |
| [39] | (a) Liu, Y.; Xiong, J.; Wei, L. Chin. J. Org. Chem. 2017, 37, 1667. (in Chinese) |
| [39] | (刘云云, 熊进, 韦丽, 有机化学, 2017, 37, 1667.) |
| [39] | (b) Xu, X. M.; Chen, D. M.; Wang, Z. L. Chin. J. Org. Chem. 2019, 39, 3338. (in Chinese) |
| [39] | (徐鑫明, 陈德茂, 王祖利, 有机化学, 2019, 39, 3338.) |
| [39] | (c) Chen, S. H.; Wang, M.; Jiang, X. F. Acta Phys.-Chim. Sin. 2019, 35, 954. (in Chinese) |
| [39] | (陈世豪, 王明, 姜雪峰, 物理化学学报, 2019, 35, 954.) |
| [39] | (d) Liu, Y. Y.; Xiong, J.; Wei, L. Chin. J. Org. Chem. 2017, 37, 1667. (in Chinese) |
| [39] | (刘云云, 熊进, 韦丽, 有机化学, 2017, 37, 1667.) |
| [39] | (e) Xu, X. M.; Yang, H. L.; Li, W. Z. Chin. J. Org. Chem. 2020, 40, 1912. (in Chinese) |
| [39] | (徐鑫明, 杨翰林, 李文忠, 有机化学, 2020, 40, 1912.) |
| [39] | (f) Xu, X. M.; Li, J. Z.; Wang, Z. L. Chin. J. Org. Chem. 2020, 40, 886. (in Chinese) |
| [39] | (徐鑫明, 李家柱, 王祖利, 有机化学, 2020, 40, 886.) |
| [39] | (g) Li, Y.; Wan, J. Chin. J. Org. Chem. 2020, 40, 3889. (in Chinese) |
| [39] | (李毅, 万结平, 有机化学, 2020, 40, 3889.) |
| [40] | (a) Wang, L.; Zhang, M.; Zhang, Y.; Liu, Q.; Zhao, X.; Li, J.; Luo, Z.; Wei, W. Chin. Chem. Lett. 2020, 31, 67. |
| [40] | (b) Liu, Q.; Lv, Y.; Liu, R.; Zhao, X.; Wang, J.; Wei, W. Chin. Chem. Lett. 2021, 32, 136. |
| [40] | (a) Armstrong, R. W.; Combs, A. P.; Tempest, P. A.; Brown, S. D.; Keating, T. A. Acc. Chem. Res. 1996, 29, 123. |
| [40] | (b) Dömling, A.; Ugi, I. Angew. Chem., nt. Ed. 2000, 39, 3168. |
| [41] | (a) Meng, N.; Lv, Y.; Liu, Q.; Liu, R.; Zhao, X.; Wei, W. Chin. Chem. Lett. 2021, 32, 258. |
| [41] | (b) Gui, Q. W.; Wang, B. B.; Zhu, S.; Li, F. L., Zhu, M. X..; Yi, M.; Yu, J. L.; Wu, Z.-L.; He, W. M. Green Chem. 2021, 23, 4430. |
| [41] | (c) Wu, Y.; Chen, J.Y.; Ning, J.; Jiang, X.; Deng, J.; Deng, Y.; Xu, R.; He, W. M. Green Chem. 2021, 23, 3950. |
| [41] | (d) Wang, S. C.; Liu, P. Y.; Chen, Y. X.; Shen, Z. J.; Hao, W. J.; Tu, S. J.; Jiang, B. Chem. Commun. 2021, 57, 7966. |
| [41] | (e) Li, Q. X.; Li, M. W.; Shi, S. Q.; Ji, X. S.; He, C. L.; Jiang, B.; Hao, W. J. Chin. J. Org. Chem. 2020, 40, 384. (in Chinese) |
| [41] | (李庆雪, 李梦伟, 时绍青, 季晓霜, 何春兰, 姜波, 郝文娟, 有机化学, 2020, 40, 384.) |
| [41] | (f) Zhang, T. S.; Hao, W. J.; Wang, R.; Wang, S. C.; Tu, S. J.; Jiang, B. Green Chem. 2020, 22, 4259. |
| [42] | Sun, J.; Qiu, J. K.; Zhu, Y. L.; Guo, C.; Hao, W. J.; Jiang, B.; Tu, S. J. J. Org. Chem. 2015, 80, 8217. |
| [43] | Sun, J.; Qiu, J. K.; Jiang, B.; Hao, W. J.; Guo, C.; Tu, S. J. J. Org. Chem. 2016, 81, 3321. |
| [44] | Wei, Y.; Liu, P.; Liu, Y.; He, J.; Li, X.; Li, S.; Zhao, J. Org. Biomol. Chem. 2021, 19, 3932. |
| [45] | (a) Chen, L. J.; Zhang, J.; Wei, Y. T.; Yang, Z.; Liu, P.; Zhang, J; Dai, B. Tetrahedron 2019, 75, 130664. |
| [45] | (b) Wei, Y. T.; He, J.; Liu, Y. L.; Xu, L.; Vaccaro, L.; Liu, P.; Gu, Y. L. ACS Omega 2020, 5, 18515. |
| [45] | (c) Wei, Y. T.; Liu, Y. L.; He, J.; Li, X. Z.; Liu, P.; Zhang, J. Tetrahedron 2020, 76, 131646. |
| [45] | (d) He, J.; Wei, Y. T.; Li, X. Z.; Dai, B.; Liu, P. Synthesis 2022, 54, 490. |
| [46] | (a) Yang, F. L.; Wang, F. X.; Wang, T. T.; Wang, Y. J.; Tian, S. K. Chem. Commun. 2014, 50, 2111. |
| [46] | (b) Yang, F. L.; Tian, S. K. Angew. Chem., Int. Ed. 2013, 52, 1. |
| [47] | Yang, F. L.; Yang, G.; Yu, B. K.; Jin, Y. X.; Tian, S. K. Adv. Synth. Catal. 2016, 358, 3368. |
| [48] | Zhang, J.; Li, W.; Liu, Y.; Liu, P. ChemistrySelect 2020, 5, 5497. |
| [49] | Talla, A.; Driessen, B.; Straathof, N. J.; Milroy, L. G.; Brunsveld, L.; Hessel, V.; Noel, T. Adv. Synth. Catal, 2015, 357, 2180. |
| [50] | Lv, Y.; Luo, J.; Ma, Y.; Dong, Q.; He, L. Org. Chem. Front. 2021, 8, 2461. |
/
| 〈 |
|
〉 |