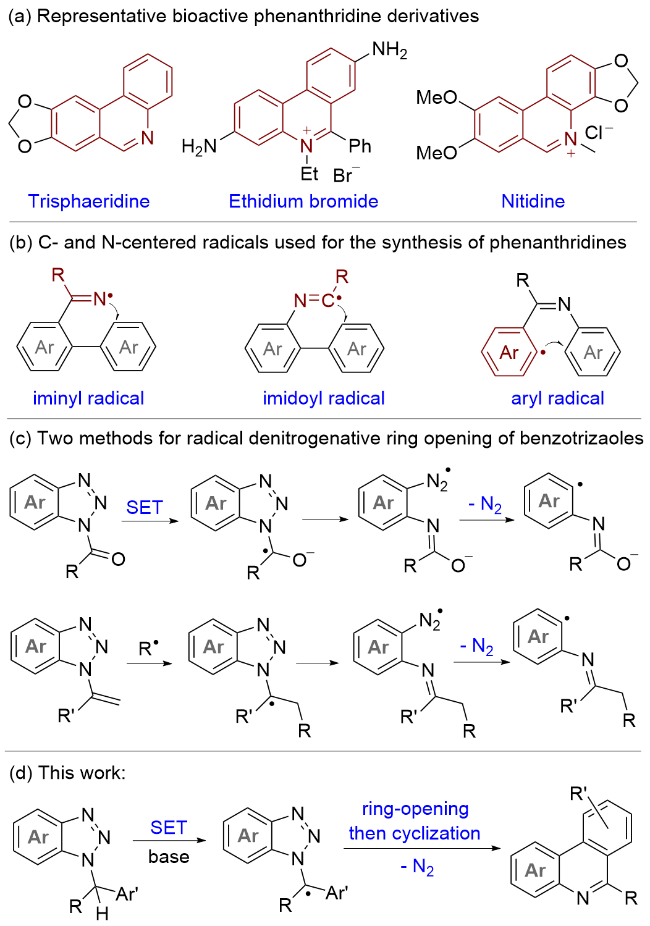
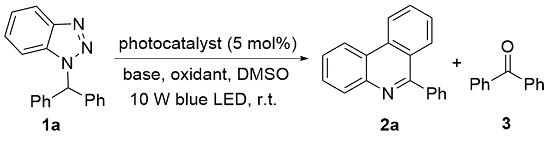
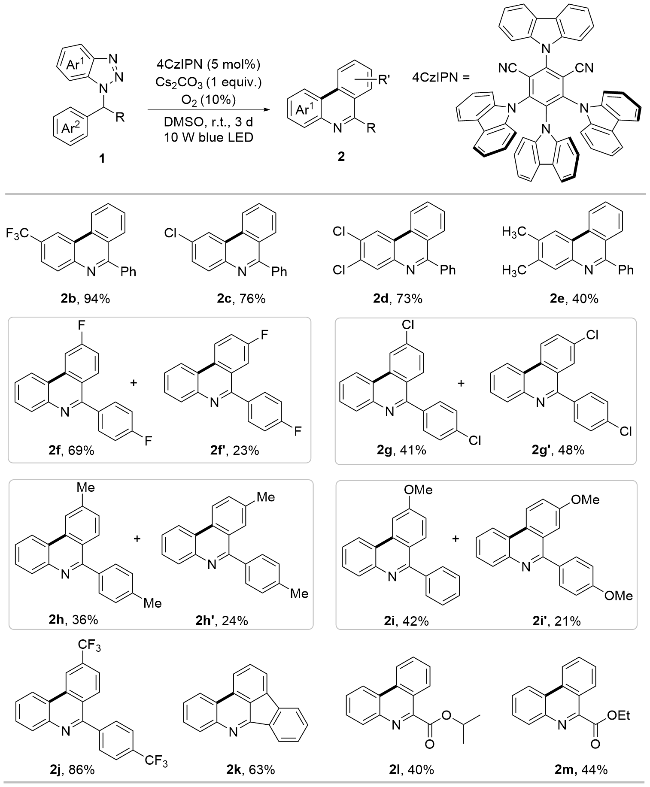
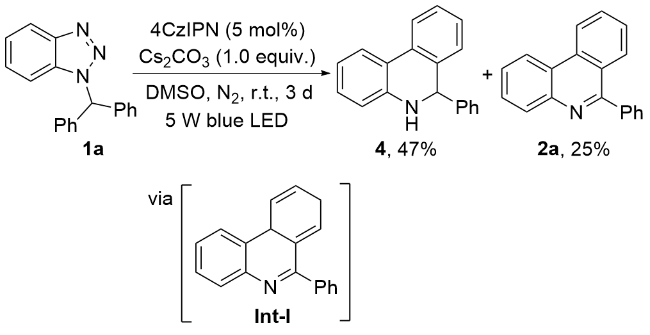
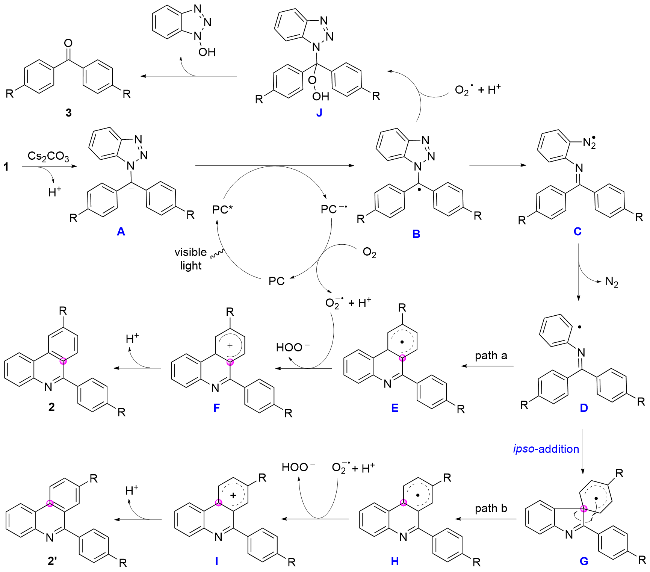
1 结果与讨论
表1 反应条件优化aTable 1 Optimization of reaction conditions |
| Entry | Photocatalyst | Base | Oxidant | Yieldb/% | |
|---|---|---|---|---|---|
| 2a | 3 | ||||
| 1 | Ru(bpy)3Cl2 | Cs2CO3 | Air | 45 | 52 |
| 2 | Ru(phen)3Cl2 | Cs2CO3 | Air | 22 | 73 |
| 3 | Eosin B | Cs2CO3 | Air | 35 | 55 |
| 4 | Riboflavin | Cs2CO3 | Air | 0 | 0 |
| 5 | FeFc | Cs2CO3 | Air | 0 | 63 |
| 6 | Rose Bengal | Cs2CO3 | Air | Trace | 0 |
| 7 | Methylene blue | Cs2CO3 | Air | 15 | 83 |
| 8 | Acr+ | Cs2CO3 | Air | 34 | 43 |
| 9 | 4CzIPN | Cs2CO3 | Air | 64 | 22 |
| 10 | 4CzIPN | tBuOK | Air | 15 | 42 |
| 11 | 4CzIPN | K2CO3 | Air | 0 | 0 |
| 12 | 4CzIPN | NaHCO3 | Air | 0 | 0 |
| 13 | 4CzIPN | DABCO | Air | 17 | 0 |
| 14 | 4CzIPN | Cs2CO3 | O2 | 34 | 56 |
| 15c | 4CzIPN | Cs2CO3 | O2 (10%) | 87 | 11 |
| 16d | 4CzIPN | Cs2CO3 | O2 (5%) | 78 | 19 |
| 17e | 4CzIPN | Cs2CO3 | O2 (10%) | 0 | 0 |
| 18 | 4CzIPN | None | O2 (10%) | 0 | 0 |
| 19 | None | Cs2CO3 | O2 (10%) | Trace | 0 |
a Reaction conditions: 1a (0.2 mmol), base (2.5 equiv.), photocatalyst (5 mol%), oxidant, DMSO (1.5 mL), r.t., 10 W blue LED, 24 h. b Isolated yield. c 3 d. d 8 d. e In the dark. |