化学学报 ›› 2024, Vol. 82 ›› Issue (1): 1-4.DOI: 10.6023/A23100472 上一篇 下一篇
研究通讯
投稿日期:2023-10-27
发布日期:2023-12-20
基金资助:
Weiyang Gao, Weichao Deng, Yang Gao, Renxiao Liang, Yixia Jia( )
)
Received:2023-10-27
Published:2023-12-20
Contact:
E-mail: Supported by:文章分享
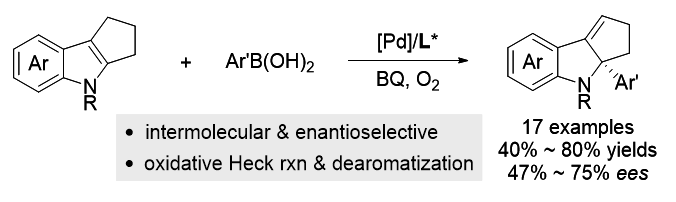
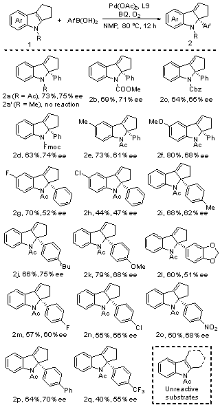
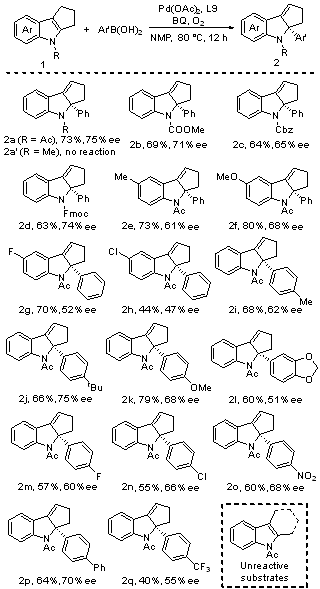
过渡金属催化的不对称去芳构化反应是合成手性环状化合物的直接方法之一. 近年来, 基于Heck反应已成功实现吲哚、苯并呋喃、吡咯、呋喃及萘等芳香化合物的不对称去芳构化反应. 然而, 现有报道往往局限于分子内反应, 分子间不对称去芳构化Heck反应仍有待研究. 与Heck反应相比, 氧化Heck反应由于反应条件相对温和且可能经历离子型催化机理, 利于实现分子间去芳构化反应并控制其对映选择性. 本工作发展了钯催化吲哚与芳基硼酸的分子间不对称去芳构化氧化Heck反应. 以Pd(OAc)2为催化剂前体、吡啶-噁唑啉为手性配体、苯醌-氧气为氧化剂, 以中等至良好的收率及中等水平的ee值, 合成了一系列含有C2-季碳手性中心的手性吲哚啉衍生物.
高炜洋, 邓伟超, 高扬, 梁仁校, 贾义霞. 吲哚分子间不对称去芳构化氧化Heck反应[J]. 化学学报, 2024, 82(1): 1-4.
Weiyang Gao, Weichao Deng, Yang Gao, Renxiao Liang, Yixia Jia. Intermolecular Enantioselective Dearomative Oxidative Heck Reaction of Indoles[J]. Acta Chimica Sinica, 2024, 82(1): 1-4.
| Entry | Ligand | Co-oxidant | Solvent | Yieldb/% | eec/% |
|---|---|---|---|---|---|
| 1 | 1,10-Phen | — | DMF | 13 | — |
| 2 | 1,10-Phen | — | THF | n.d. | — |
| 3 | 1,10-Phen | — | MeCN | n.d. | — |
| 4 | 1,10-Phen | — | MeOH | n.d. | — |
| 5 | 1,10-Phen | — | NMP | 21 | — |
| 6 | 1,10-Phen | — | 1,4-Dioxane | 6 | — |
| 7 | 1,10-Phen | FeCl3 | NMP | n.d. | — |
| 8 | 1,10-Phen | CuCl2 | NMP | 15 | — |
| 9 | 1,10-Phen | BQ | NMP | 64 | — |
| 10 | 1,10-Phen | DDQ | NMP | 47 | — |
| 11 | 1,10-Phen | 2,6-DMBQ | NMP | 56 | — |
| 12 | L1 | BQ | NMP | 51 | rac |
| 13 | L2 | BQ | NMP | 55 | 19 |
| 14 | L3 | BQ | NMP | 32 | 3 |
| 15 | L4 | BQ | NMP | 60 | 13 |
| 16 | L5 | BQ | NMP | 72 | 17 |
| 17 | L6 | BQ | NMP | 27 | 44 |
| 18 | L7 | BQ | NMP | 64 | 53 |
| 19 | L8 | BQ | NMP | 60 | 70 |
| 20 | L9 | BQ | NMP | 73 | 75 |
| 21 | L10 | BQ | NMP | 49 | 20 |
| 22d | L9 | BQ | NMP | 51 | 73 |
| Entry | Ligand | Co-oxidant | Solvent | Yieldb/% | eec/% |
|---|---|---|---|---|---|
| 1 | 1,10-Phen | — | DMF | 13 | — |
| 2 | 1,10-Phen | — | THF | n.d. | — |
| 3 | 1,10-Phen | — | MeCN | n.d. | — |
| 4 | 1,10-Phen | — | MeOH | n.d. | — |
| 5 | 1,10-Phen | — | NMP | 21 | — |
| 6 | 1,10-Phen | — | 1,4-Dioxane | 6 | — |
| 7 | 1,10-Phen | FeCl3 | NMP | n.d. | — |
| 8 | 1,10-Phen | CuCl2 | NMP | 15 | — |
| 9 | 1,10-Phen | BQ | NMP | 64 | — |
| 10 | 1,10-Phen | DDQ | NMP | 47 | — |
| 11 | 1,10-Phen | 2,6-DMBQ | NMP | 56 | — |
| 12 | L1 | BQ | NMP | 51 | rac |
| 13 | L2 | BQ | NMP | 55 | 19 |
| 14 | L3 | BQ | NMP | 32 | 3 |
| 15 | L4 | BQ | NMP | 60 | 13 |
| 16 | L5 | BQ | NMP | 72 | 17 |
| 17 | L6 | BQ | NMP | 27 | 44 |
| 18 | L7 | BQ | NMP | 64 | 53 |
| 19 | L8 | BQ | NMP | 60 | 70 |
| 20 | L9 | BQ | NMP | 73 | 75 |
| 21 | L10 | BQ | NMP | 49 | 20 |
| 22d | L9 | BQ | NMP | 51 | 73 |
| [1] |
(a) Mizoroki, T.; Mori, K.; Ozaki, A. Bull. Chem. Soc. Jpn. 1971, 44, 581.
doi: 10.1246/bcsj.44.581 |
|
(b) Heck, R. F.; Nolley, J. P. J. Org. Chem. 1972, 37, 2320.
doi: 10.1021/jo00979a024 |
|
| [2] |
For selected reviews of Heck reaction, see: (a) Heck, R. F. Acc. Chem. Res. 1979, 12, 146.
doi: 10.1021/ar50136a006 |
|
(b) Cabri, W.; Candiani, I. Acc. Chem. Res. 1995, 28, 2.
doi: 10.1021/ar00049a001 |
|
|
(c) Le Bras, J.; Muzart, J. Chem. Rev. 2011, 111, 1170.
doi: 10.1021/cr100209d |
|
|
(d) Paul, D.; Das, S.; Saha, S.; Sharma, H.; Goswami, R. K. Eur. J. Org. Chem. 2021, 2021, 2057.
doi: 10.1002/ejoc.v2021.14 |
|
| [3] |
(a) Sato, Y.; Sodeoka, M.; Shibasaki, M. J. Org. Chem. 1989, 54, 4738.
doi: 10.1021/jo00281a007 |
|
(b) Carpenter, N. E.; Kucera, D. J.; Overman, L. E. J. Org. Chem. 1989, 54, 5846.
doi: 10.1021/jo00286a009 |
|
| [4] |
For selected reviews of asymmetric Heck reaction, see: (a) Dounay, A. B.; Overman, L. E.; Chem. Rev. 2003, 103, 2945.
pmid: 21677934 |
|
(b) Shibasaki, M.; Vogl, E. M.; Ohshima, T. Adv. Synth. Catal. 2004, 346, 1533.
doi: 10.1002/adsc.v346:13/15 pmid: 21677934 |
|
|
(c) Cartney, D. M.; Guiry, P. J. Chem. Soc. Rev. 2011, 40, 5122.
doi: 10.1039/c1cs15101k pmid: 21677934 |
|
|
(d) Li, H.; Ding, C.; Xu, B.; Hou, X. Acta Chim. Sinica 2014, 72, 765. (in Chinese)
doi: 10.6023/A14040329 pmid: 21677934 |
|
|
(李浩, 丁昌华, 许斌, 侯雪龙, 化学学报, 2014, 72, 765.)
doi: 10.6023/A14040329 pmid: 21677934 |
|
|
(e) Xie, J.-Q.; Liang, R.-X.; Jia, Y.-X. Chin. J. Chem. 2021, 39, 710.
doi: 10.1002/cjoc.v39.3 pmid: 21677934 |
|
|
(f) Li, S.; Chen, Q.; Zhang, Z.-M.; Zhang, J. Green Synth. Catal. 2021, 2, 374.
pmid: 21677934 |
|
| [5] |
For selected reviews of catalytic dearomatization reactions, see: (a) Pouység, L.; Deffieux, D.; Quideau, S.; Tetrahedron 2010, 66, 2235.
doi: 10.1016/j.tet.2009.12.046 |
|
(b) Roche, S. P.; Porco, J. A. Angew. Chem., Int. Ed. 2011, 50, 4068.
doi: 10.1002/anie.v50.18 |
|
|
(c) Zhuo, C.-X.; Zhang, W.; You, S.-L. Angew. Chem., Int. Ed. 2012, 51, 12662.
doi: 10.1002/anie.v51.51 |
|
|
(d) Zheng, C.; You, S.-L. Chem 2016, 1, 830.
doi: 10.1016/j.chempr.2016.11.005 |
|
|
(e) Wu, W.-T.; Zhang, L.; You, S.-L. Chem. Soc. Rev. 2016, 45, 1570.
doi: 10.1039/C5CS00356C |
|
|
(f) Sun, W.; Li, G.; Hong, L.; Wang, R. Org. Biomol. Chem. 2016, 14, 2164.
doi: 10.1039/C5OB02526E |
|
|
(g) Huang, G.; Yin, B. Adv. Synth. Catal. 2019, 361, 405.
doi: 10.1002/adsc.v361.3 |
|
|
(h) Wang, Z. Org. Biomol. Chem. 2020, 18, 4354.
doi: 10.1039/D0OB00818D |
|
|
(i) Zheng, C.; You, S.-L. ACS Cent. Sci. 2021, 7, 432.
doi: 10.1021/acscentsci.0c01651 |
|
|
(j) Liang, R.-X.; Jia, Y.-X. Acc. Chem. Res. 2022, 55, 734.
doi: 10.1021/acs.accounts.1c00781 |
|
| [6] |
(a) Zhao, L.; Li, Z.; Chang, L.; Xu, J.; Yao, H.; Wu, X. Org. Lett. 2012, 14, 2066.
doi: 10.1021/ol300584m pmid: 22463710 |
|
(b) Douki, K.; Ono, H.; Taniguchi, T.; Shimokawa, J.; Kitamura, M.; Fukuyama, T. J. Am. Chem. Soc. 2016, 138, 14578.
doi: 10.1021/jacs.6b10237 pmid: 22463710 |
|
|
(c) Li, X.; Zhou, B.; Yang, R.-Z.; Yang, F.-M.; Liang, R.-X.; Liu, R.-R.; Jia, Y.-X. J. Am. Chem. Soc. 2018, 140, 13945.
doi: 10.1021/jacs.8b09186 pmid: 22463710 |
|
|
(d) Yang, P.; You, S.-L. Org. Lett. 2018, 20, 7684.
doi: 10.1021/acs.orglett.8b03425 pmid: 22463710 |
|
|
(e) Liang, R.-X.; Song, L.-J.; Lu, J.-B.; Xu, W.-Y.; Ding, C.; Jia, Y.-X. Angew. Chem., Int. Ed. 2021, 60, 7412.
doi: 10.1002/anie.v60.13 pmid: 22463710 |
|
|
(f) Han, X.-Q.; Wang, L.; Yang, P.; Liu, J.-L.; Xu, W.-Y.; Zheng, C.; Liang, R.-X.; You, S.-L.; Zhang, J.; Jia, Y.-X. ACS Catal. 2022, 12, 665.
pmid: 22463710 |
|
| [7] |
Yang, P.; Xu, R.-Q.; Zheng, C.; You, S.-L. Chin. J. Chem. 2020, 38, 235.
doi: 10.1002/cjoc.v38.3 |
| [8] |
Cho, C. S.; Uemura, S. J. Organomet. Chem. 1994, 465, 85.
doi: 10.1016/0022-328X(94)87040-3 |
| [9] |
Penn, L.; Shpruhman, A.; Gelman, D. J. Org. Chem. 2007, 72, 3875.
doi: 10.1021/jo070170v |
| [10] |
Lee, A.-L. Org. Biomol. Chem. 2016, 14, 5357.
doi: 10.1039/c5ob01984b pmid: 26529247 |
| [11] |
Gao, S.; Yang, C.; Huang, Y.; Zhao, L.; Wu, X.; Yao, H.; Lin, A. Org. Biomol. Chem. 2016, 14, 840.
doi: 10.1039/C5OB01970B |
| [12] |
For recent asymmetric transformations of indole: (a) Gao, H.; Miao, Y.-H.; Sun, W.-N.; Zhao, R.; Xiao, X.; Hua, Y.-Z.; Jia, S.-K.; Wang, M.-C.; Mei, G.-J. Adv. Sci. 2023, 10, 2305101.
doi: 10.1002/advs.v10.35 pmid: 25316161 |
|
(b) Zhang, H.; Shi, F. Chin. J. Org. Chem. 2022, 42, 3351. (in Chinese)
doi: 10.6023/cjoc202203018 pmid: 25316161 |
|
|
(张洪浩, 石枫, 有机化学, 2022, 42, 3351.)
doi: 10.6023/cjoc202203018 pmid: 25316161 |
|
|
(c) Sheng, F.-T.; Yang, S.; Wu, S.-F.; Zhang, Y.-C.; Shi, F. Chin. J. Chem. 2022, 40, 2151.
doi: 10.1002/cjoc.v40.18 pmid: 25316161 |
|
|
(d) Sheng, F.-T.; Wang, J.-Y.; Tan, W.; Zhang, Y.-C.; Shi, F. Org. Chem. Front. 2020, 7, 3967.
doi: 10.1039/D0QO01124J pmid: 25316161 |
|
|
(e) Zhang, Y.-C.; Jiang, F.; Shi, F. Acc. Chem. Res. 2020, 53, 425.
doi: 10.1021/acs.accounts.9b00549 pmid: 25316161 |
|
|
(f) Zheng, C.; You, S.-L. Acc. Chem. Res. 2020, 53, 974.
doi: 10.1021/acs.accounts.0c00074 pmid: 25316161 |
|
|
(g) Chen, J.-B.; Jia, Y.-X. Org. Biomol. Chem. 2017, 15, 3550.
doi: 10.1039/C7OB00413C pmid: 25316161 |
|
|
(h) Dalpozzo, R. Chem. Soc. Rev. 2015, 44, 742.
doi: 10.1039/c4cs00209a pmid: 25316161 |
|
|
(i) Bartoli, G.; Bencivenni, G.; Dalpozzo, R. Chem. Soc. Rev. 2010, 39, 4449.
doi: 10.1039/b923063g pmid: 25316161 |
| [1] | 王孟孟, 张俊, 王慧颖, 马彪, 戴辉雄. 铑催化吲哚C(4)—H选择性活化构建氮杂-螺[4,5]吲哚骨架※[J]. 化学学报, 2022, 80(3): 277-281. |
| [2] | 郑龙, 王丽佳, 唐勇. 吲哚-环丙烷的分子内开环反应※[J]. 化学学报, 2022, 80(3): 255-258. |
| [3] | 占林俊, 胡玮, 王梅, 黄斌, 龙亚秋. 亚胺氯化物介导一锅法合成3-吸电子基团取代吲哚衍生物[J]. 化学学报, 2021, 79(7): 903-907. |
| [4] | 周波, 梁仁校, 曹中艳, 周平海, 贾义霞. 钯催化吡咯环内共轭双键的Heck反应[J]. 化学学报, 2021, 79(2): 176-179. |
| [5] | 张丹琪, 邵英博, 郑汉良, 周碧莹, 薛小松. 双齿氮配体螯合五价碘试剂介导的苯酚氧化去芳构化机理的理论研究[J]. 化学学报, 2021, 79(11): 1394-1400. |
| [6] | 任响, 张小平, 王雨芬, 曹静瑜, 程媛媛, 冯守华, 陈焕文. 倍硫磷的甲基在分子内和分子间迁移的质谱研究[J]. 化学学报, 2019, 77(4): 358-364. |
| [7] | 胡书博, 陈木旺, 翟小勇, 周永贵. 不对称氢化杂环亚胺合成四氢吡咯/吲哚[1,2-a]并吡嗪[J]. 化学学报, 2018, 76(2): 103-106. |
| [8] | 廖富民, 杜溢, 周锋, 周剑. Au(I)/手性双功能叔胺催化实现的一锅法串联成烯/不对称环化反应构建螺环季碳氧化吲哚[J]. 化学学报, 2018, 76(11): 862-868. |
| [9] | 严文广, 王盼, 王丽佳, 孙秀丽, 唐勇. 铜(II)催化的吲哚与四取代D-A环丙烷[3+2]开环/环化反应[J]. 化学学报, 2017, 75(8): 783-787. |
| [10] | 吴文挺, 张立明, 游书力. 金催化去芳构化反应研究进展[J]. 化学学报, 2017, 75(5): 419-438. |
| [11] | 张令, 张沛之, 薛剑飞, 孙网彬, 邹建平. 醋酸锰引发的吲哚膦酰化反应[J]. 化学学报, 2016, 74(10): 811-818. |
| [12] | 尹小平, 徐鹏巍, 董坤, 廖奎, 周锋, 周剑. Ga(OTf)3催化的3-羟基氧化吲哚与TMSN3的取代反应研究[J]. 化学学报, 2015, 73(7): 685-689. |
| [13] | 鲁平, 冯超, 罗德平. Rh/Ag双金属催化的碳氢键氧化Heck反应研究[J]. 化学学报, 2015, 73(12): 1315-1319. |
| [14] | 段德河, 殷勤, 王守国, 顾庆, 游书力. 手性磷酸催化的C(3)-取代吲哚和甲基乙烯基酮不对称串联反应[J]. 化学学报, 2014, 72(9): 1001-1004. |
| [15] | 李浩, 丁昌华, 许斌, 侯雪龙. 钯催化分子间不对称Heck反应的研究进展[J]. 化学学报, 2014, 72(7): 765-770. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||