有机化学 ›› 2021, Vol. 41 ›› Issue (2): 471-489.DOI: 10.6023/cjoc202007043 上一篇 下一篇
综述与进展
收稿日期:2020-07-16
发布日期:2020-09-09
通讯作者:
曾兴平
作者简介:基金资助:
Shurui Zhou1, Kaige Wen1, Xingping Zeng1,*( )
)
Received:2020-07-16
Published:2020-09-09
Contact:
Xingping Zeng
Supported by:文章分享
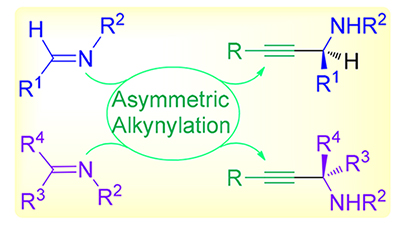
手性炔丙胺是天然产物和药物活性分子不对称全合成中常用的关键中间体, 亚胺及其类似物的不对称炔基化反应可以为该砌块提供高效高对映选择性的合成路径; 此外通过合理的底物和反应设计, 亚胺的不对称炔基化反应还能作为一系列串联反应的起点, 来合成多种结构新颖的含氮杂环化合物. 因此, 亚胺及其类似物的高效高对映选择性炔基化反应得到合成化学家们持续关注. 按照底物类型, 主要分为醛亚胺的不对称炔基化和酮亚胺的不对称炔基化两大部分, 介绍了亚胺及其类似物的不对称炔基化反应在过去十年中的研究进展. 对这些反应的机理、优势与不足之处以及该反应在合成中的应用进行简要讨论, 从而为拓展该反应在合成中的应用提供一些有益参考和借鉴.
周淑蕊, 温凯歌, 曾兴平. 亚胺及其类似物的催化不对称炔基化反应新进展[J]. 有机化学, 2021, 41(2): 471-489.
Shurui Zhou, Kaige Wen, Xingping Zeng. Recent Progress in Catalytic Asymmetric Alkynylation of Imines[J]. Chinese Journal of Organic Chemistry, 2021, 41(2): 471-489.
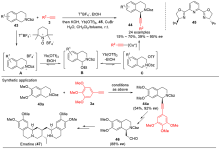
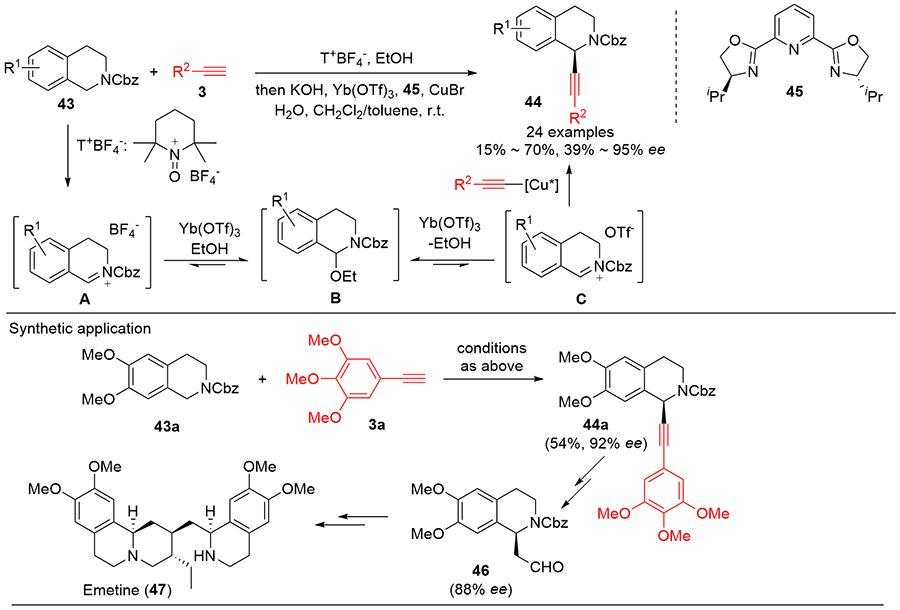
| [1] |
Lauder K.; Toscani A.; Scalacci N.; Castagnolo D. Chem. Rev. 2017, 117, 14091.
doi: 10.1021/acs.chemrev.7b00343 |
| [2] |
(a) Lu G.; Li Y.-M.; Li X.-S.; Chan A. S. C.Coord. Chem. Rev. 2005, 249, 1736.
doi: 10.1016/j.ccr.2004.12.020 pmid: 248DAAE2-925A-4E47-9F71-0E1AF9A421D2 |
|
(b) Blay G.; Monleón A.; Pedro J.R. Curr. Org. Chem. 2009, 13, 1498.
doi: 10.2174/138527209789177734 pmid: 248DAAE2-925A-4E47-9F71-0E1AF9A421D2 |
|
|
(c) Bian Q.; Zhong J.; Hou S.; Wang M. Chin. J. Org. Chem. 2010, 30, 1261. (in Chinese)
doi: 10.1002/cjoc.201200309 pmid: 248DAAE2-925A-4E47-9F71-0E1AF9A421D2 |
|
|
边庆花, 钟江春, 侯士聪, 王敏, 有机化学, 2010, 30, 1261.).
pmid: 248DAAE2-925A-4E47-9F71-0E1AF9A421D2 |
|
|
(d) Cheng M.; Li B.-G.Chin. Synth. Chem. 2012, 20, 1. (in Chinese)
pmid: 248DAAE2-925A-4E47-9F71-0E1AF9A421D2 |
|
|
成明, 李伯刚, 合成化学, 2012, 20, 1.).
pmid: 248DAAE2-925A-4E47-9F71-0E1AF9A421D2 |
|
|
(e) Bisai V.; Singh V.K. Tetrahedron Lett. 2016, 57, 4771.
doi: 10.1016/j.tetlet.2016.09.048 pmid: 248DAAE2-925A-4E47-9F71-0E1AF9A421D2 |
|
| [3] |
Yan W.; Li P.; Feng J.; Wang D.; Zhu S.; Jiang X.; Wang R. Tetrahedron : Asymmetry 2010, 21, 2037.
doi: 10.1016/j.tetasy.2010.07.020 |
| [4] |
Blay G.; Ceballos E.; Monleon A.; Pedro J.R. Tetrahedron 2012, 68, 2128.
doi: 10.1016/j.tet.2012.01.037 |
| [5] |
(a) Liu T.-L.; Zhang H.-X.; Zheng Y.; Yao Q.; Ma J.-A. Chem. Commun. 2012, 48, 12234.
doi: 10.1039/c2cc37290h |
|
(b) Yang Z.-Y.; Liu T.-L.; Zheng Y.; Li S.; Ma J.-A. Eur. J. Org. Chem. 2015, 3905.
|
|
| [6] |
Blay G.; Brines A.; Monlen A.; Pedro J.R. Chem.-Eur. J. 2012, 18, 2440.
doi: 10.1002/chem.201102909 |
| [7] |
Xie Z.; Liu X.; Liu L. Org. Lett. 2016, 18, 2982.
doi: 10.1021/acs.orglett.6b01328 |
| [8] |
Luzung M.R.; Dixon D.D.; Ortiz A.; Guerrero C.A.; Ayers S.; Ho J.; Schmidt M.A.; Strotman N.A.; Eastgate M.D. J. Org. Chem. 2017, 82, 10715.
doi: 10.1021/acs.joc.7b01882 |
| [9] |
(a) Campbell M.J.; Toste F.D. Chem. Sci. 2011, 2, 1369.
pmid: 22712050 |
|
(b) Ranjan A.; Mandal A.; Yerande S.G.; Dethe D.H. Chem. Commun. 2015, 51, 14215.
doi: 10.1039/C5CC05549K pmid: 22712050 |
|
| [10] |
Hashimoto T.; Omote M.; Maruoka K. Angew. Chem., Int. Ed. 2011, 50, 8952.
doi: 10.1002/anie.v50.38 |
| [11] |
Pappoppula M.; Cardoso F. S. P.; Garrett B.O.; Aaron A. Angew. Chem., Int. Ed. 2015, 54, 15202.
doi: 10.1002/anie.201507848 |
| [12] |
Kou X.; Zhao Q.; Guan Z.-H. Org. Chem. Front. 2020, 7, 838.
|
| [13] |
Ren Y.-Y.; Wang Y.-Q.; Liu S. J. Org. Chem. 2014, 79, 11759.
doi: 10.1021/jo5022037 |
| [14] |
Munck L.D.; Monleón A.; Vila C.; Muñoz M.C.; Pedro J.R. Org. Biomol. Chem. 2015, 13, 7393.
doi: 10.1039/C5OB01012H |
| [15] |
Munck L.D.; Monleón A.; Vila C.; Pedro J.R. Adv. Synth. Catal. 2017, 359, 1582.
doi: 10.1002/adsc.v359.9 |
| [16] |
Yu J.; Li Z.; Jia K.; Jiang Z.; Liu M.; Su W. Tetrahedron Lett. 2013, 54, 2006.
doi: 10.1016/j.tetlet.2013.02.007 |
| [17] |
Sun S.; Li C.; Floreancig P.E.; Lou H.; Liu L. Org. Lett. 2015, 17, 1684.
doi: 10.1021/acs.orglett.5b00447 |
| [18] |
Sun S.; Liu L. Synthesis 2016, 48, 2627.
doi: 10.1055/s-0035-1561421 |
| [19] |
Perepichka I.; Kundu S.; Hearne Z.; Li C.-J. Org. Biomol. Chem. 2015, 13, 447.
doi: 10.1039/C4OB02138J |
| [20] |
Huang T.; Liu X.; Lang J.; Xu J.; Lin L.; Feng X. ACS Catal. 2017, 7, 5654.
doi: 10.1021/acscatal.7b01912 |
| [21] |
(a) Wei C.; Li C.-J. J. Am. Chem. Soc. 2002, 124, 5638.
doi: 10.1021/ja026007t |
|
Wei C.; Mague J.T.; Li C.-J. Proc. Natl. Acad. Sci. U.S. A. 2004, 101, 5749.
|
|
|
Selected reviews:.
|
|
|
(c) Peshkov V.A.; Pereshivko O.P.; Van der Eycken, E.V.Chem. Soc. Rev. 2012, 41, 3790.
doi: 10.1039/c2cs15356d |
|
|
(d) Rokade B.V.; Barker J.; Guiry P.J. Chem. Soc. Rev. 2019, 48, 4766.
doi: 10.1039/C9CS00253G |
|
|
(e) Mo J.-N.; Su J.; Zhao J. Molecules 2019, 24, 1216.
doi: 10.3390/molecules24071216 |
|
|
(f) Jesin I.; Nandi G.C. Eur. J. Org. Chem. 2019, 2704.
|
|
| [22] |
Bisai V.; Suneja A.; Singh V.K. Angew. Chem., Int. Ed. 2014, 53, 10737.
doi: 10.1002/anie.201405074 |
| [23] |
Das B.G.; Shah S.; Singh V.K. Org. Lett. 2019, 21, 4981.
doi: 10.1021/acs.orglett.9b01507 |
| [24] |
Dhanasekaran S.; Kannaujiya V.K.; Biswas R.G.; Singh V.K. J. Org. Chem. 2019, 84, 3275.
doi: 10.1021/acs.joc.8b03225 |
| [25] |
Li Z.; Jiang Z.; Su W. Green Chem. 2015, 17, 2330.
doi: 10.1039/C5GC00079C |
| [26] |
Gao X.-T.; Gan C.-C.; Liu S.-Y.; Zhou F.; Wu H.-H.; Zhou J. ACS Catal. 2017, 7, 8588.
doi: 10.1021/acscatal.7b03370 |
| [27] |
(a) Nakamura S.; Hyodo K.; Nakamura Y.; Shibata N.; Toru T. Adv. Synth. Catal. 2008, 350, 1443.
doi: 10.1002/adsc.v350:10 |
|
(b) Liu H.; Du D.-M. Adv. Synth. Catal. 2009, 351, 489.
doi: 10.1002/adsc.v351:4 |
|
| [28] |
Nakamura S.; Ohara M.; Nakamura Y.; Shibata N.; Toru T. Chem.-Eur. J. 2010, 16, 2360.
doi: 10.1002/chem.v16:8 |
| [29] |
Ohara M.; Hara Y.; Ohnuki T.; Nakamura S. Chem.-Eur. J. 2014, 20, 8848.
|
| [30] |
Knöpfel T.E.; Aschwanden P.; Ichikawa T.; Watanabe T.; Carreira E.M. Angew. Chem., Int. Ed. 2004, 43, 5971.
doi: 10.1002/anie.200461286 |
| [31] |
Huang X.; Ma S. Acc. Chem. Res. 2019, 52, 1301.
|
| [32] |
(a) Ye J.; Li S.; Chen B.; Fan W.; Kuang J.; Liu J.; Liu Y.; Miao B.; Wan B.; Wang Y.; Xie X.; Yu Q.; Yuan W.; Ma S. Org. Lett. 2012, 14, 1346.
doi: 10.1021/ol300296k pmid: WOS:000459590400023 |
|
(b) Liu Q.; Cao T.; Han Y.; Jiang X.; Tang Y.; Zhai Y.; Ma S. Synlett 2019, 30, 477.
doi: 10.1055/s-0037-1611641 pmid: WOS:000459590400023 |
|
| [33] |
Fan W.; Ma S. Chem. Commun. 2013, 49, 10175.
doi: 10.1039/c3cc45118f |
| [34] |
Fan W.; Yuan W.; Ma S. Nat. Commun. 2014, 5, 1.
|
| [35] |
(a) Lin W.; Cao T.; Fan W.; Han Y.; Kuang J.; Luo H.; Miao B.; Tang X.; Yu Q.; Yuan W.; Zhang J.; Zhu C.; Ma S. Angew. Chem., Int. Ed. 2014, 53, 277.
|
|
(b) Lin W.; Ma S. Org. Chem. Front. 2014, 1, 338.
doi: 10.1039/c4qo00058g |
|
|
(c) Lin W.; Ma S. Org. Chem. Front. 2017, 4, 958.
doi: 10.1039/C7QO00062F |
|
| [36] |
Zhou S.; Tong R. Org. Lett. 2017, 19, 1594.
doi: 10.1021/acs.orglett.7b00414 |
| [37] |
(a) Cardoso F. S. P.; Abboud K.A.; Aponick A. J. Am. Chem. Soc. 2013, 135, 14548.
doi: 10.1021/ja407689a |
|
(b) Paioti P. H. S.; Abboud K.A.; Aponick A. J. Am. Chem. Soc. 2016, 138, 2150.
doi: 10.1021/jacs.5b13387 |
|
| [38] |
(a) Paioti P. H. S.; Abboud K.A.; Aponick A. ACS Catal. 2017, 7, 2133.
doi: 10.1021/acscatal.7b00133 |
|
(b) Rokade B.V.; Guiry P.J. ACS Catal. 2017, 7, 2334.
doi: 10.1021/acscatal.6b03427 |
|
|
(c) Rokade B.V.; Guiry P.J. J. Org. Chem. 2019, 84, 5763.
doi: 10.1021/acs.joc.9b00728 |
|
| [39] |
(a) Min C.; Mittal N.; Sun D.X.; Seidel D. Angew. Chem., Int. Ed. 2013, 52, 14084.
doi: 10.1002/anie.201308196 |
|
(b) Mittal N.; Sun D.X.; Seidel D. Org. Lett. 2014, 16, 1012.
doi: 10.1021/ol403773a |
|
| [40] |
Zhao C.; Seidel D. J. Am. Chem. Soc. 2015, 137, 4650.
doi: 10.1021/jacs.5b02071 |
| [41] |
Huang G.; Yang J.; Zhang X. Chem. Commun. 2011, 47, 5587.
doi: 10.1039/C1CC10403A |
| [42] |
Huang G.; Yin Z.; Zhang X. Chem.-Eur. J. 2013, 19, 11992.
doi: 10.1002/chem.201301479 |
| [43] |
Morisaki K.; Sawa M.; Nomaguchi J.-Y.; Morimoto H.; Takeuchi Y.; Mashima K.; Ohshima T. Chem.-Eur. J. 2013, 19, 8417.
doi: 10.1002/chem.v19.26 |
| [44] |
Morisaki K.; Sawa M.; Yonesaki R.; Morimoto H.; Mashima K.; Ohshima T. J. Am. Chem. Soc. 2016, 138, 6194.
doi: 10.1021/jacs.6b01590 |
| [45] |
Yin L.; Otsuka Y.; Takada H.; Mouri S.; Yazaki R.; Kumagai N.; Shibasaki M. Org. Lett. 2013, 698.
|
| [46] |
Takada H.; Kumagai N.; Shibasaki M. Org. Lett. 2015, 17, 4762.
doi: 10.1021/acs.orglett.5b02300 |
| [47] |
Chen Q.; Xie L.; Li Z.; Tang Y.; Zhao P.; Lin L.; Feng X.; Liu X. Chem. Commun. 2018, 54, 678.
doi: 10.1039/C7CC08920A |
| [48] |
Dasgupta S.; Liu J.; Shoffler C.A.; Yap G. P. A.; Watson M.P. Org. Lett. 2016, 18, 6006.
doi: 10.1021/acs.orglett.6b02787 |
| [49] |
Zhang F.-G.; Ma H.; Nie J.; Zheng Y.; Gao Q.; Ma J.-A. Adv. Synth. Catal. 2012, 354, 1422.
doi: 10.1002/adsc.201100926 |
| [50] |
Zhang Y.; Nie J.; Zhang F.-G.; Ma J.-A. J. Fluorine Chem. 2018, 208, 1.
doi: 10.1016/j.jfluchem.2018.01.008 |
| [51] |
Ling Z.; Singh S.; Xie F.; Wu L.; Zhang W. Chem. Commun. 2017, 53, 5364.
doi: 10.1039/C7CC02159C |
| [52] |
Liu R.-R.; Zhu L.; Hu J.-P.; Lu C.-J.; Gao J.-R.; Lan Y.; Jia Y.-X. Chem. Commun. 2017, 53, 5890.
doi: 10.1039/C7CC01015J |
| [1] | 洪科苗, 黄晶晶, 姚铭瀚, 徐新芳. 氮宾/炔烃复分解串联反应研究进展[J]. 有机化学, 2022, 42(2): 344-352. |
| [2] | 邵子宴, 周庆丽, 王建成, 汤芮, 沈悦海. 碘化钠-三苯基膦介导的光氧化还原醛亚胺烷基化[J]. 有机化学, 2021, 41(7): 2676-2683. |
| [3] | 孙忠文, 张聪聪, 陈丽君, 谢惠定, 柳波, 刘丹丹. 三氟乙基酮亚胺参与的催化不对称反应研究进展[J]. 有机化学, 2021, 41(5): 1789-1803. |
| [4] | 王子超, 许佑君, 施世良. 碱促进醛亚胺的快速氢硅化反应[J]. 有机化学, 2020, 40(10): 3463-3466. |
| [5] | 张金, 刘佳, 马养民, 程佩. 纳米金属氧化物催化含氮杂环类化合物的合成研究进展[J]. 有机化学, 2017, 37(3): 555-565. |
| [6] | 扈晓艳, 胡方芝, 张敏敏, 廖益均, 徐小英, 袁伟成, 张晓梅. 二芳基甲酮亚胺的不对称催化氢化硅烷化反应研究[J]. 有机化学, 2016, 36(8): 1895-1906. |
| [7] | 李晓锦, 孙艳, 张磊, 彭勃. 烯酮亚胺盐化学的研究进展[J]. 有机化学, 2016, 36(11): 2530-2544. |
| [8] | 张文生, 许文静, 匡春香. 磺酰叠氮和炔参与的多组分反应研究进展[J]. 有机化学, 2015, 35(10): 2059-2066. |
| [9] | 林敬, 程宇, 康泰然, 何龙, 刘全忠. 不饱和酮亚胺叶立德的分子内共轭加成[J]. 有机化学, 2014, 34(4): 735-740. |
| [10] | 陈金全, 康泰然, 刘敬林, 何龙, 刘全忠. 高选择性相转移催化原位产生不饱和亚胺参与的不对称Michael反应[J]. 有机化学, 2013, 33(07): 1483-1489. |
| [11] | 罗培松, 汤日元, 钟平, 李金恒. 炔烃分子内环化反应合成含氮杂环化合物研究进展[J]. 有机化学, 2009, 29(12): 1924-1937. |
| [12] | 杨益琴; 李艳苹; 王石发*; 谷 文. 新型手性N-烷基-3-蒎胺类化合物的合成及其抑菌活性的研究[J]. 有机化学, 2009, 29(07): 1092-1095. |
| [13] | 王进军,谢磊,康明芹,张敏,李付国,崔丙存. 氢化喹啉及其芳(杂)环稠合衍生物的合成[J]. 有机化学, 2005, 25(07): 830-834. |
| [14] | 密爱巧,陈元伟,肖勋,蒋耀忠. 手性蒎烯酮亚胺用于立体选择性合成[J]. 有机化学, 1993, 13(2): 199-201. |
| [15] | 刘小兰,陈红丽,缪方明. 双-[N(4-取代苯基)-水杨醛亚胺]合锌(Ⅱ)的晶体结构[J]. 有机化学, 1992, 12(5): 522-526. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||