有机化学 ›› 2021, Vol. 41 ›› Issue (4): 1646-1657.DOI: 10.6023/cjoc202010011 上一篇 下一篇
研究论文
董宏波1, 王卫伟1, 赵宇1, 刘鑫磊1, 王明安1,*( )
)
收稿日期:2020-10-09
修回日期:2020-11-20
发布日期:2020-12-19
通讯作者:
王明安
基金资助:
Hongbo Dong1, Weiwei Wang1, Yu Zhao1, Xinlei Liu1, Ming'an Wang1,*( )
)
Received:2020-10-09
Revised:2020-11-20
Published:2020-12-19
Contact:
Ming'an Wang
About author:Supported by:文章分享
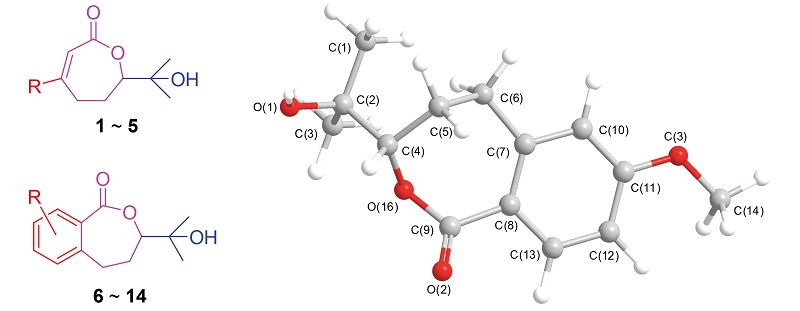
以环氧化-内酯化和Sharpless不对称双羟基化反应作为关键步骤, 以55%~90%的总收率实现了消旋及光活性3,7-二甲基-7-羟基-2-辛烯-6-内酯类似物的合成. 它们的结构经过1H NMR, 13C NMR, HR-ESI-MS和X射线衍射的表征. 对它们的杀菌活性进行了评价, 结果表明活性最好的化合物3-苯基-7-甲基-7-羟基-2-辛烯-6-内酯(4)和3-(呋喃-2-基)-7-甲基-7-羟基-2-辛烯-6-内酯(5)对6种植物病原菌的EC50值为0.5~20.0 μg/mL, 可以作为先导结构进行进一步结构优化.
董宏波, 王卫伟, 赵宇, 刘鑫磊, 王明安. 3,7-二甲基-7-羟基-2-辛烯-6-内酯类似物的合成及杀菌活性[J]. 有机化学, 2021, 41(4): 1646-1657.
Hongbo Dong, Weiwei Wang, Yu Zhao, Xinlei Liu, Ming'an Wang. Synthesis and Antifungal Activity of 3,7-Dimethyl-7-hydroxy-2-octen-6-olide Analogues[J]. Chinese Journal of Organic Chemistry, 2021, 41(4): 1646-1657.
| Entry | R | Olefin acid | Lactone | Yielda/% | Entry | R | Olefin acid | Lactone | Yielda/% |
|---|---|---|---|---|---|---|---|---|---|
| 1 | CH3 | 1b | 1 | 65 | 9 | 8-Cl | 9a | 9 | 70 |
| 2 | CF3 | 2b | 2 | 90 | 10 | 7-OCH3 | 10a | 10 | 74 |
| 3 | OCH3 | 3b | 3 | 77 | 11 | 6-OCH3 | 11a | 11 | 80 |
| 4 | C6H5 | 4b | 4 | 62 | 12 | 6-Cl | 12a | 12 | 78 |
| 5 | 2-C4H3O | 5b | 5 | 60 | 13 | 7,9-(OCH3)2 | 13a | 13 | 85 |
| 6 | H | 6a | 6 | 86 | 14 | | | 72 | |
| 7 | 8-CH3 | 7a | 7 | 76 | 15 | | | 80 | |
| 8 | 8-F | 8a | 8 | 75 | 16 | | | 73 |
| Entry | R | Olefin acid | Lactone | Yielda/% | Entry | R | Olefin acid | Lactone | Yielda/% |
|---|---|---|---|---|---|---|---|---|---|
| 1 | CH3 | 1b | 1 | 65 | 9 | 8-Cl | 9a | 9 | 70 |
| 2 | CF3 | 2b | 2 | 90 | 10 | 7-OCH3 | 10a | 10 | 74 |
| 3 | OCH3 | 3b | 3 | 77 | 11 | 6-OCH3 | 11a | 11 | 80 |
| 4 | C6H5 | 4b | 4 | 62 | 12 | 6-Cl | 12a | 12 | 78 |
| 5 | 2-C4H3O | 5b | 5 | 60 | 13 | 7,9-(OCH3)2 | 13a | 13 | 85 |
| 6 | H | 6a | 6 | 86 | 14 | | | 72 | |
| 7 | 8-CH3 | 7a | 7 | 76 | 15 | | | 80 | |
| 8 | 8-F | 8a | 8 | 75 | 16 | | | 73 |
| Compd. | R. solani | A. solani | S. sclerotiorum | B. cinerea | F. graminearum | P. capsici |
|---|---|---|---|---|---|---|
| 1 | 65.7 | 42.2 | —a | — | — | — |
| R-1 | 56.5 | 44.9 | — | — | — | — |
| S-1 | 231.6 | 52.0 | — | — | — | — |
| 2 | — | — | — | — | — | — |
| 3 | 75.6 | 23.5 | — | — | — | — |
| R-3 | 87.1 | 32.3 | — | — | — | — |
| S-3 | 73.0 | 40.5 | — | — | — | — |
| 4 | 10.7 | 3.7 | 5.1 | 0.5 | 19.4 | 18.6 |
| 5 | 2.8 | 4.6 | 9.8 | - | 10.7 | 5.1 |
| 6 | — | 115.1 | — | — | — | — |
| R-6 | — | 27.4 | — | — | — | — |
| S-6 | — | 18.4 | — | — | — | — |
| 7 | 48.9 | — | — | — | 323.7 | — |
| 8 | 134.2 | 8.1 | 186.8 | — | 132.9 | — |
| 9 | — | — | — | — | — | — |
| 10 | — | — | — | — | — | — |
| 11 | — | — | — | — | — | — |
| 12 | — | — | — | — | — | — |
| 13 | 41.4 | 6.6 | — | — | — | — |
| 14 | — | — | — | — | — | — |
| Carbendazim | 0.05 | 0.05 | 7.9 | 528.2 | 0.07 | 77.8 |
| Compd. | R. solani | A. solani | S. sclerotiorum | B. cinerea | F. graminearum | P. capsici |
|---|---|---|---|---|---|---|
| 1 | 65.7 | 42.2 | —a | — | — | — |
| R-1 | 56.5 | 44.9 | — | — | — | — |
| S-1 | 231.6 | 52.0 | — | — | — | — |
| 2 | — | — | — | — | — | — |
| 3 | 75.6 | 23.5 | — | — | — | — |
| R-3 | 87.1 | 32.3 | — | — | — | — |
| S-3 | 73.0 | 40.5 | — | — | — | — |
| 4 | 10.7 | 3.7 | 5.1 | 0.5 | 19.4 | 18.6 |
| 5 | 2.8 | 4.6 | 9.8 | - | 10.7 | 5.1 |
| 6 | — | 115.1 | — | — | — | — |
| R-6 | — | 27.4 | — | — | — | — |
| S-6 | — | 18.4 | — | — | — | — |
| 7 | 48.9 | — | — | — | 323.7 | — |
| 8 | 134.2 | 8.1 | 186.8 | — | 132.9 | — |
| 9 | — | — | — | — | — | — |
| 10 | — | — | — | — | — | — |
| 11 | — | — | — | — | — | — |
| 12 | — | — | — | — | — | — |
| 13 | 41.4 | 6.6 | — | — | — | — |
| 14 | — | — | — | — | — | — |
| Carbendazim | 0.05 | 0.05 | 7.9 | 528.2 | 0.07 | 77.8 |
| [1] |
Schulz, S.; Hotling, S. Nat. Prod. Rep. 2015, 32,1042.
|
| [2] |
Gabriela, L.; Gallardo, N.I. P.; Cabrera, G.M. Phytochem. Lett. 2008, 1,155.
|
| [3] |
Yang, Y.; Jiang, J.Z.; Qimei, L.B.; Yan, X.J.; Zhao, J.X.; Yuan, H.Z.; Qin, Z.H.; Wang, M.A. Molecules 2010, 15,7075.
|
| [4] |
Davies-Coleman, M.T.; Rivett, D.E. A. Prog. Chem. Org. Nat. Prod. 1989, 55,1.
|
| [5] |
Collett, L.A.; Davies-Coleman, M.T.; Rivett, D.E. A. Prog. Chem. Org. Nat. Prod. 1998, 75,182.
|
| [6] |
Pereda-Miranda, R.; Fragoso-Serrano, M.; Cerda-Garcia-Rojas, C.M. Tetrahedron 2001, 57,47.
|
| [7] |
Hoffmann, H.M. R.; Rabe, J. Angew. Chem. Int. Ed. 1985, 24,94.
|
| [8] |
Marco, J.A.; Carda, M.; Murga, J.; Falomir, E. Tetrahedron 2007, 63,2929.
|
| [9] |
Boucard, V.; Broustal, G.; Campagne, J.M. Eur. J. Org. Chem. 2007,225.
|
| [10] |
Gerard, R. Tetrahedron 1995, 51,2777.
|
| [11] |
Helena, M.C.; Fernanda, I.B.; Myrian, K.S.; Luiz, S.L. J. Quim. Nova 2008, 31,885.
|
| [12] |
Helena, M.C.; Fernanda, I.B.; Luiz, S.L. J. Synthesis 2007,3261.
|
| [13] |
Shiina, I. Chem. Rev. 2007, 107,239.
|
| [14] |
Chang, H.-T.; Jayanth, T.T.; Wang, C.-C.; Cheng, C.-H. J. Am. Chem. Soc. 2007, 129,12032.
|
| [15] |
Ebine, M.; Suga, Y.; Fuwa, H.; Sasaki, M. Org. Biomol. Chem. 2010, 8,39.
|
| [16] |
Emily, B.P.; Tendai, G.; Sonbinh, T.N. Org. Lett. 2008, 10,5613.
|
| [17] |
van, As, B.A. C.; Chan, D.; Kivit, P.J. J.; Palmans, A.R. A.; Meijer, E.W. Tetrahedron: Asymmetry 2007, 18,787.
|
| [18] |
Maxime, A.S.; Huub, K.; Anthony, L.S. Acta Crystallogr. 2008, E64,o607.
|
| [19] |
Fukuzawa, A.; Masamune, T. Tetrahedron Lett. 1981, 22,4081.
|
| [20] |
Cremer, D.J.; Pople, A. J. Am. Chem. Soc. 1975, 97,1354.
|
| [21] |
Wandjia, J.; Wansi, J.D.; Fuendjiep, V.; Dagne, E.; Mulholland, D.A.; Tillequin, F.; Fomum, Z.T.; Sondengam, B.L.; Nkeh, B.C.; Njamen, D. Phytochemistry 2000, 54,811.
|
| [22] |
Nkeh, B.C.; Njamen, D.; Wandjia, J.; Fomum, Z.T.; Dongmo, A.; Nguelefack, T.B.; Wansi, J.D.; Kamanyi, A. Pharm. Biol. 2003, 41,26.
|
| [23] |
Jhulki, S.; Seth, S.; Mondal, M.; Moorthy, J.N. Tetrahedron 2014, 70,2286.
|
| [24] |
Kadnikov, D.V.; Larock, R.C. Mendeleev Commun. 2007, 17,74.
|
| [25] |
Cheng, Y.A.; Chen, T.; Tan, C.K.; Heng, J.J.; Yeung, Y.Y. J. Am. Chem. Soc. 2012, 134,16492.
|
| [26] |
Wang, L.; Ren, Z.-L.; Ding, M.-W. J. Org. Chem. 2015, 80,641.
|
| [27] |
Arcadi, A.; Fabrizi, G.; Goggiamani, A.; Marinelli, F. J. Org. Chem. 2015, 80,6986.
|
| [28] |
Matsuda, T.; Shigeno, M.; Murakami, M. Org. Lett. 2008, 10,5219.
pmid: 18954068 |
| [29] |
Zarrabi, S.; Mahmoodi, N.O.; Tabatabaeian, K.; Zanjanchi, M.A. Chin. Chem. Lett. 2009, 20,1400.
|
| [30] |
Dong, H. B.; Yang, M. Y.; Jiang, J. Z.; Wang, M. A. J. Asian Nat. Prod. Res. 2013, 15,880.
|
| [31] |
Dong, H. B.; Yang, M. Y.; Tang, B.; Wang, M. A. Chin. J. Org. Chem. 2014, 34,2350. (in Chinese)
|
|
( 董宏波, 杨明艳, 汤博, 王明安, 有机化学, 2014, 34,2350.)
|
|
| [32] |
Zhao, J.; Dong, H. B.; Yang, M. Y.; Du, J.; Jiang, J. Z.; Wang, M. A. J. Asian Nat. Prod. Res. 2014, 16,312.
|
| [33] |
Wang, W.W.; Zhao, Y.; Liu, X.L.; Geng, R.; Wang, M.A. Chin. J. Org. Chem., 2019, 39,1129. (in Chinese)
|
|
( 王卫伟, 赵宇, 刘鑫磊, 耿瑞, 王明安, 有机化学, 2019, 39,1129.)
|
|
| [34] |
Srivastava, A.K.; Song, H.; Park, S.B. Synthesis 2011,1708.
|
| [35] |
Gesinski, M.R.; Tadpetch, K.; Rychnovsky, S.D. Org. Lett. 2009, 11,5342.
|
| [36] |
Matsuda, T.; Shigeno, M.; Murakami, M. Org. Lett. 2008, 10,5219.
|
| [37] |
Chang, H.T.; Jeganmohan, M.; Cheng, C.H. Chem. Commun. 2005,4955.
|
| [38] |
Roux, M.C.; Paugam, R.; Rousseau, G. J. Org. Chem. 2001, 66,4304.
|
| [39] |
Wong, O.A.; Shi, Y. Chem. Rev. 2008, 108,3958.
|
| [40] |
Dong, H.B.; Yang, M.Y.; Liu, B.; Wang, M.A. J. Asian Nat. Prod. Res. 2014, 16,847.
|
| [41] |
Kolb, H.C.; Van Nieuwenhze, M.S.; Sharpless, K.B. Chem. Rev. 1994, 94,2483.
|
| [42] |
Dong, H.B.; Yang, M.Y.; Zhang, X.T.; Wang, M.A. Tetrahedron: Asymmetry 2014, 25,610.
|
| [43] |
Jorge, G.-F.; Juan, M.; Miguel, C.; Alberto, M.J. Org. Lett. 2006, 8,2695.
|
| [44] |
Narender, T.; Sarkar, S.; Rajendar, K.; Tiwari, S. Org. Lett. 2011, 13,6140.
|
| [45] |
Inanaga, J.; Hirata, K.; Saeki, H.; Katsuki, T.; Yamaguchi, M. Bull. Chem. Soc. Jpn. 1979, 52,1989.
|
| [46] |
Yadav, J.S.; Rajendar, G.; Rao, R.S.; Pabbaraja, S. J. Org. Chem. 2013, 78,8524.
|
| [47] |
Ikuko, O.; Takenori, K.; Yoel, K.; Hiroshi, K. J. Am. Chem. Soc. 1991, 113,4092.
|
| [48] |
Tang, B.; Guan, A.Y.; Zhao, Y.; Jiang, J.Z.; Wang, M.A.; Zhou, L.G. Chin. J. Chem. 2017, 35,1133.
|
| [49] |
Zhao, Y.; Tang, B.; Guan, A.Y.; Wang, W.W.; Zhang, Z.H.; Wang, M.A. Synthesis 2017, 49,4663.
|
| [50] |
Geng, R.; Zhao, Y.; Li, Y.H.; Liu, X.L.; Wang, M.A. Chin. J. Org. Chem. 2019, 39,3574. (in Chinese)
|
|
( 耿瑞, 赵宇, 李益豪, 刘鑫磊, 王明安, 有机化学, 2019, 39,3574.)
|
| [1] | 李鹏辉, 谢青洋, 万福贤, 张元红, 姜林. 含环丙基的新型取代嘧啶-5-甲酰胺的合成及杀菌活性研究[J]. 有机化学, 2024, 44(2): 650-656. |
| [2] | 孙昌兴, 张福豪, 张欢, 李鹏辉, 姜林. 新型2-(1-甲基-1H-吡唑-4-基)嘧啶-4-甲酰胺的设计、合成、杀菌活性及分子对接研究[J]. 有机化学, 2023, 43(1): 229-235. |
| [3] | 张倩, 李益豪, 许磊川, 马好运, 李向东, 王明安. 新型含肟醚结构丁烯内酯类化合物的合成及杀菌活性[J]. 有机化学, 2022, 42(8): 2438-2448. |
| [4] | 石发胜, 王圣文, 徐欢, 路星星, 杨新玲, 孙腾达, 王长凯, 张晓鸣, 杨青, 凌云. 新型缩氨基硫脲类化合物的设计、合成及杀菌活性研究[J]. 有机化学, 2022, 42(7): 2106-2116. |
| [5] | 王卫伟, 李益豪, 刘鑫磊, 赵宇, 王明安. 3,7-二甲基辛-2,6-二烯酰胺和3,7-二甲基-6,7-二羟基辛-2-烯酰胺的合成及杀菌活性[J]. 有机化学, 2021, 41(9): 3717-3725. |
| [6] | 代阿丽, 张仁凤, 李传会, 余利娇, 王娅, 吴剑. 含三氟甲基吡啶酰胺结构的N-氰基磺酰亚胺衍生物的合成及生物活性[J]. 有机化学, 2021, 41(9): 3633-3642. |
| [7] | 王卫伟, 赵宇, 刘鑫磊, 蒋家珍, 王明安. 3-芳基-7-甲基-7-羟基-2-辛烯-6-内酯类化合物的合成及杀菌活性[J]. 有机化学, 2021, 41(6): 2343-2353. |
| [8] | 金灿, 邓希乐, 周勇, 周小毛. 含肟酯基L-香芹酮衍生物的设计、合成、晶体结构及杀菌活性[J]. 有机化学, 2021, 41(5): 2008-2018. |
| [9] | 漆亚云, 刘佳敏, 李成朋, 胡伟男, 唐思雨, 邵利辉, 王贞超, 欧阳贵平. 新型含吡啶基3-硫醚-4-吲哚亚氨基-4H-1,2,4-三唑衍生物的设计、合成及体外生物活性评价[J]. 有机化学, 2021, 41(4): 1670-1682. |
| [10] | 余玮, 王翰, 闵莉静, 华学文, 刘幸海. 新型含三唑的烯丙基苯甲酸酯类化合物的合成及杀菌活性研究[J]. 有机化学, 2021, 41(2): 826-832. |
| [11] | 陈澍, 任朝丽, 田晓雨, 张冬林, 杨森, 袁绍顷, 杜晓华, 谭成侠. 吡啶联噁唑酰胺类化合物的设计、合成及杀菌活性[J]. 有机化学, 2021, 41(2): 842-848. |
| [12] | 李安邦, 李中珊, 赵洋, 姚停停, 程敬丽, 赵金浩. 新型吡唑联噻吩甲酰胺类衍生物的设计、合成及其抑菌活性研究[J]. 有机化学, 2020, 40(9): 2836-2844. |
| [13] | 汤显军, 鲁星亮, 杨丹, 张敏, 熊永通, 吴清来, 李俊凯. 基于吩嗪-1-羧酸的新型麦角甾醇生物合成抑制剂叔醇类衍生物的合成及杀菌活性研究[J]. 有机化学, 2020, 40(8): 2491-2501. |
| [14] | 时艳华, 张帅, 万福贤, 孙昌兴, 姜林. 新型N-[2-((取代苯基)氨基)吡啶-3-基]嘧啶甲酰胺的合成、杀菌活性及分子对接[J]. 有机化学, 2020, 40(7): 1948-1954. |
| [15] | 魏凯伦, 石瑞静, 姜林, 苗成霞, 李映. N-取代苯甲酰基-N'-4,7-二甲氧基-[1,2,4]三唑并[1,5-c]嘧啶(硫)脲的设计、合成及生物活性研究[J]. 有机化学, 2020, 40(7): 2127-2134. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||