有机化学 ›› 2022, Vol. 42 ›› Issue (11): 3506-3529.DOI: 10.6023/cjoc202204050 上一篇 下一篇
综述与进展
孙阳星a, 李彦芝a, 曹燕来b( ), 王能中a, 向少华c,*(
), 王能中a, 向少华c,*( ), 刘明国a,*, 姚辉a
), 刘明国a,*, 姚辉a
收稿日期:2022-04-19
修回日期:2022-07-06
发布日期:2022-08-17
通讯作者:
向少华, 刘明国
基金资助:
Yangxing Suna, Yanzhi Lia, Yanlai Caob( ), Nengzhong Wanga, Shaohua Xiangc(
), Nengzhong Wanga, Shaohua Xiangc( ), Mingguo Liua, Hui Yaoa
), Mingguo Liua, Hui Yaoa
Received:2022-04-19
Revised:2022-07-06
Published:2022-08-17
Contact:
Shaohua Xiang, Mingguo Liu
Supported by:文章分享

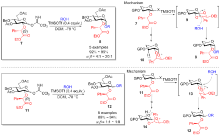
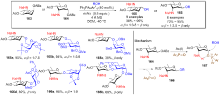
糖类化合物不仅是生命活动的能量来源, 还在许多细胞信号传导和药物研发中发挥着至关重要的作用. 糖化学的核心是糖苷化反应, 而开发一种通用、高效的立体选择性糖苷化方法仍是一大挑战. 目前主要从糖供体、催化条件以及糖受体三个方面进行立体选择性糖苷化反应研究, 其中研究最多的是糖供体的开发. 主要综述了近十年来糖供体的官能团对糖苷化立体选择性调控的发展, 根据官能团参与糖苷化反应的方式可将其分为五大类: 邻基参与型官能团、远程参与型官能团、分子内苷元传递型官能团、与催化剂配位型官能团及氢键作用型官能团.
孙阳星, 李彦芝, 曹燕来, 王能中, 向少华, 刘明国, 姚辉. 官能团导向立体选择性的糖苷化反应研究进展[J]. 有机化学, 2022, 42(11): 3506-3529.
Yangxing Sun, Yanzhi Li, Yanlai Cao, Nengzhong Wang, Shaohua Xiang, Mingguo Liu, Hui Yao. Research Advances in Functional Group-Directed Stereoselective Glycosylation[J]. Chinese Journal of Organic Chemistry, 2022, 42(11): 3506-3529.
| Entry | Modification | α∶β |
|---|---|---|
| 1 | Heat at 50 ℃ | 1∶7.1 |
| 2 | Added DMSO (1 equiv.) | 1∶4.9 |
| 3 | Excess DMTST (6 equiv.) | 1∶9.8 |
| 4 | Added tfoh (1 equiv.) | 1∶8.1 |
| 5 | Replace H with TMS | 1∶2.0 |
| 6 | 4,6-O-benzylidene | 1∶2.1 |
| Entry | Modification | α∶β |
|---|---|---|
| 1 | Heat at 50 ℃ | 1∶7.1 |
| 2 | Added DMSO (1 equiv.) | 1∶4.9 |
| 3 | Excess DMTST (6 equiv.) | 1∶9.8 |
| 4 | Added tfoh (1 equiv.) | 1∶8.1 |
| 5 | Replace H with TMS | 1∶2.0 |
| 6 | 4,6-O-benzylidene | 1∶2.1 |

| [1] |
Zhang, B.; Zhu, X.-M.; Hu, J.-N.; Ye, H.; Luo, T.; Liu, X.-R.; Li, H.-Y.; Li, W.; Zheng, Y.-N.; Deng, Z.-Y. J. Agric. Food. Chem. 2012, 60, 10278.
doi: 10.1021/jf303160y |
| [2] |
Qian, E.-W.; Ge, D.-T.; Kong, S.-K. J. Nat. Prod. 2012, 75, 531.
doi: 10.1021/np200555s |
| [3] |
Li, Y.; Shi, Z.; Chen, L.; Zheng, S.; Li, S.; Xu, B.; Liu, Z.; Liu, J.; Deng, C.-Y.; Ye, F. J. Med. Chem. 2017, 60, 4173.
doi: 10.1021/acs.jmedchem.6b01818 |
| [4] |
Hu, F.-L.; Liu, I.-M.; Kuo, D.-H.; Chen, W.-C.; Su, H.-C.; Cheng, J.-T. J. Nat. Prod. 2003, 66, 788.
doi: 10.1021/np0203887 |
| [5] |
Li, P.-Y.; Zhang, J.-R.; Guo, S.-H.; Zhang, X.-Y.; Fan, X.-S. Chin. J. Org. Chem. 2015, 35, 910. (in Chinese)
doi: 10.6023/cjoc201410034 |
|
( 李培源, 张建瑞, 郭胜海, 张新迎, 范学森, 有机化学 2015, 35, 910.)
doi: 10.6023/cjoc201410034 |
|
| [6] |
Ardestani, N. S.; Majd, N. Y.; Amani, M. J. Chem. Eng. Data 2020, 65, 4762.
doi: 10.1021/acs.jced.0c00183 |
| [7] |
Bello, A. M. B.; Poduch, E.; Liu, Y.; Wei, L.-H.; Crandall, I.; Wang, X.-Y.; Dyanand, C.; Kain, K. C.; Kotra, L. P. J. Med. Chem. 2008, 51, 439.
doi: 10.1021/jm7010673 |
| [8] |
Steiningerova, L.; Kamenik, Z.; Gazak, R.; Kadlcik, S.; Bashiri, G.; Man, P.; Kuzma, M.; Pavlikova, M.; Janata, J. J. Am. Chem. Soc. 2020, 142, 3440.
doi: 10.1021/jacs.9b11234 pmid: 31944685 |
| [9] |
Li, Z.-X.; Zhang, Y.-F.; Lin, M.-M.; Ouyang, P.-K.; Ge, J.; Liu, Z. Org. Process Res. Dev. 2013, 17, 1179.
doi: 10.1021/op400135y |
| [10] |
Leng, W.-L.; Yao, H.; He, J.-X.; Liu, X.-W. Acc. Chem. Res. 2018, 51, 628.
doi: 10.1021/acs.accounts.7b00449 |
| [11] |
(a) McKay, M. J.; Nguyen, H. M. ACS Catal. 2012, 2, 156.
|
|
(b) Li, X.; Zhu, J. Eur. J. Org. Chem. 2016, 2016, 4724.
doi: 10.1002/ejoc.201600484 |
|
|
(c) Peng, P.; Schmidt, R. R. Acc. Chem. Res. 2017, 50, 1171.
doi: 10.1021/acs.accounts.6b00518 |
|
|
(d) Nielsen, M. M.; Pedersen, C. M. Chem. Rev. 2018, 118, 8285.
doi: 10.1021/acs.chemrev.8b00144 |
|
|
(e) Wan, H.; Wu, P.-R.; Zhao, X.; Zeng, J.; Wan, Q. Acta. Chim. Sinica 2019, 77, 231. (in Chinese)
doi: 10.6023/A18100429 |
|
|
( 王浩, 吴品儒, 赵祥, 曾静, 万谦, 化学学报 2019, 77, 231.)
doi: 10.6023/A18100429 |
|
| [12] |
(a) Schumann, B.; Parameswarappa, S. G.; Lisboa, M. P.; Kottari, N.; Guidetti, F.; Pereira, C. L.; Seeberger, P. H. Angew. Chem., Int. Ed. 2016, 55, 14431.
doi: 10.1002/anie.201606774 |
|
(b) van der Vorm, S.; Hansen, T.; van Hengst, J. M. A.; Overkleeft, H. S.; van der Marel, G. A.; Codee, J. D. C. Chem. Soc. Rev. 2019, 48, 4688.
doi: 10.1039/C8CS00369F |
|
| [13] |
(a) Zeng, J.; Ma, J.-M.; Xiang, S.-H.; Cai, S.-T.; Liu, X.-W. Angew. Chem., Int. Ed. 2013, 52, 5134.
doi: 10.1002/anie.201210266 |
|
(b) Gao, P.-C.; Zhu, S.-Y.; Cao, H.; Yang, J.-S. J. Am. Chem. Soc. 2016, 138, 1684.
doi: 10.1021/jacs.5b12589 |
|
|
(c) Zhu, D.-P.; Geng, M.-Y.; Yu, B. Angew. Chem., Int. Ed. 2022, 61, e202203239.
|
|
| [14] |
Ghouilem, J.; de Robichon, M.; Le Bideau, F.; Ferry, A.; Messaoudi, S. Chem.-Eur. J. 2021, 27, 491.
doi: 10.1002/chem.202003267 |
| [15] |
Fischer, E. Ber. Dtsch. Chem. Ges. 1893, 26, 2400.
doi: 10.1002/cber.18930260327 |
| [16] |
Koenigs, W.; Knorr, E. Ber. Dtsch. Chem. Ges. 1901, 34, 957.
doi: 10.1002/cber.190103401162 |
| [17] |
(a) Mensink, R. A.; Boltje, T. J. Chem.-Eur. J. 2017, 23, 17637.
doi: 10.1002/chem.201700908 pmid: 28741787 |
|
(b) Chen, L.-Q.; Lai, D.; Song, Z.-W.; Zhao, X.-E.; Kong, F.-Z. Chin. J. Org. Chem. 2006, 26, 627. (in Chinese)
doi: 10.1002/cjoc.200890118 pmid: 28741787 |
|
|
( 陈朗秋, 赖端, 宋志伟, 赵兴俄, 孔繁祚, 有机化学 2006, 26, 627.)
pmid: 28741787 |
|
| [18] |
Williams, R. J.; McGill, N. W.; White, J. M.; Williams, S. J. J. Carbohydr. Chem. 2010, 29, 236.
doi: 10.1080/07328303.2010.508141 |
| [19] |
(a) Huang, X.-F.; Huang, L.-J.; Wang, H.-S.; Ye, X.-S. Angew. Chem., Int. Ed. 2004, 43, 5221.
doi: 10.1002/anie.200460176 pmid: 26878147 |
|
(b) Zhu, X.-J.; Schmidt, R. R. Angew. Chem., Int. Ed. 2009, 48, 1900.
doi: 10.1002/anie.200802036 pmid: 26878147 |
|
|
(c) Fang, T.; Gu, Y.; Huang, W.; Boons, G. J. J. Am. Chem. Soc. 2016, 138, 3002.
doi: 10.1021/jacs.5b08436 pmid: 26878147 |
|
|
(d) Nielsen, M. M.; Pedersen, C. M. Chem. Rev. 2018, 118, 8285.
doi: 10.1021/acs.chemrev.8b00144 pmid: 26878147 |
|
| [20] |
Li, Y.; Yang, Y.; Yu, B. Tetrahedron. Lett. 2008, 49, 3604.
doi: 10.1016/j.tetlet.2008.04.017 |
| [21] |
(a) Yang, F.; Wang, Q.; Yu, B. Tetrahedron. Lett. 2012, 53, 5231.
doi: 10.1016/j.tetlet.2012.07.059 |
|
(b) Chen, X.; Shen, D.; Wang, Q.; Yang, Y.; Yu, B. Chem. Commun. 2015, 51, 13957.
doi: 10.1039/C5CC05651A |
|
|
(c) Mishra, B.; Neralkar, M.; Hotha, S. Angew. Chem., Int. Ed. 2016, 55, 7786.
doi: 10.1002/anie.201511695 |
|
|
(d) Hu, Y.; Yu, K.; Shi, L.-L.; Liu, L.; Sui, J.-J.; Liu, D.-Y.; Xiong, B.; Sun, J.-S. J. Am. Chem. Soc. 2017, 139, 12736.
doi: 10.1021/jacs.7b07020 |
|
| [22] |
Hu, Z.; Tang, Y.; Yu, B. J. Am. Chem. Soc. 2019, 141, 4806.
doi: 10.1021/jacs.9b00210 |
| [23] |
Kim, J. H.; Yang, H.; Boons, G. J. Angew. Chem., Int. Ed. 2005, 44, 947.
doi: 10.1002/anie.200461745 |
| [24] |
Yamada, T.; Takemura, K.; Yoshida, J.; Yamago, S. Angew. Chem., Int. Ed. 2006, 45, 7575.
doi: 10.1002/anie.200602699 |
| [25] |
Liu, H.; Hansen, T.; Zhou, S.-Y.; Wen, G. E.; Liu, X.-X.; Zhang, Q.-J.; Codee, J. D. C.; Schmidt, R. R.; Sun, J.-S. Org. Lett. 2019, 21, 8713.
doi: 10.1021/acs.orglett.9b03321 |
| [26] |
Kim, J. H.; Yang, H.; Park, J.; Boons, G. J. J. Am. Chem. Soc. 2005, 127, 12090.
doi: 10.1021/ja052548h |
| [27] |
Cox, D. J.; Fairbanks, A. J. Tetrahedron: Asymmetry 2009, 20, 773.
|
| [28] |
Singh, G. P.; Watson, A. J.; Fairbanks, A. J. Org. Lett. 2015, 17, 4376.
doi: 10.1021/acs.orglett.5b02226 |
| [29] |
Smoot, J. T.; Pornsuriyasak, P.; Demchenko, A. V. Angew. Chem., Int. Ed. 2005, 44, 7123.
doi: 10.1002/anie.200502694 |
| [30] |
Le Mai Hoang, K.; Liu, X.-W. Nat. Commun. 2014, 5, 5051.
doi: 10.1038/ncomms6051 pmid: 25277946 |
| [31] |
Kabotso, D. E. K.; Smiley, D.; Mayer, J. P.; Gelfanov, V. M.; Perez, T. D.; DiMarchi, R. D.; Pohl, N. L. B.; Liu, F. J. Med. Chem. 2020, 63, 6134.
doi: 10.1021/acs.jmedchem.0c00266 pmid: 32406685 |
| [32] |
Chen, J.; Hansen, T.; Zhang, Q.-J.; Liu, D.-Y.; Sun, Y.; Yan, H.; Codée, J. D. C.; Schmidt, R. R.; Sun, J.-S. Angew. Chem., Int. Ed. 2019, 131, 2.
|
| [33] |
Karak, M.; Joh, Y.; Suenaga, M.; Oishi, T.; Torikai, K. Org. Lett. 2019, 21, 1221.
doi: 10.1021/acs.orglett.9b00220 |
| [34] |
(a) Hansen, T.; Elferink, H.; van Hengst, J. M. A.; Houthuijs, K. J.; Remmerswaal, W. A.; Kromm, A.; Berden, G.; van der Vorm, S.; Rijs, A. M.; Overkleeft, H. S.; Filippov, D. V.; Rutjes, F.; van der Marel, G. A.; Martens, J.; Oomens, J.; Codee, J. D. C.; Boltje, T. J. Nat. Commun. 2020, 11, 2664.
doi: 10.1038/s41467-020-16362-x |
|
(b) Marianski, M.; Mucha, E.; Greis, K.; Moon, S.; Pardo, A.; Kirschbaum, C.; Thomas, D. A.; Meijer, G.; von Helden, G.; Gilmore, K.; Seeberger, P. H.; Pagel, K. Angew. Chem., Int. Ed. 2020, 59, 6166.
doi: 10.1002/anie.201916245 |
|
| [35] |
Baek, J. Y.; Lee, B. Y.; Jo, M. G.; Kim, K. S. J. Am. Chem. Soc. 2009, 131, 17705.
doi: 10.1021/ja907252u |
| [36] |
(a) Yao, D.-M.; Liu, Y.-H.; Yan, S.-Q.; Li, Y.-X.; Hu, C.; Ding, N. Chem. Commun. 2017, 53, 2986.
doi: 10.1039/C7CC00274B |
|
(b) Xu, K.; Man, Q.-M.; Zhang, Y.; Guo, J.; Liu, Y.-C.; Fu, Z.-Y.; Zhu, Y.-Y.; Li, Y.-X.; Zheng, M.-Y.; Ding, N. Org. Chem. Front. 2020, 7, 1606.
doi: 10.1039/D0QO00363H |
|
| [37] |
Liu, X.-L.; Song, Y.-Y.; Liu, A.; Zhou, Y.-E.; Zhu, Q.; Lin, Y.-T.; Sun, H.-Y.; Zhu, K.-D.; Liu, W.; Ding, N.; Xie, W.-J.; Sun, H.-P.; Yu, B.; Xu, P.; Li, W. Angew. Chem., Int. Ed. 2022, 61, e202201510.
|
| [38] |
Barresi, F.; Hindsgaul, O. J. Am. Chem. Soc. 1991, 113, 9376.
doi: 10.1021/ja00024a057 |
| [39] |
Stork, G.; Kim, G. J. Am. Chem. Soc. 1992, 114, 1087.
doi: 10.1021/ja00029a047 |
| [40] |
Walk, J. T.; Buchan, Z. A.; Montgomery, J. Chem. Sci. 2015, 6, 3448.
doi: 10.1039/C5SC00810G |
| [41] |
Ito, Y.; Ogawa, T. Angew. Chem., nt. Ed. 1994, 33, 1765.
|
| [42] |
Ishiwata, A.; Munemura, Y.; Ito, Y. Eur. J. Org. Chem. 2008, 2008, 4250.
doi: 10.1002/ejoc.200800249 |
| [43] |
Kampanart, C.; David, J. C.; Majid, J. C.; Fairbanks, A. J. Org. Lett. 2003, 6, 3797.
doi: 10.1021/ol048427o |
| [44] |
Nakagawa, A.; Tanaka, M.; Hanamura, S.; Takahashi, D.; Toshima, K. Angew. Chem., Int. Ed. 2015, 54, 10935.
doi: 10.1002/anie.201504182 |
| [45] |
Grundler, G.; Schmidt, R. R. Carbohydr. Res. 1985, 135, 203.
doi: 10.1016/S0008-6215(00)90772-9 |
| [46] |
Brandon, P. S.; Gregory, J. M.; Nguyen, H. M. Org. Lett. 2007, 9, 3173.
pmid: 17616145 |
| [47] |
Cai, Y.; Ling, C.-C.; Bundle., D. R. J. Org. Chem. 2005, 70, 4021.
|
| [48] |
Enoch, A. M.; Nguyen, H. M. J. Am. Chem. Soc. 2009, 131, 8778.
doi: 10.1021/ja903123b |
| [49] |
Ferrier, R. J. Top. Curr. Chem. 2001, 215, 153.
|
| [50] |
Xiang, S.-H.; Hoang Kle, M.; He, J.-X.; Tan, Y.-J.; Liu, X.-W. Angew. Chem., Int. Ed. 2015, 54, 604.
|
| [51] |
Ji, L.; Xiang, S.-H.; Leng, W.-L.; Le Mai Hoang, K.; Liu, X.-W. Org. Lett. 2015, 17, 1357.
doi: 10.1021/ol5037437 pmid: 25730324 |
| [52] |
Probst, N.; Grelier, G.; Ghermani, N.; Gandon, V.; Alami, M.; Messaoudi, S. Org. Lett. 2017, 19, 5038.
doi: 10.1021/acs.orglett.7b02170 |
| [53] |
Ghouilem, J.; Tran, C.; Grimblat, N.; Retailleau, P.; Alami, M.; Gandon, V.; Messaoudi, S. ACS Catal. 2021, 11, 1818.
doi: 10.1021/acscatal.0c05052 |
| [54] |
Yao, H.; Zhang, S.-S.; Leng, W.-L.; Leow, M. L.; Xiang, S.-H.; He, J.-X.; Liao, H.-Z.; Le Mai Hoang, K.; Liu, X.-W. ACS Catal. 2017, 7, 5456.
doi: 10.1021/acscatal.7b01630 |
| [55] |
Wang, Q.-Y.; Lai, M.-N.; Luo, H.-J.; Ren, K.-K.; Wang, J.-R.; Huang, N.-Y.; Deng, Z.-S.; Zou, K.; Yao, H. Org. Lett. 2022, 24, 1587.
doi: 10.1021/acs.orglett.1c04378 |
| [56] |
Dai, Y.-W.; Zheng, J.-F.; Zhang, Q. Org. Lett. 2018, 20, 3923.
doi: 10.1021/acs.orglett.8b01506 |
| [57] |
Wang, Y.; Yao, H.; Hua, M.; Jiao, Y.; He, H.-B.; Liu, M.-G.; Huang, N.-Y.; Zou, K. J. Org. Chem. 2020, 85, 7485.
doi: 10.1021/acs.joc.0c00975 |
| [58] |
Liu, Y.-X.; Jiao, Y.; Luo, H.-J.; Huang, N.-Y.; Lai, M.-L.; Zou, K.; Yao, H. ACS Catal. 2021, 11, 5287.
doi: 10.1021/acscatal.1c00225 |
| [59] |
Yasomanee, J. P.; Demchenko, A. V. J. Am. Chem. Soc. 2012, 134, 20097.
doi: 10.1021/ja307355n pmid: 23167454 |
| [60] |
Liu, Q.-W.; Bin, H.-C.; Yang, J.-S. Org. Lett. 2013, 15, 3974.
doi: 10.1021/ol401755e |
| [61] |
Liu, X.-L.; Lin, Y.-T.; Liu, A.; Sun, Q.-H.; Sun, H.-Y.; Xu, P.; Li, G.-L.; Song, Y.-Y.; Xie, W.-J.; Sun, H.-P.; Yu, B.; Li, W. Chin. J. Chem. 2021, 40, 443.
doi: 10.1002/cjoc.202100865 |
| [62] |
Zeng, J.; Wang, R.-B.; Zhang, S.-X.; Fang, J.; Liu, S.-S.; Sun, G.-F.; Xu, B.-B.; Xiao, Y.; Fu, D.-X.; Zhang, W.-Q.; Hu, Y.-X.; Wan, Q. J. Am. Chem. Soc. 2019, 141, 8509.
doi: 10.1021/jacs.9b01862 |
| [1] | 张剑, 梁万洁, 杨艺, 闫法超, 刘会. 联烯胺化合物的区域选择性双官能团化[J]. 有机化学, 2024, 44(2): 335-348. |
| [2] | 朱彦硕, 王红言, 舒朋华, 张克娜, 王琪琳. 烷氧自由基引发1,5-氢原子转移实现C(sp3)—H键官能团化的研究进展[J]. 有机化学, 2024, 44(1): 1-17. |
| [3] | 董江湖, 宣良明, 王池, 赵晨熙, 王海峰, 严琼姣, 汪伟, 陈芬儿. 无过渡金属或无光催化剂条件下可见光促进喹喔啉酮C(3)—H官能团化研究进展[J]. 有机化学, 2024, 44(1): 111-136. |
| [4] | 王兢睿, 冯永奎, 王能中, 黄年玉, 姚辉. 钯催化立体选择性合成硝基烷类β-碳糖苷[J]. 有机化学, 2023, 43(9): 3216-3225. |
| [5] | 王玉超, 刘晋彪, 何智涛. 钯催化共轭二烯的不对称氢官能团化[J]. 有机化学, 2023, 43(8): 2614-2627. |
| [6] | 刘颖杰, 石岗庆, 仇格, 张鑫, 宋冬雪, 陈宁, 于淼, 许颖. 光/电催化醚α-位官能团化研究进展[J]. 有机化学, 2023, 43(8): 2664-2681. |
| [7] | 许晓萍, 张翼飞, 莫小渝, 江俊. 铑催化3-重氮吲哚-2-亚胺与吡唑啉酮的C—H官能团化反应制备3-吡唑基吲哚[J]. 有机化学, 2023, 43(7): 2519-2527. |
| [8] | 潘彦年, 秦萧, 袁成凯, 鲁艺. 配体在Cp*Rh(III)催化C—H键官能团化反应中的应用[J]. 有机化学, 2023, 43(3): 924-948. |
| [9] | 侯虹宇, 程元元, 陈彬, 佟振合, 吴骊珠. 光催化烯烃α-酰化反应[J]. 有机化学, 2023, 43(3): 1012-1022. |
| [10] | 李落墨, 杨小会. 离子转移反应的研究进展[J]. 有机化学, 2023, 43(3): 1036-1044. |
| [11] | 刘宁, 爨晓丹, 李慧, 段希焱. 烯胺酮α-官能团化反应的研究进展[J]. 有机化学, 2023, 43(2): 602-621. |
| [12] | 南宁, 吴双, 秦景灏, 李金恒. 基于硅烷化启动的环化反应研究进展[J]. 有机化学, 2023, 43(10): 3414-3453. |
| [13] | 赵晓正, 凌琴琴, 曹桂妍, 火星, 赵小龙, 苏瀛鹏. 炔丙醇类化合物参与的环化反应研究进展[J]. 有机化学, 2022, 42(9): 2605-2639. |
| [14] | 宇世伟, 陈兆华, 陈淇, 林舒婷, 何金萍, 陶冠燊, 汪朝阳. 硫代磺酸酯的合成与应用研究进展[J]. 有机化学, 2022, 42(8): 2322-2330. |
| [15] | 闫法超, 李洋, 李玉东, Mohamed Makha, 李跃辉. 氰甲基导向的吲哚选择性C—H烯基化[J]. 有机化学, 2022, 42(7): 2192-2200. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||