有机化学 ›› 2023, Vol. 43 ›› Issue (4): 1483-1491.DOI: 10.6023/cjoc202208031 上一篇 下一篇
所属专题: 有机氟化学虚拟合辑
研究论文
梁志鹏a, 叶浩a, 张海滨b, 姜国民a,*( ), 吴新星a,c,*(
), 吴新星a,c,*( )
)
收稿日期:2022-08-24
修回日期:2022-11-02
发布日期:2022-12-07
通讯作者:
姜国民, 吴新星
基金资助:
Zhipeng Lianga, Hao Yea, Haibin Zhangb, Guomin Jianga( ), Xinxing Wua,c(
), Xinxing Wua,c( )
)
Received:2022-08-24
Revised:2022-11-02
Published:2022-12-07
Contact:
Guomin Jiang, Xinxing Wu
Supported by:文章分享
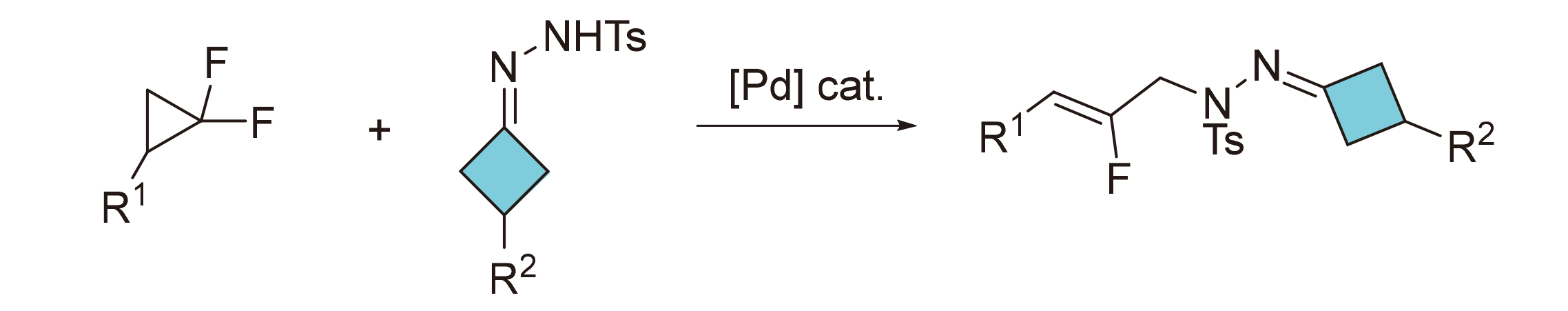
以环丁酮类腙和偕二氟环丙烷为原料, 通过钯催化的偕二氟环丙烷开环和氮中心的亲核捕获过程, 以中等至优秀的收率合成了一系列N-氟代烯丙基腙四元环化合物. 该方法具有较强的官能团兼容性和良好的底物普适性, 同时适用于克级规模反应制备.
梁志鹏, 叶浩, 张海滨, 姜国民, 吴新星. 环丁酮类腙参与的偕二氟环丙烷开环胺化反应[J]. 有机化学, 2023, 43(4): 1483-1491.
Zhipeng Liang, Hao Ye, Haibin Zhang, Guomin Jiang, Xinxing Wu. Ring Opening Amination of gem-Difluorocyclopropanes with Cyclobutanone Hydrazones[J]. Chinese Journal of Organic Chemistry, 2023, 43(4): 1483-1491.
| Entry | Ligand | Base | Solvent | Yieldb/% | Z/Ec |
|---|---|---|---|---|---|
| 1 | PPh3 | Cs2CO3 | Toluene | 21 | 21∶1 |
| 2 | PPh3 | Cs2CO3 | MeCN | Trace | — |
| 3 | PPh3 | Cs2CO3 | DME | Trace | — |
| 4 | PPh3 | Cs2CO3 | DCE | 30 | 33∶1 |
| 5d | PPh3 | Cs2CO3 | THF | 37 | 20∶1 |
| 6 | PPh3 | Cs2CO3 | Dioxane | 43 | 28∶1 |
| 7 | PPh3 | K2CO3 | Dioxane | 40 | 24∶1 |
| 8 | PPh3 | tBuOK | Dioxane | Trace | — |
| 9 | PPh3 | tBuOLi | Dioxane | Trace | — |
| 10 | PPh3 | K3PO4 | Dioxane | 51 | 23∶1 |
| 11 | PPh3 | NaHCO3 | Dioxane | 62 | 19∶1 |
| 12 | P(2-furyl)3 | NaHCO3 | Dioxane | Trace | — |
| 13 | PCy3 | NaHCO3 | Dioxane | 18 | 23∶1 |
| 14 | Xphos | NaHCO3 | Dioxane | 89 | 27∶1 |
| 15 | DPPB | NaHCO3 | Dioxane | 28 | 25∶1 |
| 16 | Xantphos | NaHCO3 | Dioxane | 73 | 28∶1 |
| Entry | Ligand | Base | Solvent | Yieldb/% | Z/Ec |
|---|---|---|---|---|---|
| 1 | PPh3 | Cs2CO3 | Toluene | 21 | 21∶1 |
| 2 | PPh3 | Cs2CO3 | MeCN | Trace | — |
| 3 | PPh3 | Cs2CO3 | DME | Trace | — |
| 4 | PPh3 | Cs2CO3 | DCE | 30 | 33∶1 |
| 5d | PPh3 | Cs2CO3 | THF | 37 | 20∶1 |
| 6 | PPh3 | Cs2CO3 | Dioxane | 43 | 28∶1 |
| 7 | PPh3 | K2CO3 | Dioxane | 40 | 24∶1 |
| 8 | PPh3 | tBuOK | Dioxane | Trace | — |
| 9 | PPh3 | tBuOLi | Dioxane | Trace | — |
| 10 | PPh3 | K3PO4 | Dioxane | 51 | 23∶1 |
| 11 | PPh3 | NaHCO3 | Dioxane | 62 | 19∶1 |
| 12 | P(2-furyl)3 | NaHCO3 | Dioxane | Trace | — |
| 13 | PCy3 | NaHCO3 | Dioxane | 18 | 23∶1 |
| 14 | Xphos | NaHCO3 | Dioxane | 89 | 27∶1 |
| 15 | DPPB | NaHCO3 | Dioxane | 28 | 25∶1 |
| 16 | Xantphos | NaHCO3 | Dioxane | 73 | 28∶1 |
| [1] |
(a) Hancock, E. N.; Wiest, J. M.; Brown, M. K. Nat. Prod. Rep. 2019, 36, 1383.
doi: 10.1039/c8np00083b pmid: 30855044 |
|
(b) Li, J.; Gao, K.; Bian, M.; Ding, H. Org. Chem. Front. 2020, 7, 136.
doi: 10.1039/C9QO01178A pmid: 30855044 |
|
|
(c) Lukin, K.; Kishore, V.; Gordon, T. Org. Process Res. Dev. 2013, 17, 666.
doi: 10.1021/op300345v pmid: 30855044 |
|
|
(d) Beck, J. C.; Lacker, C. R.; Chapman, L. M.; Reisman, S. E. Chem. Sci. 2019, 10, 2315.
doi: 10.1039/C8SC05444D pmid: 30855044 |
|
|
(e) Cui, Y.; Xia, D. Chin. J. Org. Chem. 2021, 41, 907. (in Chinese)
doi: 10.6023/cjoc202008036 pmid: 30855044 |
|
|
(崔英翠, 夏德斌, 有机化学, 2021, 41, 907.)
doi: 10.6023/cjoc202008036 pmid: 30855044 |
|
| [2] |
(a) Biletskyi, B.; Colonna, P.; Masson, K.; Parrain, J.-L.; Commeiras, L.; Chouraqui, G. Chem. Soc. Rev. 2021, 50, 7513.
doi: 10.1039/D0CS01396J |
|
(b) Murakami, M.; Ishida, N. Chem. Rev. 2021, 121, 264.
doi: 10.1021/acs.chemrev.0c00569 |
|
| [3] |
For selected examples: (a) Wang, Y.; Hu, M.; Ding, L.; Wang, Y.; Wang, X.-N.; Chang, J. Org. Lett. 2022, 24, 5056.
doi: 10.1021/acs.orglett.2c01825 pmid: 33356273 |
|
(b) Li, H.; Hsung, R. P.; DeKorver, K. A.; Wei, Y. Org. Lett. 2010, 12, 37806.
pmid: 33356273 |
|
|
(c) Kölmel, D. K.; Ratnayake, A. S.; Flanagan, M. E.; Tsai, M.-H.; Duan, C.; Song, C. Org. Lett. 2020, 22, 2908.
doi: 10.1021/acs.orglett.0c00574 pmid: 33356273 |
|
|
(d) Luzung, M. R.; Mauleón, P.; Toste, F. D. J. Am. Chem. Soc. 2007, 129, 12402.
doi: 10.1021/ja075412n pmid: 33356273 |
|
|
(e) Okamoto, K.; Shimbayashi, T.; Tamura, E.; Ohe, K. Org. Lett. 2015, 17, 5843.
doi: 10.1021/acs.orglett.5b03065 pmid: 33356273 |
|
|
(f) Oderinde, M. S.; Ramirez, A.; Murali Dhar, T. G.; L. A. M.; Jorge, C.; Aulakh, D.; Sandhu, B.; Pawluczyk, J.; Sarjeant, A. A.; Meanwell, N. A.; Mathur, A.; Kempson, J. J. Org. Chem. 2021, 86, 1730.
doi: 10.1021/acs.joc.0c02547 pmid: 33356273 |
|
|
(g) Conner, M. L.; Kevin Brown, M. ; J. Org. Chem. 2016, 81, 8050.
doi: 10.1021/acs.joc.6b01446 pmid: 33356273 |
|
|
(h) Zhu, H.-T.; Ke, S.; Zhou, N.-N.; Fan, M.-J.; Yang,, D.-S. Org. Lett. 2016, 18, 4554.
doi: 10.1021/acs.orglett.6b02195 pmid: 33356273 |
|
|
(i) Sakai, K.; Kochi, T.; Kakiuchi, F. Org. Lett. 2013, 15, 1024.
doi: 10.1021/ol303510k pmid: 33356273 |
|
| [4] |
For selected examples: (a) Oishi, S.; Kamitani, H.; Kodama, E.; Matsuoka, M.; Fujii, N. Org. Biomol. Chem. 2009, 7, 2872.
doi: 10.1039/b907983a |
|
(b) Fujita, T.; Fuchibe, K.; Ichikawa, J. Angew. Chem., Int. Ed. 2019, 58, 390.
doi: 10.1002/anie.v58.2 |
|
|
(c) Osada, S.; Sano, S.; Ueyama, M.; Chuman, Y.; Kodama, H.; Sakaguchi, K. Bioorg. Med. Chem. 2010, 18, 605.
doi: 10.1016/j.bmc.2009.12.005 |
|
|
(d) Zhang, X.; Cao, S. Tetrahedron Lett. 2017, 58, 375.
doi: 10.1016/j.tetlet.2016.12.054 |
|
|
(e) Bartlett, P. A.; Otake, A. J. Org. Chem. 1995, 60, 3107.
doi: 10.1021/jo00115a028 |
|
| [5] |
For selected examples: (a) Dolbier, W. R.; Battiste, M. A. Chem. Rev. 2003, 103, 1071.
doi: 10.1021/cr010023b |
|
(b) Wenz, J.; Rettenmeier, C. A.; Wadepohl, H.; Gade, L. H. Chem. Commun. 2016, 52, 202.
doi: 10.1039/C5CC08950F |
|
|
(c) Song, X.; Xu, C.; Wang, M. Tetrahedron Lett. 2017, 58, 1806.
doi: 10.1016/j.tetlet.2017.03.058 |
|
|
(d) Song, X.; Xu, C.; Du, D.; Zhao, Z.; Zhu, D.; Wang, M. Org. Lett. 2017, 19, 6542.
doi: 10.1021/acs.orglett.7b03254 |
|
|
(e) Fu, Z.; Zhu, J.; Guo, S.; Lin, A. Chem. Commun. 2021, 57, 1262.
doi: 10.1039/D0CC07529A |
|
|
(f) Jiang, Z.-T.; Huang, J.; Zeng, Y.; Hu, F.; Xia, Y. Angew. Chem., Int. Ed. 2021, 60, 10626
doi: 10.1002/anie.v60.19 |
|
| [6] |
For selected examples: (a) Ahmed, E.-A. M. A.; Suliman, A. M. Y.; Gong, T.-J.; Fu, Y. Org. Lett. 2019, 21, 5645.
doi: 10.1021/acs.orglett.9b01979 |
|
(b) Ahmed, E.-A. M. A.; Suliman, A. M. Y.; Gong, T.-J.; Fu, Y. Org. Lett. 2020, 22, 1414.
doi: 10.1021/acs.orglett.0c00022 |
|
| [7] |
Xu, J.; Ahmed, E.-A.; Xiao, B.; Lu, Q.-Q.; Wang, Y.-L.; Yu, C.-G.; Fu, Y. Angew. Chem., Int. Ed. 2015, 54, 8231.
doi: 10.1002/anie.201502308 |
| [8] |
Lv, L.; Li, C.-J. Angew. Chem., Int. Ed. 2021, 60, 13098.
doi: 10.1002/anie.v60.23 |
| [9] |
Xiong, B.; Chen, X.; Liu, J.; Zhang, X.; Xia, Y.; Lian, Z. ACS Catal. 2021, 11, 11960.
doi: 10.1021/acscatal.1c02952 |
| [10] |
(a) Ning, X.; Chen, Y.; Hu, F.; Xia, Y. Org. Lett. 2021, 23, 8348.
doi: 10.1021/acs.orglett.1c03052 |
|
(b) Ye, H.; Ren, T.; Wu, X. Chin. J. Org. Chem. 2021, 41, 4338. (in Chinese)
doi: 10.6023/cjoc202106048 |
|
|
(叶浩, 任婷婷, 吴新星, 有机化学, 2021, 41, 4338.)
doi: 10.6023/cjoc202106048 |
| [1] | 陆晓雨, 孙晓梅, 钮亚琴, 王俊超, 殷文婧, 高梦婷, 刘孜, 韦正桓, 陶庭骅. 铜催化氟代丙烯酸与氧杂吖丙啶的脱羧交叉偶联反应[J]. 有机化学, 2023, 43(6): 2110-2119. |
| [2] | 杜青锋, 张璐, 高峰, 王乐, 张万斌. 过渡金属催化氧/氮杂环丙烷不对称开环反应的研究进展[J]. 有机化学, 2022, 42(10): 3240-3262. |
| [3] | 李志清, 邱潇杨, 娄江, 王强. 可见光催化偕二氟烯烃碳-氟键官能化反应的研究进展[J]. 有机化学, 2021, 41(11): 4192-4207. |
| [4] | 孙建婷, 陈玲艳, 魏邦国. 二碘化钐促进的2-哌啶酮与α,β-不饱和酸酯的加成-开环反应研究[J]. 有机化学, 2021, 41(11): 4320-4326. |
| [5] | 陶萍芳, 黄俊, 刘玉钊, 韦光明, 王艺菲, 韦贤生, 黄国保, 李秀英. 钯催化氧杂降冰片烯与三氟硼酸钾盐的不对称开环反应[J]. 有机化学, 2020, 40(6): 1630-1637. |
| [6] | 吴雅莉, 周雪松, 肖文精, 陈加荣. 乙烯基氮杂环丙烷在有机合成中的研究进展[J]. 有机化学, 2020, 40(11): 3760-3776. |
| [7] | 许露露, 叶倩雯, 程冬萍, 李小年, 许孝良. N-溴代丁二酰亚胺促进的环丙烯羧酸酯的区域选择性开环反应[J]. 有机化学, 2019, 39(9): 2645-2649. |
| [8] | 和振秀, 周永云, 孙蔚青, 樊瑞峰, 沈国礼, 樊保敏. 铑/锌共催化苯酚对氧杂苯并降冰片烯的不对称开环反应研究[J]. 有机化学, 2019, 39(3): 754-760. |
| [9] | 张娟, 王碧云, 刘熠森, 曹松. 镍催化的偕二氟芳基乙烯与有机锌交叉偶联反应立体选择性合成(Z)-单氟烯烃[J]. 有机化学, 2019, 39(1): 249-256. |
| [10] | 胡继荣, 徐建斌, 邹玲玲, 吕海平, 樊瑞峰, 刘娜, 周永云, 樊保敏. 铑催化酸酐对氧杂苯并降冰片烯的不对称开环反应研究[J]. 有机化学, 2018, 38(7): 1687-1694. |
| [11] | 廖富民, 余金生, 周剑. 三或四取代单氟烯烃的高立体选择性合成研究进展[J]. 有机化学, 2017, 37(9): 2175-2186. |
| [12] | 褚旭, 常宏宏, 高文超, 魏文珑, 李兴. 碳亲核试剂对氮杂环丙烷的开环反应研究进展[J]. 有机化学, 2017, 37(10): 2569-2589. |
| [13] | 李泽民, 黄道锐, 马丛明, 许晓娟, 刘祖亮, 姚其正. 7-氨基-6-硝基-[1,2,5]噁二唑并[3,4-b]吡啶-1-氧化物的胺化开环反应及产物的抗肿瘤活性[J]. 有机化学, 2016, 36(9): 2236-2241. |
| [14] | 鄢东, 吴超, 易卫国. 金催化炔烃与1,4-二氧六环的开环加成反应研究[J]. 有机化学, 2014, 34(9): 1857-1863. |
| [15] | 李小娜, 周宏勇, 张鹏亮, 王家喜. 手性氨基酸衍生物的合成:硅胶促进的取代氮丙啶的开环反应[J]. 有机化学, 2013, 33(12): 2545-2550. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||