有机化学 ›› 2023, Vol. 43 ›› Issue (6): 2197-2205.DOI: 10.6023/cjoc202209011 上一篇 下一篇
研究论文
卢凯, 屈浩琦, 陈樨, 秋慧, 郑晶*( ), 马猛涛*(
), 马猛涛*( )
)
收稿日期:2022-09-10
修回日期:2022-11-01
发布日期:2022-12-21
基金资助:
Kai Lu, Haoqi Qu, Xi Chen, Hui Qiu, Jing Zheng*( ), Mengtao Ma*(
), Mengtao Ma*( )
)
Received:2022-09-10
Revised:2022-11-01
Published:2022-12-21
Contact:
E-mail: Supported by:文章分享
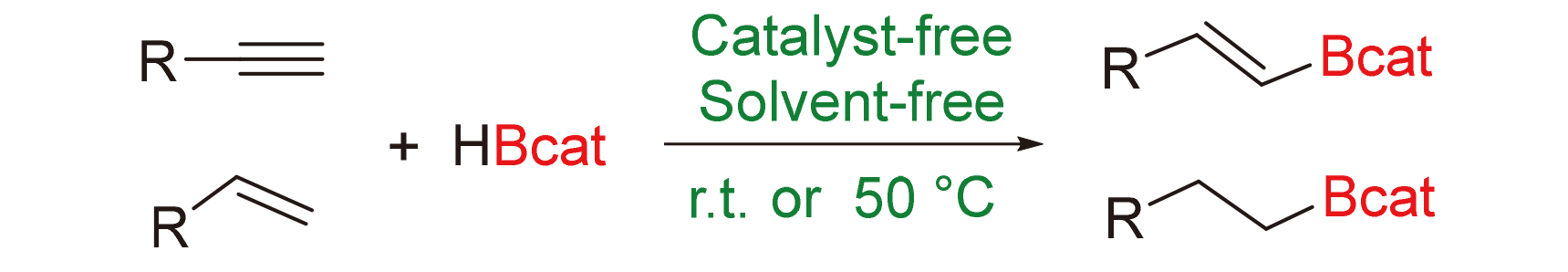
报道了无催化剂和无溶剂条件下炔烃和烯烃与儿茶酚硼烷的硼氢化反应, 各种芳香族和脂肪族炔烃和烯烃底物分别以高产率和高区域/立体选择性成功地转化为相应的反马氏烯基和烷基硼酸酯产物. 克级硼氢化和多用途转化反应显示了其在实际应用中的巨大潜力. 在相应密度泛函理论(DFT)计算的基础上, 提出了一种可能的反应机理.
卢凯, 屈浩琦, 陈樨, 秋慧, 郑晶, 马猛涛. 无催化剂、无溶剂条件下炔烃和烯烃与儿茶酚硼烷的硼氢化反应[J]. 有机化学, 2023, 43(6): 2197-2205.
Kai Lu, Haoqi Qu, Xi Chen, Hui Qiu, Jing Zheng, Mengtao Ma. Catalyst-Free and Solvent-Free Hydroboration of Alkynes and Alkenes with Catecholborane[J]. Chinese Journal of Organic Chemistry, 2023, 43(6): 2197-2205.
| Entry | n | Temp./℃ | Time/h | Solvent | Conv.a/% |
|---|---|---|---|---|---|
| 1 | 1.1 | r.t. | 12 | CDCl3 | 70 |
| 2 | 1.2 | r.t. | 6 | 76 | |
| 3 | 1.2 | r.t. | 12 | 99 | |
| 4 | 1.2 | r.t. | 12 | CDCl3 | 99 |
| 5 | 1.2 | 40 | 6 | 80 | |
| 6 | 1.2 | 40 | 12 | 99 | |
| 7 | 3.0 | r.t. | 12 | 99 | |
| 8 | 3.0 | 110 | 12 | CDCl3 | 99 |
| Entry | n | Temp./℃ | Time/h | Solvent | Conv.a/% |
|---|---|---|---|---|---|
| 1 | 1.1 | r.t. | 12 | CDCl3 | 70 |
| 2 | 1.2 | r.t. | 6 | 76 | |
| 3 | 1.2 | r.t. | 12 | 99 | |
| 4 | 1.2 | r.t. | 12 | CDCl3 | 99 |
| 5 | 1.2 | 40 | 6 | 80 | |
| 6 | 1.2 | 40 | 12 | 99 | |
| 7 | 3.0 | r.t. | 12 | 99 | |
| 8 | 3.0 | 110 | 12 | CDCl3 | 99 |
| Entry | n | Temp./℃ | Time/h | Conv.a/% |
|---|---|---|---|---|
| 1 | 1.2 | rt | 12 | 12 |
| 2 | 1.2 | 50 | 12 | 76 |
| 3 | 1.2 | 50 | 20 | 81 |
| 4 | 1.5 | 50 | 20 | 99 |
| Entry | n | Temp./℃ | Time/h | Conv.a/% |
|---|---|---|---|---|
| 1 | 1.2 | rt | 12 | 12 |
| 2 | 1.2 | 50 | 12 | 76 |
| 3 | 1.2 | 50 | 20 | 81 |
| 4 | 1.5 | 50 | 20 | 99 |
| [1] |
Miyaura, N.; Suzuki, A. Chem. Rev. 1995, 95, 2457.
doi: 10.1021/cr00039a007 |
| [2] |
Dhillon, R. S. Hydroboration and Organic Synthesis, Springer Berlin Heidelberg, New York, 2007, pp. 59-99.
|
| [3] |
Saha, K.; Ghosh, S. Dalton Trans. 2022, 51, 2631.
doi: 10.1039/D1DT04289K |
| [4] |
Bose, S. K.; Mao, L. J.; Kuehn, L.; Radius, U.; Nekvinda, J.; Santos, W. L.; Westcott, S. A.; Steel, P. G.; Marder, T. B. Chem. Rev. 2021, 121, 13238.
doi: 10.1021/acs.chemrev.1c00255 |
| [5] |
Luo, M.; Zang, S.; Yao, W.; Zheng, J.; Ma, M. Sci. Sin. Chim. 2020, 50, 639.
doi: 10.1360/SSC-2020-0025 |
| [6] |
Shegavi, M. L.; Bose, S. K. Catal. Sci. Technol. 2019, 9, 3307.
doi: 10.1039/C9CY00807A |
| [7] |
Yoshida, H. ACS Catal. 2016, 6, 1799.
doi: 10.1021/acscatal.5b02973 |
| [8] |
Geier, S. J.; Vogels, C. M.; Westcott, S. A. ACS Symp. Ser. 2016, 1236, 209.
|
| [9] |
Chong, C. C.; Kinjo, R. ACS Catal. 2015, 5, 3238.
doi: 10.1021/acscatal.5b00428 |
| [10] |
Li, C.; Song, S.; Li, Y.; Xu, C.; Luo, Q.; Guo, Y.; Wang, X. Nat. Commun. 2021, 12, 3813.
doi: 10.1038/s41467-021-24117-5 |
| [11] |
Cao, X.; Li, J.; Zhu, A.; Su, F.; Yao, W.; Xue, F.; Ma, M. Org. Chem. Front. 2020, 7, 3625.
doi: 10.1039/D0QO00938E |
| [12] |
Cao, X.; Wang, W.; Lu, K.; Yao, W.; Xue, F.; Ma, M. Dalton Trans. 2020, 49, 2776.
doi: 10.1039/d0dt00465k pmid: 32073112 |
| [13] |
Wang, W.; Shen, X.; Zhao, F.; Jiang, H.; Yao, W.; Pullarkat, S. A.; Xu, L.; Ma, M. J. Org. Chem. 2018, 83, 69.
doi: 10.1021/acs.joc.7b02076 |
| [14] |
Arase, A.; Nunokawa, Y.; Masuda, Y.; Hoshi, M. J. Chem. Soc., Chem. Commun. 1991, 205.
|
| [15] |
Kisan, S.; Krishnakumar, V.; Gunanathan, C. ACS Catal. 2017, 7, 5950.
doi: 10.1021/acscatal.7b01750 |
| [16] |
MacNair, A. J.; Millet, C. R. P.; Nichol, G. S.; Ironmonger, A.; Thomas, S. P. ACS Catal. 2016, 6, 7217.
doi: 10.1021/acscatal.6b02281 |
| [17] |
Ulm, F.; Cornaton, Y.; Djukic, J.; Chetcuti, M. J.; Ritleng, V. Chem.-Eur. J. 2020, 26, 8916.
doi: 10.1002/chem.v26.41 |
| [18] |
Khalimon, A. Y.; Farha, P.; Kuzminab, L. G.; Nikonov, G. I. Chem. Commun. 2012, 48, 455.
doi: 10.1039/C1CC14508H |
| [19] |
Bai, Y.; Cui, C. Acta Chim. Sinica 2020, 78, 763. (in Chinese)
doi: 10.6023/A20050163 |
|
(白云平, 崔春明, 化学学报, 2020, 78, 763.)
doi: 10.6023/A20050163 |
|
| [20] |
Hartwig, J. F.; Muhoro, C. N. Organometallics 2000, 19, 30.
doi: 10.1021/om990507m |
| [21] |
He, X.; Hartwig, J. F. J. Am. Chem. Soc. 1996, 118, 1696.
doi: 10.1021/ja9516773 |
| [22] |
Gridnev, I. D.; Miyaura, N.; Suzuki, A. Organometallics 1993, 12, 589.
doi: 10.1021/om00026a053 |
| [23] |
Leyva, A.; Zhang, X.; Corma, A. Chem. Commun. 2009, 33, 4947.
|
| [24] |
Yang, D.; Huang, X. Synth. Commun. 1996, 26, 4617.
doi: 10.1080/00397919608004786 |
| [25] |
Ohmura, T.; Yamamoto, Y.; Miyaura, N. J. Am. Chem. Soc. 2000, 122, 4990.
doi: 10.1021/ja0002823 |
| [26] |
Merola, J. S.; Knorr, J. R. J. Organomet. Chem. 2014, 750, 86.
doi: 10.1016/j.jorganchem.2013.10.049 |
| [27] |
Mamidala, R.; Pandey, V. K.; Rit, A. Chem. Commun. 2019, 55, 989.
doi: 10.1039/C8CC07499B |
| [28] |
Arase, A.; Hoshi, M.; Mijin, A.; Nishi, K. Synth. Commun. 1995, 25, 1957.
doi: 10.1080/00397919508015872 |
| [29] |
Shirakawa, K.; Arase, A.; Hoshi, M. Synthesis 2004, 1814.
|
| [30] |
Shao, H.; Chakrabarty, S.; Qi, X.; Takacs, J. M.; Liu, P. J. Am. Chem. Soc. 2021, 143, 4801.
doi: 10.1021/jacs.1c01303 |
| [31] |
Xi, Y.; Su, B.; Qi, X.; Pedram, S.; Liu, P.; Hartwig, J. F. J. Am. Chem. Soc. 2020, 142, 18213.
doi: 10.1021/jacs.0c08746 |
| [32] |
Bochat, A. J.; Shoba, V. M.; Takacs, J. M. Angew. Chem., Int. Ed. 2019, 58, 9434.
doi: 10.1002/anie.v58.28 |
| [33] |
Rej, S.; Das, A.; Panda, T. K. Adv. Synth. Catal. 2021, 363, 4818.
doi: 10.1002/adsc.v363.21 |
| [34] |
Ding, H.; Gao, W.; Yu, T.; Wang, Z.; Gou, F.; Ding, S. J. Org. Chem. 2022, 87, 1526.
doi: 10.1021/acs.joc.1c02315 |
| [35] |
Zhong, M.; Gagne, Y.; Hope, T. O.; Pannecoucke, X.; Frenette, M.; Jubault, P.; Poisson, T. Angew. Chem., Int. Ed. 2021, 60, 14498.
doi: 10.1002/anie.v60.26 |
| [36] |
Liu, J.; Xie, Y.; Wu, C.; Shao, Y.; Zhang, F.; Shi, Y.; Liu, Q.; Chen, J. Org. Chem. Front. 2021, 8, 3802.
doi: 10.1039/D1QO00513H |
| [37] |
Chen, J.; Shen, X.; Lu, Z. Angew. Chem., Int. Ed. 2021, 60, 690.
doi: 10.1002/anie.v60.2 |
| [38] |
Kuciński, K.; Hreczycho, G. Green Chem. 2020, 22, 5210.
doi: 10.1039/D0GC01430C |
| [39] |
Harinath, A.; Bhattacharjee, J.; Panda, T. K. Chem. Commun. 2019, 55, 1386.
doi: 10.1039/C8CC08841A |
| [40] |
Wang, W.; Luo, M.; Zhu, D.; Yao, W.; Xu, L.; Ma, M. Org. Biomol. Chem. 2019, 17, 3604.
doi: 10.1039/C9OB00485H |
| [41] |
Jaladi, A. K.; Choi, H. S.; An, D. K. New J. Chem. 2020, 44, 13626.
doi: 10.1039/D0NJ02612C |
| [42] |
Yuan, K.; Suzuki, N.; Mellerup, S. K.; Wang, X.; Yamaguchi, S.; Wang, S. Org. Lett. 2016, 18, 720.
doi: 10.1021/acs.orglett.5b03698 |
| [43] |
Stachowiak, H.; Kaźmierczak, J.; Kuciński, K.; Hreczycho, G. Green Chem. 2018, 20, 1738.
doi: 10.1039/C8GC00042E |
| [44] |
Wang, W.; Luo, M.; Yao, W.; Ma, M.; Pullarkat, S. A.; Xu, L.; Leung, P. New J. Chem. 2019, 43, 10744.
doi: 10.1039/C9NJ02722J |
| [45] |
Shimizu, K.; Yasutake, S.; Kondo, R. Chem. Pharm. Bull. 2003, 51, 318.
doi: 10.1248/cpb.51.318 |
| [46] |
Segun, P. A.; Ogbole, O. O.; Akinleye, T. E.; Faleye, T. O. C.; Adeniji, A. J. Nat. Prod. Res. 2021, 35, 1909.
doi: 10.1080/14786419.2019.1644505 |
| [47] |
Dery, S.; Alshanski, I.; Mervinetsky, E.; Feferman, D.; Yitzchaik, S.; Hurevich, M.; Gross, E. T. Chem. Commun. 2021, 57, 6233.
doi: 10.1039/D1CC02491D |
| [48] |
Zhang, M.; Xu, H. J. Comput. Chem. 2019, 40, 1772.
doi: 10.1002/jcc.v40.19 |
| [49] |
Pandey, V. K.; Donthireddy, S. N. R.; Rit, A. Chem.-Asian J. 2019, 14, 3255.
doi: 10.1002/asia.201901016 |
| [50] |
Geier, S. J.; Binder, J. F.; Vogels, C. M.; Watanabe, L. K.; Macdonald, C. L. B.; Westcott, S. A. New J. Chem. 2021, 45, 14908.
doi: 10.1039/D1NJ01025E |
| [51] |
Khalimon, A. Y.; Farhaa, P. M.; Nikonov, G. I. Dalton Trans. 2015, 44, 18945.
doi: 10.1039/c5dt02945g pmid: 26469856 |
| [52] |
Farinola, G. M.; Fiandanese, V.; Mazzone, L.; Naso, F. Chem. Commun. 1995, 2523.
|
| [53] |
Garon, C. N.; McIsaac, D. I.; Vogels, C. M.; Decken, A.; Williams, I. D.; Kleeberg, C.; Marder, T. B.; Westcott, S. A. Dalton Trans. 2009, 9, 1624.
|
| [54] |
Li, S.; Li, J.; Xia, T.; Zhao, W. Chin. J. Chem. 2019, 37, 462.
doi: 10.1002/cjoc.v37.5 |
| [55] |
Geier, M. J.; Geier, S. J.; Vogels, C. M.; Béland, F.; Westcott, S. A. Synlett 2009, 3, 477.
|
| [56] |
Morrill, C.; Grubbs, R. H. J. Org. Chem. 2003, 68, 6031.
doi: 10.1021/jo0345345 |
| [57] |
Heard, D. M.; Tayler, E. R.; Cox, R. J.; Simpson, T. J.; Willis, C. L. Tetrahedron 2020, 76, 130717.
doi: 10.1016/j.tet.2019.130717 |
| [58] |
Zhang, Y.; Zhao, X.; Bi, C.; Lu, W.; Song, M.; Wang, D.; Qing, G. Green Chem. 2021, 23, 1691.
doi: 10.1039/D0GC03890C |
| [59] |
Sun, B.; Zheng, S.; Mo, F. Chem. Commun. 2021, 57, 5674.
doi: 10.1039/D1CC02134F |
| [60] |
Wang, Z.; Wang, M.; Gao, J.; Shi, S.; Xu, Y. Org. Chem. Front. 2019, 6, 2949.
doi: 10.1039/C9QO00750D |
| [61] |
Wang, G.; Miao, T. Chem.-Eur. J. 2011, 17, 5787.
doi: 10.1002/chem.v17.21 |
| [1] | 黄净, 杨毅华, 张占辉, 刘守信. 酰胺键的绿色高效构建方法与技术进展[J]. 有机化学, 2024, 44(2): 409-420. |
| [2] | 李思达, 崔鑫, 舒兴中, 吴立朋. 钛催化的烯烃制备1,1-二硼化合物[J]. 有机化学, 2024, 44(2): 631-637. |
| [3] | 张建涛, 张聪, 莫诺琳, 罗佳婷, 陈莲芬, 刘卫兵. 氯仿参与的烯烃自由基加成反应的研究进展[J]. 有机化学, 2023, 43(9): 3098-3106. |
| [4] | 岁丹丹, 岑南楠, 龚若蕖, 陈阳, 陈文博. 无支持电解质条件下连续流电化学合成三氟甲基化氧化吲哚[J]. 有机化学, 2023, 43(9): 3239-3245. |
| [5] | 贝文峰, 潘健, 冉冬梅, 刘伊琳, 杨震, 冯若昆. 基于钴催化吲哚酰胺与二炔和单炔的[4+2]环化反应合成γ-咔啉酮[J]. 有机化学, 2023, 43(9): 3226-3238. |
| [6] | 蒋宜欣, 唐伯孝, 毛海波, 陈雪霞, 俞洋杰, 全翠英, 徐昭阳, 石金慧, 刘益林. 水-聚乙二醇(PEG-200)中烯烃与碘代芳烃绿色可循环无负载偶联反应的研究[J]. 有机化学, 2023, 43(9): 3210-3215. |
| [7] | 张素珍, 张文文, 杨慧, 顾庆, 游书力. 铑催化2-烯基苯酚与炔烃的对映体选择性螺环化反应[J]. 有机化学, 2023, 43(8): 2926-2933. |
| [8] | 王莎, 陈常鹏, 曾小明. 联吡啶配体促进铬催化炔烃的顺式硼氢化反应[J]. 有机化学, 2023, 43(7): 2447-2453. |
| [9] | 马佳敏, 李姣兄, 孟千森, 曾祥华. 炔烃的自由基砜基化反应研究进展[J]. 有机化学, 2023, 43(6): 2040-2052. |
| [10] | 陆晓雨, 孙晓梅, 钮亚琴, 王俊超, 殷文婧, 高梦婷, 刘孜, 韦正桓, 陶庭骅. 铜催化氟代丙烯酸与氧杂吖丙啶的脱羧交叉偶联反应[J]. 有机化学, 2023, 43(6): 2110-2119. |
| [11] | 陈志豪, 范奇, 尹标林, 李清江, 王洪根. α-硼取代羰基类化合物的合成进展[J]. 有机化学, 2023, 43(5): 1706-1712. |
| [12] | 刘育园, 雷雅钦, 杨文, 赵万祥. 钴催化烯胺远程硼氢化[J]. 有机化学, 2023, 43(5): 1761-1771. |
| [13] | 李思达, 舒兴中, 吴立朋. 锆、钛介导的烯烃、炔烃硼氢化[J]. 有机化学, 2023, 43(5): 1751-1760. |
| [14] | 莫百川, 陈春霞, 彭进松. 木质素及其衍生物负载金属催化剂在有机合成中的应用研究进展[J]. 有机化学, 2023, 43(4): 1215-1240. |
| [15] | 窦谦, 汪太民, 房丽晶, 翟宏斌, 程斌. 光诱导铁催化在有机合成中的应用研究进展[J]. 有机化学, 2023, 43(4): 1386-1415. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||