有机化学 ›› 2023, Vol. 43 ›› Issue (8): 2926-2933.DOI: 10.6023/cjoc202303021 上一篇 下一篇
研究论文
张素珍a,b, 张文文b, 杨慧b, 顾庆b,*( ), 游书力b,*(
), 游书力b,*( )
)
收稿日期:2023-03-15
修回日期:2023-03-28
发布日期:2023-04-07
基金资助:
Suzhen Zhanga,b, Wenwen Zhangb, Hui Yangb, Qing Gub( ), Shuli Youb(
), Shuli Youb( )
)
Received:2023-03-15
Revised:2023-03-28
Published:2023-04-07
Contact:
*E-mail: Supported by:文章分享

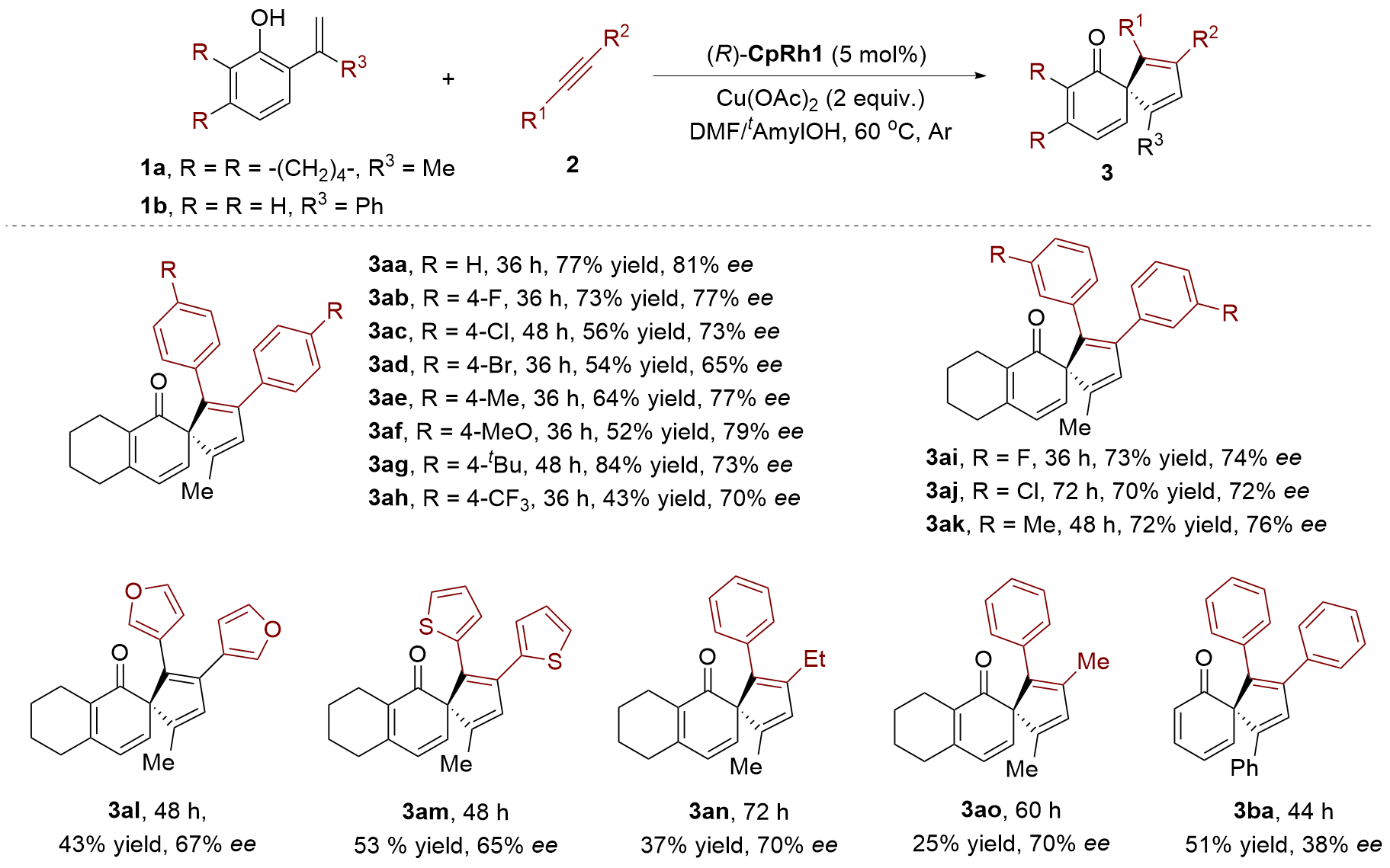
发展了铑催化2-烯基苯酚与炔烃的对映选择性螺环化反应. 在5 mol% 1,1'-联二萘酚(BINOL)衍生的环戊二烯铑络合物[(R)-CpRh1]和2 equiv.的醋酸铜存在下, C—H活化/螺环化反应可以高达84%收率和81% ee对映选择性获得手性螺环己烯酮化合物. 该反应条件温和, 具有良好的官能团耐受性.
张素珍, 张文文, 杨慧, 顾庆, 游书力. 铑催化2-烯基苯酚与炔烃的对映体选择性螺环化反应[J]. 有机化学, 2023, 43(8): 2926-2933.
Suzhen Zhang, Wenwen Zhang, Hui Yang, Qing Gu, Shuli You. Rhodium-Catalyzed Enantioselective Spiroannulation of 2-Alkenylphenols with Alkynes[J]. Chinese Journal of Organic Chemistry, 2023, 43(8): 2926-2933.
| Entry | [Rh] | Solvent | Yieldb/% | eec/% |
|---|---|---|---|---|
| 1 | (R)-CpRh1 | CH3CN | 48 | 74 |
| 2 | (R)-CpRh2 | CH3CN | 60 | 40 |
| 3 | (R)-CpRh3 | CH3CN | 50 | 60 |
| 4 | (R)-CpRh4 | CH3CN | 39 | 56 |
| 5 | (R)-CpRh5 | CH3CN | 8 | 39 |
| 6 | (S)-SCpRh1 | CH3CN | 18 | 54 |
| 7 | (S)-SCpRh2 | CH3CN | 60 | 38 |
| 8d | (R)-CpRh1 | CH3CN | 52 | 76 |
| 9d | (R)-CpRh1 | tAmylOH | 60 | 75 |
| 10d | (R)-CpRh1 | 1,4-Dioxane | 14 | 83 |
| 11d | (R)-CpRh1 | THF | 21 | 80 |
| 12d | (R)-CpRh1 | DMF | 31 | 70 |
| 13d | (R)-CpRh1 | 1,4-Dioxane/tAmylOH | 42 | 77 |
| 14d | (R)-CpRh1 | THF/tAmylOH | 52 | 76 |
| 15d | (R)-CpRh1 | DMF/tAmylOH | 81 (77e) | 81 |
| Entry | [Rh] | Solvent | Yieldb/% | eec/% |
|---|---|---|---|---|
| 1 | (R)-CpRh1 | CH3CN | 48 | 74 |
| 2 | (R)-CpRh2 | CH3CN | 60 | 40 |
| 3 | (R)-CpRh3 | CH3CN | 50 | 60 |
| 4 | (R)-CpRh4 | CH3CN | 39 | 56 |
| 5 | (R)-CpRh5 | CH3CN | 8 | 39 |
| 6 | (S)-SCpRh1 | CH3CN | 18 | 54 |
| 7 | (S)-SCpRh2 | CH3CN | 60 | 38 |
| 8d | (R)-CpRh1 | CH3CN | 52 | 76 |
| 9d | (R)-CpRh1 | tAmylOH | 60 | 75 |
| 10d | (R)-CpRh1 | 1,4-Dioxane | 14 | 83 |
| 11d | (R)-CpRh1 | THF | 21 | 80 |
| 12d | (R)-CpRh1 | DMF | 31 | 70 |
| 13d | (R)-CpRh1 | 1,4-Dioxane/tAmylOH | 42 | 77 |
| 14d | (R)-CpRh1 | THF/tAmylOH | 52 | 76 |
| 15d | (R)-CpRh1 | DMF/tAmylOH | 81 (77e) | 81 |

| [1] |
For reviews on transition-metal-catalyzed C—H activation/annul- ation reactions, see: (a) Satoh, T.; Miura, M. Chem.-Eur. J. 2010, 16, 11212.
doi: 10.1002/chem.v16:37 |
|
(b) Ackermann, L. Acc. Chem. Res. 2014, 47, 281.
doi: 10.1021/ar3002798 |
|
|
(c) Yang, Y.; Li, K.; Cheng, Y.; Wan, D.; Li, M.; You, J. Chem. Commun. 2016, 52, 2872.
doi: 10.1039/C5CC09180B |
|
|
(d) Duarah, G.; Kaishap, P. P.; Begum, T.; Gogoi, S. Adv. Synth. Catal. 2019, 361, 654.
doi: 10.1002/adsc.201800755 |
|
|
(d) Kuang, G.; Liu, G.; Zhang, X.; Lu, N.; Peng, Y.; Xiao, Q.; Zhou, Y. Synthesis 2020, 52, 993.
doi: 10.1055/s-0039-1690816 |
|
|
(e) Saha, A.; Shankar, M.; Sau, S.; Sahoo, A. K. Chem. Commun. 2022, 58, 4561.
doi: 10.1039/D2CC00172A |
|
|
Selected reviews on transition-metal-catalyzed C—H functionalizations, see: (f) Ji, Y.; Zhang, M.; Xing, M.; Cui, H.; Zhao, Q.; Zhang, C. Chin. J. Chem. 2021, 39, 391.
doi: 10.1002/cjoc.v39.2 |
|
|
(g) Liu, X.; Kuang, C.; Su, C. Acta Chim. Sinica 2022, 80, 1135. (in Chinese)
doi: 10.6023/A22040147 |
|
|
( 刘霞, 匡春香, 苏长会, 化学学报, 2022, 80, 1135.)
doi: 10.6023/A22040147 |
|
|
(h) Gu, H.; Jin, X.; Li, J.; Li, H.; Liu, J. Chin. J. Org. Chem. 2022, 42, 2682. (in Chinese)
doi: 10.6023/cjoc202204056 |
|
|
( 顾海春, 靳新新, 李嘉琪, 李贺, 刘景林, 有机化学, 2022, 42, 2682.)
doi: 10.6023/cjoc202204056 |
|
| [2] |
(a) Reddy Chidipudi, S.; Khan, I.; Lam, H. W. Angew. Chem., Int. Ed. 2012, 51, 12115.
doi: 10.1002/anie.201207170 |
|
(b) Dooley, J. D.; Reddy Chidipudi, S.; Lam, H. W. J. Am. Chem. Soc. 2013, 135, 10829.
doi: 10.1021/ja404867k |
|
|
(c) Reddy Chidipudi, S.; Burns, D. J.; Khan, I.; Lam, H. W. Angew. Chem., Int. Ed. 2015, 54, 13975.
doi: 10.1002/anie.v54.47 |
|
| [3] |
(a) Nan, J.; Zuo, Z.; Luo, L.; Bai, L.; Zheng, H.; Yuan, Y.; Liu, J.; Luan, X.; Wang, Y. J. Am. Chem. Soc. 2013, 135, 17306.
doi: 10.1021/ja410060e |
|
(b) Han, L.; Wang, H.; Luan, X. Org. Chem. Front. 2018, 5, 2453.
doi: 10.1039/C8QO00614H |
|
|
(c) Hao, J.; Ge, Y.; Yang, L.; Wang, J.; Luan, X. Tetrahedron Lett. 2021, 71, 153050.
doi: 10.1016/j.tetlet.2021.153050 |
|
|
(d) Li, K.; Bai, L.; Luan, X. Chin. J. Org. Chem. 2019, 39, 2211. (in Chinese)
doi: 10.6023/cjoc201903065 |
|
|
( 李锟雨, 白璐, 栾新军, 有机化学, 2019, 39, 2211.)
doi: 10.6023/cjoc201903065 |
|
|
(e) Li, H.; Cui, X. Chin. J. Org. Chem. 2020, 40, 543. (in Chinese)
doi: 10.6023/cjoc202000007 |
|
|
( 李欢, 崔秀灵, 有机化学, 2020, 40, 543.)
doi: 10.6023/cjoc202000007 |
|
| [4] |
(a) Zheng, J.; Wang, S.-B.; Zheng, C.; You, S.-L. J. Am. Chem. Soc. 2015, 137, 4880.
doi: 10.1021/jacs.5b01707 pmid: 25853771 |
|
(b) Zheng, C.; Zheng, J.; You, S.-L. ACS Catal. 2016, 6, 262.
doi: 10.1021/acscatal.5b01891 pmid: 25853771 |
|
| [5] |
Other examples of enantioselective C—H spiroannulation reactions with alkynes, see: (a) Zhang, M.; Huang, G. Chem. Eur. J. 2016, 22, 9356.
doi: 10.1002/chem.201600884 |
|
(b) Zheng, J.; Wang, S.-B.; Zheng, C.; You, S.-L. Angew. Chem., Int. Ed. 2017, 56, 4540.
doi: 10.1002/anie.201700021 |
|
|
(c) Duarah, G.; Kaishap, P. P.; Sarma, B.; Gogoi, S. Chem. Eur. J. 2018, 24, 10196.
doi: 10.1002/chem.v24.40 |
|
|
(d) Li, H.; Gontla, R.; Flegel, J.; Merten, C.; Ziegler, S.; Antonchick, A. P.; Waldmann, H. Angew. Chem., Int. Ed. 2019, 58, 307.
doi: 10.1002/anie.201811041 |
|
|
(e) Huang, Y.-Q.; Wu, Z.-J.; Zhu, L.; Gu, Q.; Lu, X.; You, S.-L.; Mei, T.-S. CCS Chem. 2022, 4, 3181.
doi: 10.31635/ccschem.021.202101376 |
|
|
(f) Wang, Y.; Huang, X.; Wang, Q.; Tang, Y.; Xu, S.; Li, Y. Org. Lett. 2021, 23, 757.
doi: 10.1021/acs.orglett.0c03982 |
|
|
(g) Wei, W.; Scheremetjew, A.; Ackermann, L. Chem. Sci. 2022, 13, 2783.
doi: 10.1039/D1SC07124F |
|
| [6] |
For C—H spiroannulation reactions of phenols with alkynes in a racemic manner, see: (a) Seoane, A.; Casanova, N.; Quinones, N.; Mascareñas, J. L.; Gulias, M. J. Am. Chem. Soc. 2014, 136, 7607.
doi: 10.1021/ja5034952 |
|
(b) Kujawa, S.; Best, D.; Burns, D. J.; Lam, H. W. Chem. Eur. J. 2014, 20, 8599.
doi: 10.1002/chem.201403454 |
|
|
(c) Zuo, Z.; Yang, X.; Liu, J.; Nan, J.; Bai, L.; Wang, Y.; Luan, X. J. Org. Chem. 2015, 80, 3349.
doi: 10.1021/acs.joc.5b00316 |
|
|
(d) Lin, P.-P.; Han, X.-L.; Ye, G.-H.; Li, J.-L.; Li, Q.; Wang, H. J. Org. Chem. 2019, 84, 12966.
doi: 10.1021/acs.joc.9b01750 |
|
|
(e) Liu, A.; Han, K.; Wu, X.-X.; Chen, S.; Wang, J. Chin. J. Chem. 2020, 38, 1257.
doi: 10.1002/cjoc.v38.11 |
|
|
(f) Liu, T.; Han, L.; Zhang, J.; Lu, G. J. Org. Chem. 2021, 86, 10484.
|
|
| [7] |
(a) Pettus, T. R. R.; Inoue, M.; Chen, X.-T.; Danishefsky, S. J. J. Am. Chem. Soc. 2000, 122, 6160.
doi: 10.1021/ja000521m pmid: 31008606 |
|
(b) Zhan, Z.-J.; Li, C.-P.; Shan, W.-G. J. Chem. Res. 2007, 1, 38.
pmid: 31008606 |
|
|
(c) Saito, Y.; Takashima, Y.; Kamada, A.; Suzuki, Y.; Suenaga, M.; Okamoto, Y.; Matsunaga, Y.; Hanai, R.; Kawahara, T.; Gong, X.; Tori, M.; Kuroda, C. Tetrahedron 2012, 68, 10011.
doi: 10.1016/j.tet.2012.09.042 pmid: 31008606 |
|
|
(d) Sandargo, B.; Michehl, M.; Praditya, D.; Steinmann, E.; Stadler, M.; Surup, F. Org. Lett. 2019, 21, 3286.
doi: 10.1021/acs.orglett.9b01017 pmid: 31008606 |
|
| [8] |
For selected reviews on Rh-catalyzed C—H functionalizations, see: (a) Ye, B.; Cramer, N. Acc. Chem. Res. 2015, 48, 1308.
doi: 10.1021/acs.accounts.5b00092 |
|
(b) Yoshino, T.; Satake, S.; Matsunaga, S. Chem. Eur. J. 2020, 26, 7346.
doi: 10.1002/chem.v26.33 |
|
|
(c) Shaaban, S.; Davies, C.; Waldmann, H. Eur. J. Org. Chem. 2020, 6512.
|
|
|
(d) Mas-Rosello, J.; Herraiz, A. G.; Audic, B.; Laverny, A.; Cramer, N. Angew. Chem., Int. Ed. 2021, 60, 13198.
doi: 10.1002/anie.v60.24 |
|
|
(e) Davies, C.; Shaaban, S.; Waldmann, H. Trends Chem. 2022, 4, 318.
doi: 10.1016/j.trechm.2022.01.005 |
|
| [9] |
(a) Ye, B.; Cramer, N. Science 2012, 338, 504.
doi: 10.1126/science.1226938 pmid: 27070297 |
|
(b) Ye, B.; Cramer, N. J. Am. Chem. Soc. 2013, 135, 636.
doi: 10.1021/ja311956k pmid: 27070297 |
|
|
(c) Zheng, J.; Cui, W.-J.; Zheng, C.; You, S.-L. J. Am. Chem. Soc. 2016, 138, 5242.
doi: 10.1021/jacs.6b02302 pmid: 27070297 |
| [1] | 贝文峰, 潘健, 冉冬梅, 刘伊琳, 杨震, 冯若昆. 基于钴催化吲哚酰胺与二炔和单炔的[4+2]环化反应合成γ-咔啉酮[J]. 有机化学, 2023, 43(9): 3226-3238. |
| [2] | 卢凯, 屈浩琦, 陈樨, 秋慧, 郑晶, 马猛涛. 无催化剂、无溶剂条件下炔烃和烯烃与儿茶酚硼烷的硼氢化反应[J]. 有机化学, 2023, 43(6): 2197-2205. |
| [3] | 马佳敏, 李姣兄, 孟千森, 曾祥华. 炔烃的自由基砜基化反应研究进展[J]. 有机化学, 2023, 43(6): 2040-2052. |
| [4] | 陈志豪, 范奇, 尹标林, 李清江, 王洪根. α-硼取代羰基类化合物的合成进展[J]. 有机化学, 2023, 43(5): 1706-1712. |
| [5] | 李思达, 舒兴中, 吴立朋. 锆、钛介导的烯烃、炔烃硼氢化[J]. 有机化学, 2023, 43(5): 1751-1760. |
| [6] | 高师泉, 刘闯军, 杨俊锋, 张俊良. 钴催化的烯烃和炔烃的电化学还原偶联反应[J]. 有机化学, 2023, 43(4): 1559-1565. |
| [7] | 刘鹏, 钟富明, 廖礼豪, 谭伟强, 赵晓丹. 炔烃参与的去芳构化反应构建螺环己二烯酮类化合物的研究进展[J]. 有机化学, 2023, 43(12): 4019-4035. |
| [8] | 田冲, 孙奇, 王俊锋, 陈俏, 温志国, Maxim Borzov, 聂万丽. 卤素阴离子催化的立体可控炔烃碳硼化反应研究[J]. 有机化学, 2023, 43(1): 338-344. |
| [9] | 刘浩阳, 孙爽爽, 马献力, 陈艳艳, 徐燕丽. 可见光促进异腈插入反应合成硒代螺环[吲哚-3,3'-喹啉]衍生物[J]. 有机化学, 2022, 42(9): 2867-2876. |
| [10] | 孙奇, 孙泽颖, 俞泽, 王光伟. 镍催化炔烃的立体选择性芳基-二氟烷基化反应[J]. 有机化学, 2022, 42(8): 2515-2520. |
| [11] | 刘会丽, 朱超杰, 唐天地. 酸性沸石HBeta催化的傅克烯基化反应[J]. 有机化学, 2022, 42(6): 1792-1798. |
| [12] | 洪科苗, 黄晶晶, 姚铭瀚, 徐新芳. 氮宾/炔烃复分解串联反应研究进展[J]. 有机化学, 2022, 42(2): 344-352. |
| [13] | 郑煜, 钱沈城, 徐鹏程, 郑斌南, 黄申林. 电化学氧化芳基端炔的硫氰化磺化反应[J]. 有机化学, 2022, 42(12): 4275-4281. |
| [14] | 李秀英, 陶萍芳, 程泳渝, 胡琼, 黄伟娟, 李芸, 罗志辉, 黄国保. 电化学促进的烯烃和炔烃双官能团化反应研究进展[J]. 有机化学, 2022, 42(12): 4169-4201. |
| [15] | 徐磊, 王方, 陈凡, 朱圣卿, 储玲玲. 可见光/镍协同催化烯烃和炔烃双官能团化反应研究进展[J]. 有机化学, 2022, 42(1): 1-15. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||