平面构型的铂(II)配合物拥有独特而丰富的光谱特性, 它在可见光区呈现出灵活可调的发光颜色
[1], 同时拥有长激发态寿命
[2]和室温磷光(RTP)特性
[3-4]. 这些卓越的光学性质使其在众多领域得到广泛应用, 可以应用于生物探针
[5]、发光传感器
[6]、光催化合成
[7]及磷光染料
[8]等领域. 铂(II)配合物为d
8电子构型, 其d轨道发生简并后与配体进行配位反应, 生成的配合物展现出独特的光物理性质, 主要存在以下三类电子跃迁方式: (1)
3IL跃迁(配体分子内部); (2)
3MLCT跃迁(Pt[π]→[π*]跃迁); (3)
3LLCT跃迁[π(C≡C)→π*(L)]
[9]. 除此之外, 当配合物之间处于较近的距离时, 还可能发生Pt…Pt到配体的跃迁方式, 用
3MMLCT (dσ*→π*)表示
[10].
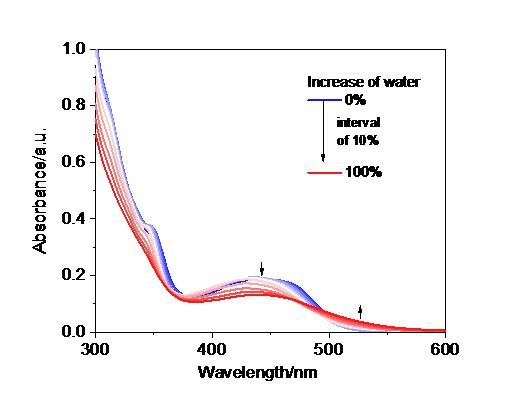
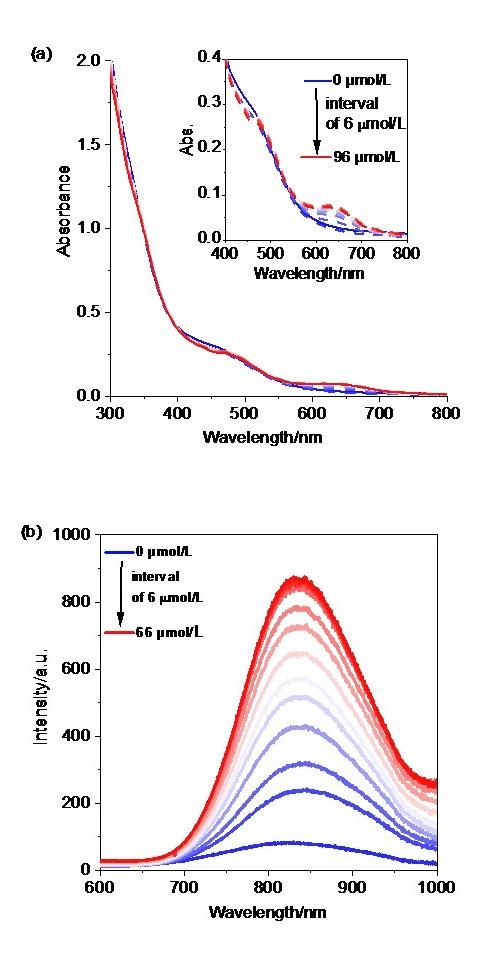
3MMLCT的磷光发射对分子排列方式要求较高. 一般只有在金属间距离小于0.34 nm时, 铂(Ⅱ)配合物分子间才会存在Pt…Pt和π-π作用, 产生一个独特的
3MMLCT发射
[11-12]. 因此, 早期人们只在固体中观测到这种磷光发射
[13-14], 低浓度的溶液中几乎不存在. 随着科学研究的发展, 不少科学家通过一些手段实现了溶液中的
3MMLCT磷光发射
[15-23]. 比如: Yam课题组
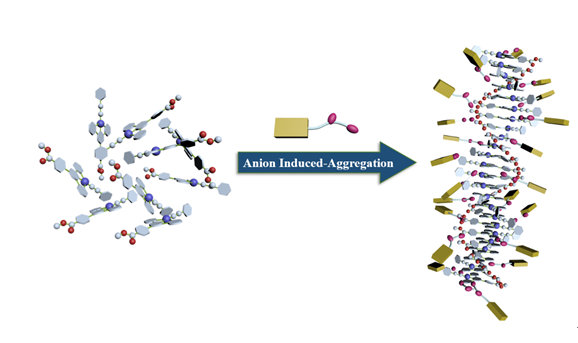
[22]采用不良溶剂调控的手段, 实现了不同构型铂(II)配合物的聚集, 观测到不同颜色的
3MMLCT发射. 此外, Yam 等
[23]还报道了在溶剂中添加抗衡离子聚合物, 诱导配合物在聚合物周围形成有序的聚集体, 并观测到其独特的
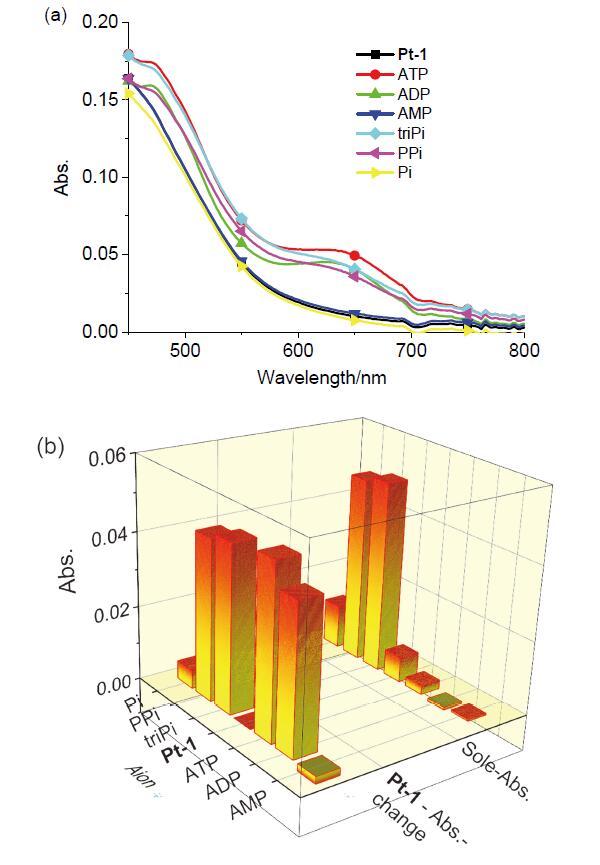
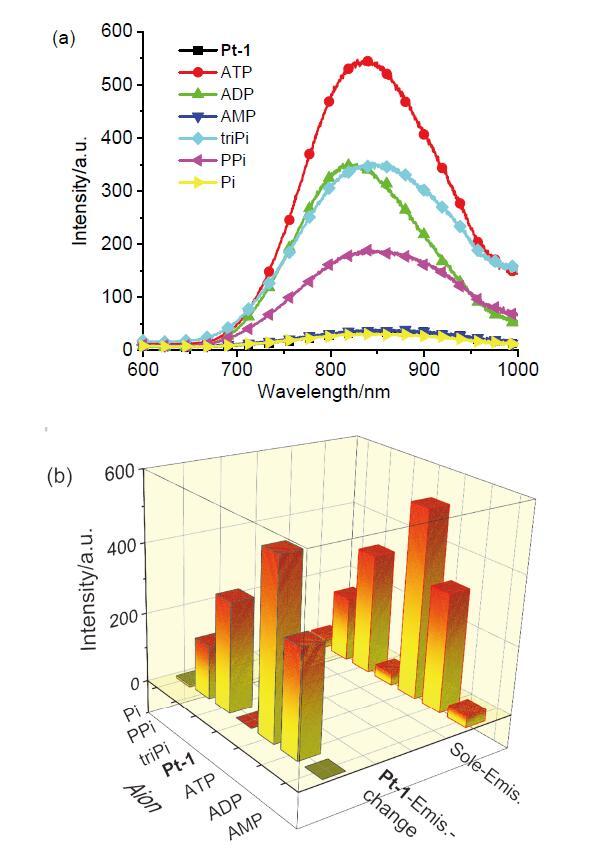
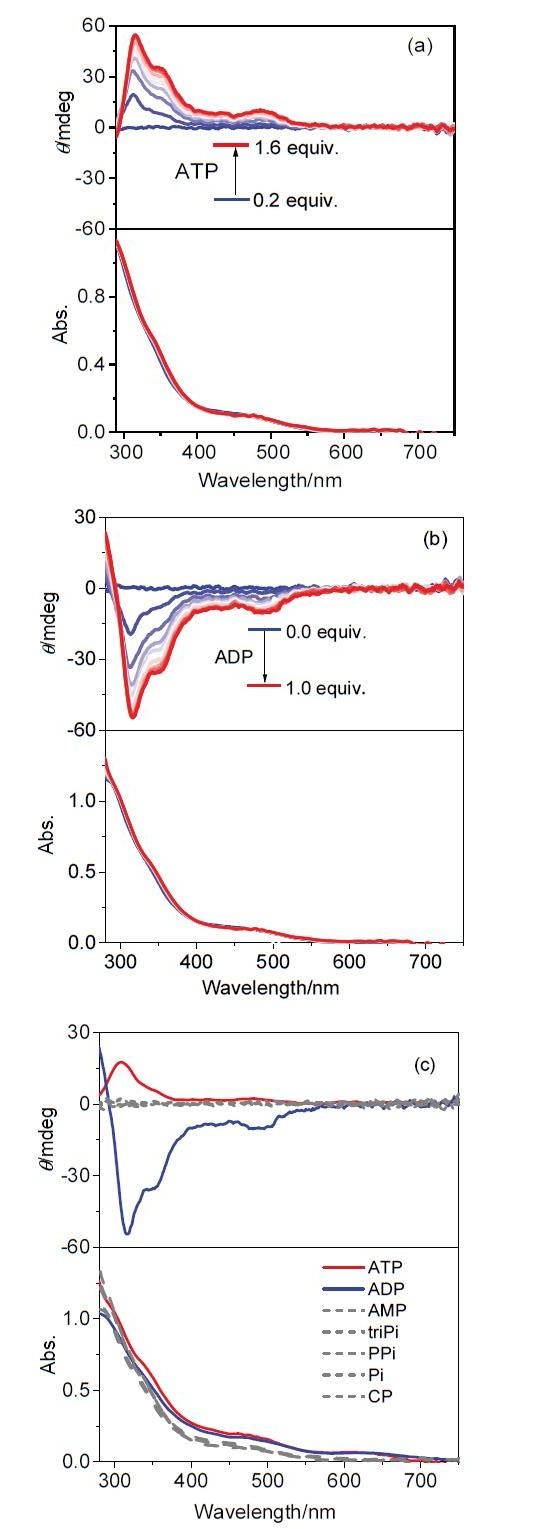
3MMLCT发光, 但关于小分子诱导铂(II)配合物聚集的报道甚少. 核苷酸结构由一个五碳糖、疏水的氮碱基和带负电荷的磷酸基团组成(
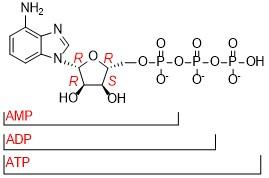
Scheme 1), 其中腺苷酸三磷酸盐(ATP)、腺苷酸二磷酸盐(ADP)和腺苷酸单磷酸盐(AMP)是非常重要的核苷酸, 在细胞水平的新陈代谢过程中起着非常基础且决定性的作用, 参与细胞信号传输与转运、离子通道的调制以及遗传信息的转达等重要生命过程
[24]. ATP是活细胞体内的能量提供者, 提供的能量供细胞完成各项生命活动后, 转变为其前体ADP和/或AMP, 即三种核苷酸在细胞活动过程中相互转化, 了解各个核苷酸的量对于深入理解细胞水平的新陈代谢过程具有至关重要的作用. 然而, ATP、ADP和AMP三者结构极其相似, 这也对三者的检测方法要求更高. 目前, 主要检测手段分为以下两种: (1) HPLC分析法
[25-26]:
通过三个分子在HPLC中不同的保留时间进行区分, 但这种方法对于仪器和分离制备柱的要求较高, 分离条件苛刻, 成本昂贵; (2)荧光探针法
[27-32]: 通过分子探针与三个分子间存在不同的结合力, 在光谱中产生的不同信号进行区分. 但目前关于ATP、AMP等磷酸衍生物中ADP特异性分子探针的研究报道相对较少, 由于荧光探针具有成本较低、响应性好等优点成为新型物质分析鉴定的方法
[33-36]. 因此如何高效区分三种核苷酸具有重要的研究意义.
超分子作用依赖于氢键
[37]、静电作用
[38]、π-π堆积
[39]等弱相互作用, 具有动态可逆
[40]、多功能化
[41]以及刺激响应
[42]的特点, 这些特点允许超分子体系在微小的刺激下产生大的信号相应. 将发光分子与超分子体系结合, 借助超分子体系高度的可设计性, 通过调节分子结构、组装方式以及其他外部刺激能够实现发光体系的多重刺激响应以及更多样的识别能力
[43-45].