有机化学 ›› 2021, Vol. 41 ›› Issue (1): 357-363.DOI: 10.6023/cjoc202006027 上一篇 下一篇
研究论文
肖钤a, 臧沈荦a, 陈泽卫b, 姚薇薇b,*( ), 郑晶a,*(
), 郑晶a,*( ), 马猛涛a,*(
), 马猛涛a,*( )
)
收稿日期:2020-06-15
修回日期:2020-07-26
发布日期:2020-08-19
通讯作者:
姚薇薇, 郑晶, 马猛涛
作者简介:
基金资助:
Qian Xiaoa, Shenluo Zanga, Zewei Chenb, Weiwei Yaob,*( ), Jing Zhenga,*(
), Jing Zhenga,*( ), Mengtao Maa,*(
), Mengtao Maa,*( )
)
Received:2020-06-15
Revised:2020-07-26
Published:2020-08-19
Contact:
Weiwei Yao, Jing Zheng, Mengtao Ma
Supported by:文章分享
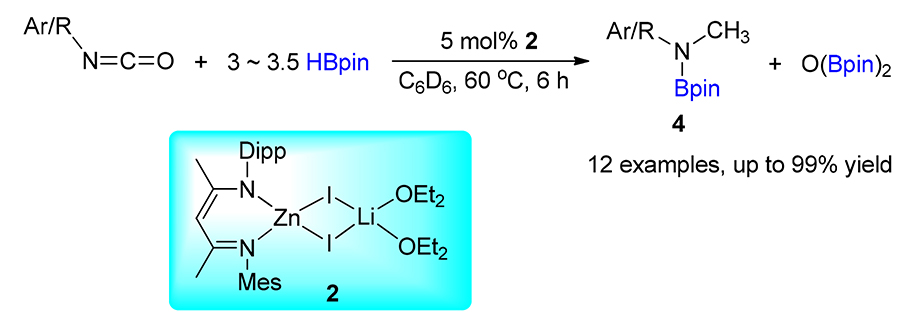
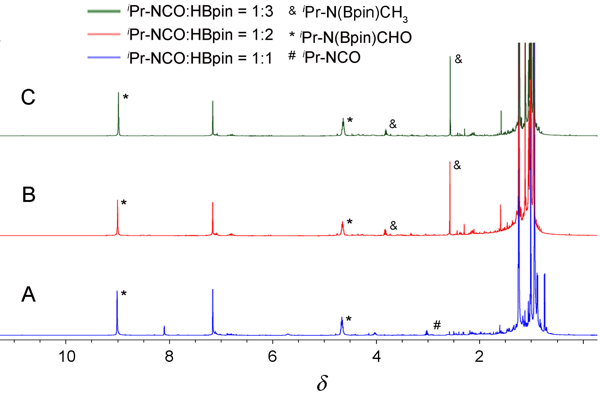
有关异腈酸酯硼氢化反应的报道极其稀少, 迄今为止, 锌金属化合物催化的异腈酸酯硼氢化反应尚未见报道. 介绍了一种结构新颖的不对称 β-二亚胺锌-锂双金属化合物的合成方法, 并将其作为高效催化剂成功应用于一系列带有不同官能团的异腈酸酯和频哪醇硼烷的硼氢化反应中, 同时对硼氢化反应机理进行了初步探索.
肖钤, 臧沈荦, 陈泽卫, 姚薇薇, 郑晶, 马猛涛. 锌-锂双金属化合物的合成及其在异腈酸酯硼氢化中的催化应用[J]. 有机化学, 2021, 41(1): 357-363.
Qian Xiao, Shenluo Zang, Zewei Chen, Weiwei Yao, Jing Zheng, Mengtao Ma. Synthesis of Zn-Li Bimetallic Compound and Its Catalytic Application in Hydroboration of Isocyanate[J]. Chinese Journal of Organic Chemistry, 2021, 41(1): 357-363.
| Zn(1)–N(1) | 0.1976(2) | Zn (1)–N(2) | 0.1979(3) |
|---|---|---|---|
| Zn(1)–I(1) | 0.2592(4) | Zn (1)–I(2) | 0.2660(4) |
| Li(1)–I(1) | 0.2872(6) | Li(1)–I(2) | 0.2800(6) |
| Li(1)–O(1) | 0.1927(7) | Li(1)–O(2) | 0.1910(7) |
| N(1)–Zn(1)–N(2) | 98.21(11) | I(1)–Zn(1)–I(2) | 102.42(15) |
| N(1)–Zn(1)–I(1) | 115.43(7) | N(1)–Zn(1)–I(2) | 112.78(7) |
| N(2)–Zn(1)–I(1) | 122.50(7) | N(2)–Zn(1)–I(2) | 105.50(7) |
| Zn(1)–I(1)–Li(1) | 80.33(13) | Zn(1)–I(2)–Li(1) | 80.53(12) |
| I(1)–Li(1)–I(2) | 92.39(18) | O(1)–Li(1)–O(2) | 109.40(3) |
| I(1)–Li(1)–O(1) | 121.90(3) | I(1)–Li(1)–O(2) | 108.20(3) |
| I(2)–Li(1)–O(1) | 108.20(3) | I(2)–Li(1)–O(2) | 116.40(3) |
| Zn(1)–N(1) | 0.1976(2) | Zn (1)–N(2) | 0.1979(3) |
|---|---|---|---|
| Zn(1)–I(1) | 0.2592(4) | Zn (1)–I(2) | 0.2660(4) |
| Li(1)–I(1) | 0.2872(6) | Li(1)–I(2) | 0.2800(6) |
| Li(1)–O(1) | 0.1927(7) | Li(1)–O(2) | 0.1910(7) |
| N(1)–Zn(1)–N(2) | 98.21(11) | I(1)–Zn(1)–I(2) | 102.42(15) |
| N(1)–Zn(1)–I(1) | 115.43(7) | N(1)–Zn(1)–I(2) | 112.78(7) |
| N(2)–Zn(1)–I(1) | 122.50(7) | N(2)–Zn(1)–I(2) | 105.50(7) |
| Zn(1)–I(1)–Li(1) | 80.33(13) | Zn(1)–I(2)–Li(1) | 80.53(12) |
| I(1)–Li(1)–I(2) | 92.39(18) | O(1)–Li(1)–O(2) | 109.40(3) |
| I(1)–Li(1)–O(1) | 121.90(3) | I(1)–Li(1)–O(2) | 108.20(3) |
| I(2)–Li(1)–O(1) | 108.20(3) | I(2)–Li(1)–O(2) | 116.40(3) |
| Zn(1)–N(1) | 0.2031(18) | Zn(1)–N(2) | 0.2033(17) |
|---|---|---|---|
| Zn(1)–N(3) | 0.2017(17) | Zn (1)–N(4) | 0.2051(17) |
| N(1)–Zn(1)–N(2) | 94.71(7) | N(1)–Zn(1)–N(3) | 113.49(7) |
| N(1)–Zn(1)–N(4) | 114.80(7) | N(2)–Zn(1)–N(3) | 124.91(7) |
| N(2)–Zn(1)–N(4) | 115.96(7) | N(3)–Zn(1)–N(4) | 94.43(7) |
| Zn(1)–N(1) | 0.2031(18) | Zn(1)–N(2) | 0.2033(17) |
|---|---|---|---|
| Zn(1)–N(3) | 0.2017(17) | Zn (1)–N(4) | 0.2051(17) |
| N(1)–Zn(1)–N(2) | 94.71(7) | N(1)–Zn(1)–N(3) | 113.49(7) |
| N(1)–Zn(1)–N(4) | 114.80(7) | N(2)–Zn(1)–N(3) | 124.91(7) |
| N(2)–Zn(1)–N(4) | 115.96(7) | N(3)–Zn(1)–N(4) | 94.43(7) |
| Compd. | 2 | 3 |
|---|---|---|
| Formula | C 34H 55I 2LiN 2O 2Zn | C 107H 147N 8Zn 2 |
| M r | 849.91 | 1676.11 |
| Temp./K | 130(2) | 120(2) |
| λ/nm | 0.071073 | 0.071073 |
| Crystal system | Monoclinic | Monoclinic |
| Space group | P2 1/ c | P2 1/ n |
| a/nm | 1.15779(9) | 1.08285(4) |
| b/nm | 3.0070(2) | 2.17902(8) |
| c/nm | 1.24889(9) | 4.01324(15) |
| α/(°) | 90 | 90 |
| β/(°) | 116.076(2) | 95.7710(10) |
| γ/(°) | 90 | 90 |
| V/nm 3 | 3.9054(5) | 9.4215(6) |
| Z | 4 | 4 |
| ρ calc/(g•cm –3) | 1.446 | 1.182 |
| μ/mm –1 | 2.238 | 0.560 |
| F(000) | 1712 | 3620 |
| R 1(obs. data) | 0.0289 | 0.0384 |
| wR 2(obs. data) | 0.0629 | 0.0866 |
| GOF on F 2 | 1.094 | 1.030 |
| CCDC | 2008454 | 2008455 |
| Compd. | 2 | 3 |
|---|---|---|
| Formula | C 34H 55I 2LiN 2O 2Zn | C 107H 147N 8Zn 2 |
| M r | 849.91 | 1676.11 |
| Temp./K | 130(2) | 120(2) |
| λ/nm | 0.071073 | 0.071073 |
| Crystal system | Monoclinic | Monoclinic |
| Space group | P2 1/ c | P2 1/ n |
| a/nm | 1.15779(9) | 1.08285(4) |
| b/nm | 3.0070(2) | 2.17902(8) |
| c/nm | 1.24889(9) | 4.01324(15) |
| α/(°) | 90 | 90 |
| β/(°) | 116.076(2) | 95.7710(10) |
| γ/(°) | 90 | 90 |
| V/nm 3 | 3.9054(5) | 9.4215(6) |
| Z | 4 | 4 |
| ρ calc/(g•cm –3) | 1.446 | 1.182 |
| μ/mm –1 | 2.238 | 0.560 |
| F(000) | 1712 | 3620 |
| R 1(obs. data) | 0.0289 | 0.0384 |
| wR 2(obs. data) | 0.0629 | 0.0866 |
| GOF on F 2 | 1.094 | 1.030 |
| CCDC | 2008454 | 2008455 |
| Entry | Cat./mol% | n | Temp./℃ | Time/h | Yield a /% |
|---|---|---|---|---|---|
| 1 | 0 | 3 | 25 | 12 | 0 |
| 2 | 0 | 3 | 60 | 12 | 0 |
| 3 | 5 | 3 | 25 | 24 | 23 |
| 4 | 5 | 3 | 60 | 12 | 93 |
| 5 | 10 | 3 | 60 | 12 | 95 |
| 6 | 5 | 3 | 60 | 6 | 70 |
| 7 | 5 | 3.5 | 60 | 6 | 99 |
| Entry | Cat./mol% | n | Temp./℃ | Time/h | Yield a /% |
|---|---|---|---|---|---|
| 1 | 0 | 3 | 25 | 12 | 0 |
| 2 | 0 | 3 | 60 | 12 | 0 |
| 3 | 5 | 3 | 25 | 24 | 23 |
| 4 | 5 | 3 | 60 | 12 | 93 |
| 5 | 10 | 3 | 60 | 12 | 95 |
| 6 | 5 | 3 | 60 | 6 | 70 |
| 7 | 5 | 3.5 | 60 | 6 | 99 |
| Entry | Ar/R | Product | Yield a /% | Entry | Ar/R | Product | Yield a /% |
|---|---|---|---|---|---|---|---|
| 1 b | i Pr | | 99 | 2 b | Et | | 99 |
| 3 b | n Pr | | 99 | 4 b | n Bu | | 99 |
| 5 b | t Bu | | 95 | 6 b | Ad | | 99 |
| 7 c | | | 94 | 8 c | | | 93 |
| 9 c | | | 99 | 10 c | | | 99 |
| 11 c | | | 99 | 12 c | | | 99 |
| Entry | Ar/R | Product | Yield a /% | Entry | Ar/R | Product | Yield a /% |
|---|---|---|---|---|---|---|---|
| 1 b | i Pr | | 99 | 2 b | Et | | 99 |
| 3 b | n Pr | | 99 | 4 b | n Bu | | 99 |
| 5 b | t Bu | | 95 | 6 b | Ad | | 99 |
| 7 c | | | 94 | 8 c | | | 93 |
| 9 c | | | 99 | 10 c | | | 99 |
| 11 c | | | 99 | 12 c | | | 99 |
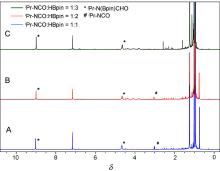
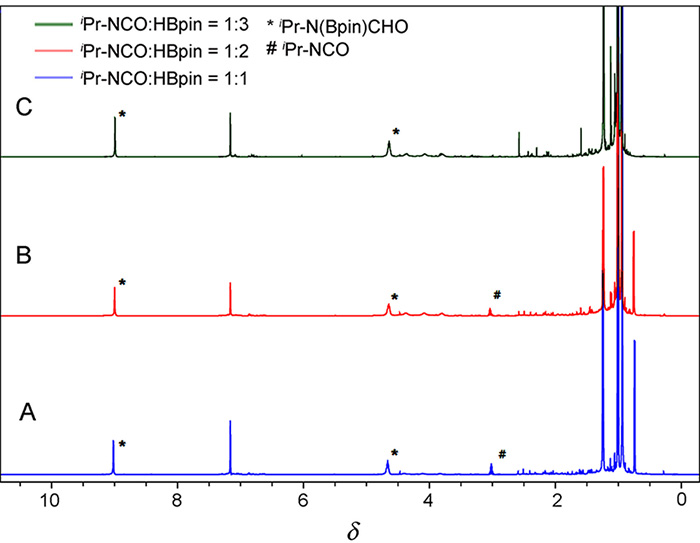
| [1] |
Bravo-Zhivotovskii D.; Yuzefovich M.; Bendikov M.; Klink- hammer K.; Apeloig Y. Angew. Chem., Int. Ed. 1999, 38, 1100.
|
| [2] |
Resa I.; Carmona E.; Gutierrez-Puebla E.; Monge A. Science 2004, 305, 1136.
|
| [3] |
Del Río, D.; Galindo, A.; Resa, I.; Carmona, E. Angew. Chem., Int. Ed. 2005, 44, 1244.
|
| [4] |
Li T.; Schulz S.; Roesky P.W. Chem. Soc. Rev. 2012, 41, 3759.
|
| [5] |
Cao C.; Shi Y.; Xu H.; Zhao B. Coord. Chem. Rev. 2018, 365, 122.
|
| [6] |
Chen M.; Jiang S.; Maron L.; Xu X. Dalton Trans. 2019 48, 1931.
|
| [7] |
Freitag K.; Banh H.; Ganesamoorthy C.; Gemel C.; Seidel R.W.; Fischer R.A. Dalton Trans. 2013, 42, 10540.
|
| [8] |
Bollermann T.; Gemel C.; Fischer R.A. Coord. Chem. Rev. 2012, 256, 537.
|
| [9] |
Lühl A.; Pada N.H.; Blechert S.; Roesky P.W. Chem. Commun. 2011, 47, 8280.
|
| [10] |
Lühl A.; Hartenstein L.; Blechert S.; Roesky P.W. Organometallics 2012, 31, 7109.
|
| [11] |
Chong C.C.; Kinjo R. ACS Catal. 2015, 5, 3238.
|
| [12] |
Yoshida H. ACS Catal. 2016, 6, 1799.
|
| [13] |
Luo M.; Zang S.; Yao W.; Zheng J.; Ma M. Sci. Sin. Chim. 2020, 50, 639.
|
| [14] |
Zhou N.; Yuan X.; Zhao Y.; Xie J.; Zhu C. Angew. Chem., Int. Ed. 2018, 57, 3990.
|
| [15] |
Shimoi M.; Watanabe T.; Maeda K.; Curran D.P.; Taniguchi T. Angew. Chem., Int. Ed. 2018, 57, 9485.
|
| [16] |
Ren S.; Zhang F.; Xu A.; Yang Y.; Zheng M.; Zhou X.; Fu Y.; Wang Y. Nat. Commun. 2019, 10, 1934.
|
| [17] |
Huang Y.; Wang J.; Zheng W.; Zhang F.; Yu Y.; Zheng M.; Zhou X.; Wang Y.Chem. Commun. 2019, 55, 11904.
|
| [18] |
Li T.; Zhang J.; Cui C. Chin. J. Chem. 2019, 37, 679.
|
| [19] |
Xu X.; Kang Z.; Yan D.; Xue M. Chin. J. Chem. 2019, 37, 1142.
|
| [20] |
Liu X.; Zhu Q.; Chen D.; Wang L.; Jin L.; Liu C. Angew. Chem., Int. Ed. 2020, 59, 2745.
|
| [21] |
Tamang S.R.; Singh A.; Bedi D.; Bazkiaei A.R.; Warner A.A.; Glogau K.; Mcdonald C.; Unruh D.K.; Findlater M. Nat. Catal. 2020, 3, 154.
|
| [22] |
Mcquilken A.C.; Dao Q.M.; Cardenas A.J.P.; Bertke J.A.; Grimme S.; Warren T.H. Angew. Chem. Int. Ed. 2016, 55, 14335.
|
| [23] |
Mukherjee D.; Shirase S.; Spaniol T.P.; Mashima K.; Okuda J. Chem. Commun. 2016, 52, 13155.
|
| [24] |
Yang Y.; Anker M.D.; Fang J.; Mahon M.F.; Maron L.; Weetman C.; Hill M.S. Chem. Sci. 2017, 8, 3529.
|
| [25] |
Solé C.; Fernández E. Angew. Chem., Int. Ed. 2013, 52, 11351.
|
| [26] |
Li J.; Luo M.; Sheng X.; Hua H.; Yao W.; Pullarkat S.A.; Xu L.; Ma M. Org. Chem. Front. 2018, 5, 3538.
|
| [27] |
Prust J.; Most K.; Müller I.; Stasch A.; Roesky H.W.; Usón I. Eur. J. Inorg. Chem. 2001, 1613.
|
| [28] |
Spielmann J.; Piesik D.; Wittkamp B.; Jansen G.; Harder S. Chem. Commun. 2009, 23, 3455.
|
| [29] |
Lummis P.A.; Momeni M.R.; Lui M.W.; Mcdonald R.; Ferguson M.J.; Miskolzie M.; Brown A.; Rivard E. Angew. Chem., Int. Ed. 2014, 53, 9347.
|
| [30] |
Gong S.; Ma H. Dalton Trans. 2008, 25, 3345.
|
| [1] | 冯康博, 陈炯, 古双喜, 王海峰, 陈芬儿. 全连续流反应技术在药物合成中的新进展(2019~2022)[J]. 有机化学, 2024, 44(2): 378-397. |
| [2] | 李鹏辉, 谢青洋, 万福贤, 张元红, 姜林. 含环丙基的新型取代嘧啶-5-甲酰胺的合成及杀菌活性研究[J]. 有机化学, 2024, 44(2): 650-656. |
| [3] | 邹发凯, 王能中, 姚辉, 王慧, 刘明国, 黄年玉. 1β-/3R-芳基硫代糖的区域与立体选择性合成[J]. 有机化学, 2024, 44(2): 593-604. |
| [4] | 李路瑶, 贺忠文, 张振国, 贾振华, 罗德平. 三芳基碳正离子在有机合成中的应用[J]. 有机化学, 2024, 44(2): 421-437. |
| [5] | 梅青刚, 李清寒. 可见光促进C(3)(杂)芳硫基吲哚化合物的合成研究进展[J]. 有机化学, 2024, 44(2): 398-408. |
| [6] | 赵茜帆, 陈永正, 张世明. 碳基非金属催化剂在有机合成领域的应用及机理研究[J]. 有机化学, 2024, 44(1): 137-147. |
| [7] | 陈珊, 陈志林, 胡琼, 蒙艳双, 黄悦, 陶萍芳, 卢丽如, 黄国保. 含双硫脲基团分子钳在非极性溶剂中识别中性分子[J]. 有机化学, 2024, 44(1): 277-281. |
| [8] | 王化坤, 任晓龙, 宣宜宁. 卤盐催化的α,β-环氧羧酸酯与异氰酸酯[3+2]环加成反应研究[J]. 有机化学, 2024, 44(1): 251-258. |
| [9] | 金玉坤, 任保轶, 梁福顺. 可见光介导的三氟甲基的选择性C-F键断裂及其在偕二氟类化合物合成中的应用[J]. 有机化学, 2024, 44(1): 85-110. |
| [10] | 马翠云, 罗海澜, 张福华, 郭丹, 陈树兴, 王飞. 3-Pyrrolyl BODIPY的绿色生物合成、光物理性质及应用研究[J]. 有机化学, 2024, 44(1): 216-223. |
| [11] | 王博珍, 张婕, 粘春惠, 金茗茗, 孔苗苗, 李物兰, 何文斐, 吴建章. 含有3,4-二氯苯基的酰胺类化合物的合成及抗肿瘤活性研究[J]. 有机化学, 2024, 44(1): 232-241. |
| [12] | 杨维清, 葛宴兵, 陈元元, 刘萍, 付海燕, 马梦林. 1,8-萘酰亚胺衍生物的设计、合成及其对半胱氨酸的识别研究[J]. 有机化学, 2024, 44(1): 180-194. |
| [13] | 于士航, 刘嘉威, 安碧玉, 边庆花, 王敏, 钟江春. 黑腹尼虎天牛接触性信息素的不对称合成[J]. 有机化学, 2024, 44(1): 301-308. |
| [14] | 岁丹丹, 岑南楠, 龚若蕖, 陈阳, 陈文博. 无支持电解质条件下连续流电化学合成三氟甲基化氧化吲哚[J]. 有机化学, 2023, 43(9): 3239-3245. |
| [15] | 李阳, 袁锦鼎, 赵頔. 低共熔溶剂1,3-二甲基脲/L-(+)-酒石酸中(E)-2-苯乙烯基喹啉-3-羧酸类衍生物的绿色合成[J]. 有机化学, 2023, 43(9): 3268-3276. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||