化学学报 ›› 2019, Vol. 77 ›› Issue (9): 794-802.DOI: 10.6023/A19050179 上一篇 下一篇
所属专题: 有机自由基化学
研究展望
投稿日期:2019-05-14
发布日期:2019-06-04
通讯作者:
左智伟
E-mail:zuozhw@shanghaitech.edu.cn
作者简介:陈奕霖, 上海科技大学2014级在读硕博生. 本科毕业于大连海事大学, 现主要从事光催化合成方法学研究.|常亮, 上海科技大学博士后, 2018年7月于法国索邦大学获博士学位, 同年10月加入上海科技大学左智伟教授课题组, 现主要从事廉价光催化剂的研究.
基金资助:
Chen, Yilin, Chang, Liang, Zuo, Zhiwei*( )
)
Received:2019-05-14
Published:2019-06-04
Contact:
Zuo, Zhiwei
E-mail:zuozhw@shanghaitech.edu.cn
Supported by:文章分享
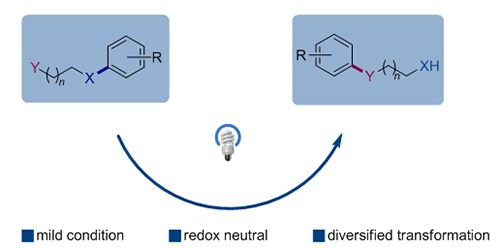
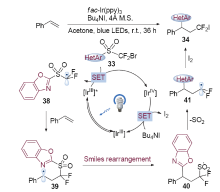
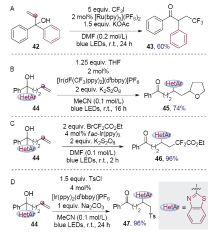
Smiles重排反应是有机合成中被广泛使用的人名反应之一, 是芳基化合物构建策略的一种独特方法. Smiles重排经历了近一个世纪的发展, 从传统的离子型Smiles反应、Truce-Smiles反应等, 发展到后期的自由基型Smiles重排, 这些进展极大地丰富了该反应在合成化学、材料化学等领域的应用. 近年来, 光催化氧化还原反应获得了广泛关注, 这一新颖催化模式高效利用光能, 能在温和的条件下产生自由基中间体, 实现了很多选择性反应. 过去的五年中, 化学家逐渐将这一催化模式应用到了Smiles重排反应中, 发展了一系列新颖、实用的合成方法. 本文对这些进展进行综述, 主要依据促进重排反应的自由基种类和成键类型进行分类.
陈奕霖, 常亮, 左智伟. 可见光催化诱导的Smiles重排研究进展[J]. 化学学报, 2019, 77(9): 794-802.
Chen, Yilin, Chang, Liang, Zuo, Zhiwei. Visible Light Photoredox-Induced Smiles Rearrangement[J]. Acta Chimica Sinica, 2019, 77(9): 794-802.






| [1] |
(a) Chen, Z.-M.; Zhang, X.-M.; Tu, Y.-Q. Chem. Soc. Rev. 2015, 44, 5220
doi: 10.1039/C4CS00467A |
|
(b) Allart-Simon, I.; Gérard, S.; Sapi, J. Molecules 2016, 21, 878;
doi: 10.1039/C4CS00467A |
|
|
(c) Holden, C. M.; Greaney, M. F. Chem. Eur. J. 2017, 23, 8992;
doi: 10.1039/C4CS00467A |
|
|
(d) Lin, S.-B.; He, X.-R.; Meng, J.-P.; Gu, H.-N.; Zhang, P.-Z.; Wu, J. Chin. J. Org. Chem. 2017, 37, 1864.
doi: 10.1039/C4CS00467A |
|
|
( 蔺松波, 何兴瑞, 孟金鹏, 顾海宁, 张培志, 吴军, 有机化学, 2017, 37, 1864.)
doi: 10.1039/C4CS00467A |
|
| [2] | (a) Warren, L. A.; Smiles, S. J. Chem. Soc. 1930, 1327 |
| (b) Warren, L. A.; Smiles, S. J. Chem. Soc. 1930, 956; | |
| (c) Levi, A.; Warren, L. A.; Smiles, S. J. Chem. Soc. 1933, 1490. | |
| [3] |
(a) Kong, W.; Merino, E.; Nevado, C. Angew. Chem., Int. Ed. 2014, 53, 5078
doi: 10.1002/anie.201310747 |
|
(b) Thaharn, W.; Soorukram, D.; Kuhakarn, C.; Tuchinda, P.; Reutrakul, V.; Pohmakotr, M. Angew. Chem., Int. Ed. 2014, 53, 2212;
doi: 10.1002/anie.201310747 |
|
|
(c) Fuentes, N.; Kong, W.; Fernández-Sánchez, L.; Merino, E.; Nevado, C. J. Am. Chem. Soc. 2015, 137, 964;
doi: 10.1002/anie.201310747 |
|
|
(d) Wu, X.; Zhu, C. Chin. J. Chem. 2019, 37, 171.
doi: 10.1002/anie.201310747 |
|
| [4] |
Douglas, J. J.; Albright, H.; Sevrin, M. J.; Cole, K. P.; Stephenson, C. R . J.Angew. Chem., Int. Ed. 2015, 54, 14898.
doi: 10.1002/anie.201507369 |
| [5] | Benito Collado, A. B.; Diaz Buezo, N.; Jimenez-Aguado, A. M.; Lafuente Blanco, C.; Martinez-Grau, M. A.; Pedregal-Tercero, C.; Toledo Escribano, M. A. U.S. 8232289 B2, 2011. |
| [6] |
Douglas, J. J.; Sevrin, M. J.; Cole, K. P.; Stephenson, C. R . J.Org. Process Res. Dev. 2016, 20, 1148.
doi: 10.1021/acs.oprd.6b00126 |
| [7] |
Li, Y.; Hu, B.; Dong, W.; Xie, X.; Wan, J.; Zhang, Z . J. Org. Chem. 2016, 81, 7036.
doi: 10.1021/acs.joc.6b00735 |
| [8] |
Alpers, D.; Cole, K. P.; Stephenson, C. R . J.Angew. Chem., Int. Ed. 2018, 57, 12167.
doi: 10.1002/anie.201806659 |
| [9] |
Faderl, C.; Budde, S.; Kachkovskyi, G.; Rackl, D.; Reiser, O . J. Org. Chem. 2018, 83, 12192.
doi: 10.1021/acs.joc.8b01538 |
| [10] |
Liu, C.; Zhang, B . RSC Adv. 2015, 5, 61199.
doi: 10.1039/C5RA08996D |
| [11] |
Brachet, E.; Marzo, L.; Selkti, M.; König, B.; Belmont, P . Chem. Sci. 2016, 7, 5002.
doi: 10.1039/C6SC01095D |
| [12] |
Tang, S.; Yuan, L.; Deng, Y.-L.; Li, Z.-Z.; Wang, L.-N.; Huang, G.-X.; Sheng, R.-L . Tetrahedron Lett. 2017, 58, 329.
doi: 10.1016/j.tetlet.2016.12.027 |
| [13] |
Huang, H.; Li, Y . J. Org. Chem. 2017, 82, 4449.
doi: 10.1021/acs.joc.7b00350 |
| [14] |
Monos, T. M.; McAtee, R. C.; Stephenson, C. R. J.Science 2018, 361, 1369.
doi: 10.1126/science.aat2117 |
| [15] |
Zard, S. Z . Chem. Soc. Rev. 2008, 37, 1603.
doi: 10.1039/b613443m |
| [16] |
Yu, J.; Wu, Z.; Zhu, C . Angew. Chem., Int. Ed. 2018, 57, 17156.
doi: 10.1002/anie.v57.52 |
| [17] |
Whalley, D. M.; Duong, H. A.; Greaney, M. F . Chem. Eur. J. 2019, 25, 1927.
doi: 10.1002/chem.v25.8 |
| [18] |
Xu, P.; Hu, K.; Gu, Z.; Cheng, Y.; Zhu, C . Chem. Commun. 2015, 51, 7222.
doi: 10.1039/C5CC01189B |
| [19] |
(a) Huang, H.-L.; Yan, H.; Yang, C.; Xia, W. Chem. Commun. 2015, 51, 4910
doi: 10.1039/C4CC10321A |
|
(b) Li, Y.; Liu, B.; Ouyang, X.-H.; Song, R.-J.; Li, J.-H. Org. Chem. Front. 2015, 2, 1457;
doi: 10.1039/C4CC10321A |
|
|
(c) Cai, S.; Tian, Y.; Zhang, J.; Liu, Z.; Lu, M.; Weng, W.; Huang, M. Adv. Synth. Catal. 2018, 360, 4084;
doi: 10.1039/C4CC10321A |
|
|
(d) Lu, M.; Qin, H.; Lin, Z.; Huang, M.; Weng, W.; Cai, S. Org. Lett. 2018, 20, 7611;
doi: 10.1039/C4CC10321A |
|
|
(e) Wang, H.; Xu, Q.; Yu, S. Org. Chem. Front. 2018, 5, 2224;
doi: 10.1039/C4CC10321A |
|
|
(f) Wang, Q.-L.; Chen, Z.; Zhou, C.-S.; Xiong, B.-Q.; Zhang, P.-L.; Yang, C.-A.; Liu, Y.; Zhou, Q. Tetrahedron Lett. 2018, 59, 4551;
doi: 10.1039/C4CC10321A |
|
|
(g) Yin, Y.; Weng, W.-Z.; Sun, J.-G.; Zhang, B. Org. Biomol. Chem. 2018, 16, 2356;
doi: 10.1039/C4CC10321A |
|
|
(h) Wei, X.-J.; Noël, T. J. Org. Chem. 2018, 83, 11377. 11377.
doi: 10.1039/C4CC10321A |
|
| [20] |
Gu, L.; Gao, Y.; Ai, X.; Jin, C.; He, Y.; Li, G.; Yuan, M . Chem. Commun. 2017, 53, 12946.
doi: 10.1039/C7CC06484E |
| [21] |
Zhou, N.-N.; Xu, P.; Li, W.-P.; Cheng, Y.-X.; Zhu, C.-J . Acta Chim. Sinica 2017, 75, 60.
doi: 10.6023/A16070375 |
|
( 周能能, 胥攀, 李伟鹏, 成义祥, 朱成建 , 化学学报, 2017, 75, 60.)
doi: 10.6023/A16070375 |
|
| [22] |
Yu, J.; Wang, D.; Xu, Y.; Wu, Z.; Zhu, C . Adv. Synth. Catal. 2018, 360, 744.
doi: 10.1002/adsc.v360.4 |
| [23] |
Tang, N.; Yang, S.; Wu, X.; Zhu, C . Tetrahedron 2019, 75, 1639.
doi: 10.1016/j.tet.2018.12.003 |
| [24] |
Wu, X.; Wang, M.; Huan, L.; Wang, D.; Wang, J.; Zhu, C . Angew. Chem. 2018, 130, 1656.
doi: 10.1002/ange.201709025 |
| [25] |
Dondoni, A.; Marra, A . Chem. Rev. 2004, 104, 2557.
doi: 10.1021/cr020079l |
| [26] |
Shu, W.; Genoux, A.; Li, Z.; Nevado, C . Angew. Chem., Int. Ed. 2017, 56, 10521.
doi: 10.1002/anie.v56.35 |
| [27] |
Wang, N.; Gu, Q.-S.; Li, Z.-L.; Li, Z.; Guo, Y.-L.; Guo, Z.; Liu, X.-Y . Angew. Chem., Int. Ed. 2018, 57, 14225.
doi: 10.1002/anie.201808890 |
| [28] |
Wang, S.-F.; Cao, X.-P.; Li, Y . Angew. Chem., Int. Ed. 2017, 56, 13809.
doi: 10.1002/anie.201706597 |
| [29] |
Gonzalez-Gomez, J. C.; Ramirez, N. P.; Lana-Villarreal, T.; Bonete, P. Org. Biomol. Chem. 2017, 15, 9680.
doi: 10.1039/C7OB02579C |
| [30] |
Li, J.; Liu, Z.; Wu, S.; Chen, Y . Org. Lett. 2019, 21, 2077.
doi: 10.1021/acs.orglett.9b00353 |
| [1] | 李飞, 丁汇丽, 李超忠. 基于氟仿衍生的三氟甲基硼络合物参与的烯烃氢三氟甲基化反应[J]. 化学学报, 2023, 81(6): 577-581. |
| [2] | 徐袁利, 潘辉, 杨义, 左智伟. 连续流条件下蒽-铈协同催化的苄位碳氢键选择性氧化反应★[J]. 化学学报, 2023, 81(5): 435-440. |
| [3] | 杨民, 叶柏柏, 陈健强, 吴劼. 可见光催化烷基磺酰自由基启动芳酰肼的烷基磺酰化反应[J]. 化学学报, 2022, 80(1): 11-15. |
| [4] | 马智烨, 叶丽, 吴雨桓, 赵彤. B,N-SnO2/TiO2光催化剂的制备及其光催化性能研究[J]. 化学学报, 2021, 79(9): 1173-1179. |
| [5] | 董奎, 刘强, 吴骊珠. 放氢交叉偶联反应[J]. 化学学报, 2020, 78(4): 299-310. |
| [6] | 张振, 龚莉, 周晓渝, 颜思顺, 李静, 余达刚. 二氧化碳参与的自由基型烯烃双官能团化反应[J]. 化学学报, 2019, 77(9): 783-793. |
| [7] | 杨俊航, 傅晓波, 卢增辉, 朱钢国. 可见光催化烯烃砜基化启动的远程醛基碳-氢键直接硫化反应[J]. 化学学报, 2019, 77(9): 901-905. |
| [8] | 戴建玲, 雷文龙, 刘强. 可见光驱使铜盐催化芳香烃二氟烷基化反应[J]. 化学学报, 2019, 77(9): 911-915. |
| [9] | 刘茹雪, 何小燕, 牛力同, 吕柏霖, 余菲, 张哲, 杨志旺. 具有分级纳米结构的In2S3/CdIn2S4在可见光下催化苯甲胺的氧化偶联反应[J]. 化学学报, 2019, 77(7): 653-660. |
| [10] | 孟双艳, 杨红菊, 朱楠, 杨娇, 杨瑞瑞, 杨志旺. BiOCl-ov/坡缕石复合可见光催化剂的制备及其对醇类的选择性氧化研究[J]. 化学学报, 2019, 77(5): 461-468. |
| [11] | 马亚丽, 刘茹雪, 孟双艳, 牛力同, 杨志旺, 雷自强. 以UiO-66为前驱体的Fe-ZrO2的制备及其可见光降解性能研究[J]. 化学学报, 2019, 77(2): 153-159. |
| [12] | 孟双艳, 王明明, 吕柏霖, 薛群基, 杨志旺. Eu掺杂的ZnO/MIL-53(Fe)光催化剂的合成及其对醇类选择性氧化的催化性能研究[J]. 化学学报, 2019, 77(11): 1184-1193. |
| [13] | 张文强, 李秋艳, 杨馨雨, 马征, 王欢欢, 王晓军. 含苯并噻二唑结构单元的金属有机骨架在可见光催化需氧氧化反应中的应用[J]. 化学学报, 2017, 75(1): 80-85. |
| [14] | 钟建基, 孟庆元, 陈彬, 佟振合, 吴骊珠. 可见光催化的交叉偶联放氢反应[J]. 化学学报, 2017, 75(1): 34-40. |
| [15] | 余晓叶, 周帆, 陈加荣, 肖文精. 可见光促进的酰胺氮自由基参与的分子内氢胺化反应[J]. 化学学报, 2017, 75(1): 86-91. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||