有机化学 ›› 2019, Vol. 39 ›› Issue (11): 3207-3214.DOI: 10.6023/cjoc201904069 上一篇 下一篇
研究论文
李恒超, 赵玲, 刘燕, 张霞, 李王兵, 敬林海, 黄锦*( ), 汪伟*(
), 汪伟*( )
)
收稿日期:2019-04-27
发布日期:2019-07-03
通讯作者:
黄锦,汪伟
E-mail:huahuanhuangjin@163.com;wangwei1987@cwnu.edu.cn
基金资助:
Li Hengchao, Zhao Ling, Liu Yan, Zhang Xia, Li Wangbing, Jing Linhai, Huang Jin*( ), Wang Wei*(
), Wang Wei*( )
)
Received:2019-04-27
Published:2019-07-03
Contact:
Huang Jin,Wang Wei
E-mail:huahuanhuangjin@163.com;wangwei1987@cwnu.edu.cn
Supported by:文章分享
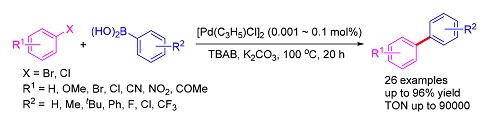
一种简单、高效的钯纳米粒子催化体系被用于Suzuki偶联反应中.该催化体系对含各种官能团的卤代芳烃和芳基硼酸都表现出了非常高的催化活性.当用对硝基溴苯作底物时,在催化剂用量低至0.001 mol%时转化数能达到90000,这也证实了该催化体系有比较好的稳定性和较长的寿命.
李恒超, 赵玲, 刘燕, 张霞, 李王兵, 敬林海, 黄锦, 汪伟. 基于简单高效钯纳米粒子催化Suzuki偶联反应的研究[J]. 有机化学, 2019, 39(11): 3207-3214.
Li Hengchao, Zhao Ling, Liu Yan, Zhang Xia, Li Wangbing, Jing Linhai, Huang Jin, Wang Wei. An Efficient Palladium Nanoparticles Catalytic System for Suzuki Coupling Reactions[J]. Chinese Journal of Organic Chemistry, 2019, 39(11): 3207-3214.
 | |||||
| Entry | Base | Solvent | TBAB/mmol | Time/h | Yieldb/% |
| 1 | Et3N | DMA | 0.375 | 8 | 0 |
| 2 | NaOAc | DMA | 0.375 | 8 | 0 |
| 3 | NaHCO3 | DMA | 0.375 | 8 | 10 |
| 4 | Na2CO3 | DMA | 0.375 | 8 | 17 |
| 5 | K2CO3 | DMA | 0.375 | 8 | 100 |
| 6 | K3PO4 | DMA | 0.375 | 8 | 88 |
| 7 | NaOH | DMA | 0.375 | 8 | 19 |
| 8 | K2CO3 | DMA | 0.375 | 2 | 96 |
| 9 | K2CO3 | DMF | 0.375 | 2 | 100 |
| 10 | K2CO3 | 1, 4-Dioxane | 0.375 | 2 | 58 |
| 11 | K2CO3 | n-Butanol | 0.375 | 2 | 26 |
| 12 | K2CO3 | Toluene | 0.375 | 2 | 63 |
| 13 | K2CO3 | DMF | 0.125 | 1 | 94 |
| 14 | K2CO3 | DMF | 0.25 | 1 | 85 |
| 15 | K2CO3 | DMF | 0.375 | 1 | 79 |
| 16 | K2CO3 | DMF | 0.5 | 1 | 84 |
 | |||||
| Entry | Base | Solvent | TBAB/mmol | Time/h | Yieldb/% |
| 1 | Et3N | DMA | 0.375 | 8 | 0 |
| 2 | NaOAc | DMA | 0.375 | 8 | 0 |
| 3 | NaHCO3 | DMA | 0.375 | 8 | 10 |
| 4 | Na2CO3 | DMA | 0.375 | 8 | 17 |
| 5 | K2CO3 | DMA | 0.375 | 8 | 100 |
| 6 | K3PO4 | DMA | 0.375 | 8 | 88 |
| 7 | NaOH | DMA | 0.375 | 8 | 19 |
| 8 | K2CO3 | DMA | 0.375 | 2 | 96 |
| 9 | K2CO3 | DMF | 0.375 | 2 | 100 |
| 10 | K2CO3 | 1, 4-Dioxane | 0.375 | 2 | 58 |
| 11 | K2CO3 | n-Butanol | 0.375 | 2 | 26 |
| 12 | K2CO3 | Toluene | 0.375 | 2 | 63 |
| 13 | K2CO3 | DMF | 0.125 | 1 | 94 |
| 14 | K2CO3 | DMF | 0.25 | 1 | 85 |
| 15 | K2CO3 | DMF | 0.375 | 1 | 79 |
| 16 | K2CO3 | DMF | 0.5 | 1 | 84 |
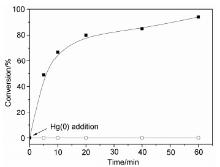
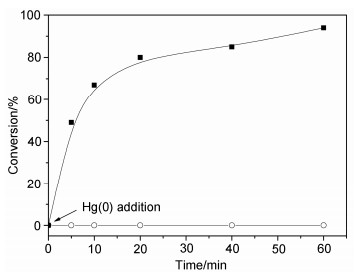
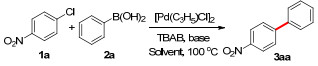
| [1] |
Miyaura N.; Suzuki A. Chem. Rev. 1995, 95 2457.
doi: 10.1021/cr00039a007 |
| [2] | Suzuki A. Chem. Commun. 2005 4759. |
| [3] |
Suzuki A. Angew. Chem., Int. Ed. 2011, 50 6722.
doi: 10.1002/anie.201101379 |
| [4] |
Capdeville R.; Buchdunger E.; Zimmermann J.; Matter A. Nat. Rev. Drug Discovery 2002, 1 493.
doi: 10.1038/nrd839 |
| [5] |
Corbet J. P.; Mignani G. Chem. Rev. 2006, 106 2651.
doi: 10.1021/cr0505268 |
| [6] |
Magano J.; Dunetz J. R. Chem. Rev. 2011, 111 2177.
doi: 10.1021/cr100346g |
| [7] |
Fihri A.; Bouhrara M.; Nekoueishahraki B.; Basset J.-M.; Polshettiwar V. Chem. Soc. Rev. 2011, 40 5181.
doi: 10.1039/c1cs15079k |
| [8] |
(a) Jana, R.; Pathak, T. P.; Sigman, M. S. Chem. Rev. 2011, 111, 1417.
doi: 10.1021/cr100327p |
|
(b) Stockton, K. P.; Merritt, C. J.; Sumby, C. J.; Greatrex, B. W. Eur. J. Org. Chem. 2015, 6999.
doi: 10.1021/cr100327p |
|
|
(c) Li, J.-X.; Yang, S.-R.; Wu, W.-Q.; Jiang, H.-F. Eur. J. Org. Chem. 2018, 1284.
doi: 10.1021/cr100327p |
|
| [9] | Albisson D. A.; Bedford R. B.; Lawrence S. E.; Scully P. N. Chem. Commun. 1998 2095. |
| [10] |
Zapf A.; Ehrentraut A.; Beller M. Angew. Chem., Int. Ed. 2000, 39 4153.
doi: 10.1002/1521-3773(20001117)39:22<4153::AID-ANIE4153>3.0.CO;2-T |
| [11] |
Yuan D.; Huynh H. V. Organometallics 2010, 29 6020.
doi: 10.1021/om1008023 |
| [12] | Bianchini C.; Lee H. M.; Meli A.; Oberhauser W.; Vizza F.; Brüggeller P.; Rainer H. B.; Langes C. Chem. Commun. 2000 777. |
| [13] |
Nair P.; Anderson G. K.; Rath N. P. Organometallics 2003, 22 1494.
doi: 10.1021/om0209069 |
| [14] |
Imamoto T.; Yashio K.; Crépy K. V. L.; Katagiri K.; Takahashi H.; Kouchi M.; Gridnev I. D. Organometallics 2006, 25 908.
doi: 10.1021/om050759p |
| [15] |
Field L. D.; Messerle B. A.; Smernik R. J.; Hambley T. W.; Turner P. Inorg. Chem. 1997, 36 2884.
doi: 10.1021/ic970030b |
| [16] |
(a) Laurenti, D.; Feuerstein, M.; Pèpe, G.; Doucet, H.; Santelli, M. J. Org. Chem. 2001, 66, 1633.
doi: 10.1021/jo001146j |
|
(b) Feuerstein, M.; Laurenti, D.; Bougeant, C.; Doucet, H.; Santelli, M. Chem. Commun. 2001, 325.
doi: 10.1021/jo001146j |
|
|
(c) Feuerstein, M.; Doucet, H.; Santelli, M. Synlett 2001, 9, 1458.
doi: 10.1021/jo001146j |
|
|
(d) Feuerstein, M.; Doucet, H.; Santelli, M. Tetrahedron Lett. 2001, 42, 6667.
doi: 10.1021/jo001146j |
|
|
(e) Feuerstein, M.; Doucet, H.; Santelli, M. J. Organomet. Chem. 2003, 687, 327.
doi: 10.1021/jo001146j |
|
| [17] |
Hierso J.-C.; Fihri A.; Amardeil R.; Meunier P.; Doucet H.; Santelli M.; Donnadieu B. Organometallics 2003, 22 4490.
doi: 10.1021/om0302948 |
| [18] |
Zaborova E.; Deschamp J.; Guieu S.; Bleriot Y.; Poli G.; Menand M.; Madec D.; Prestat G.; Sollogoub M. Chem. Commun. 2011, 47 9206.
doi: 10.1039/c1cc12241j |
| [19] |
(a) Wang, K.; Yi, T.; Yu, X.-J.; Zheng, X.-L.; Fu, H.-Y.; Chen, H.; Li, R.-X. Appl. Organomet. Chem. 2012, 26, 342.
doi: 10.1002/aoc.2869 |
|
(b) Wang, K.; Fu, Q.; Zhou, R.; Zheng, X.-L.; Fu, H.-Y.; Chen, H.; Li, R.-X. Appl. Organomet. Chem. 2013, 27, 232.
doi: 10.1002/aoc.2869 |
|
|
(c) Wang, K.; Wang, W.; Luo, H.; Zheng, X.-L.; Fu, H.-Y.; Chen, H.; Li, R.-X. Catal. Lett. 2013, 143, 1214.
doi: 10.1002/aoc.2869 |
|
|
(d) Guo, F.-C.; Zhou, R.; Jiang, Z.-J.; Wang, W.; Zheng, X.-L.; Fu, H.-Y.; Chen, H.; Li, R.-X. Catal. Commun. 2015, 66, 87.
doi: 10.1002/aoc.2869 |
|
| [20] |
(a) Bernhardt, E.; Willner, H.; Jonas, V.; Thiel, W.; Aubke, F. Angew. Chem., Int. Ed. 2000, 39, 165.
doi: 10.6023/cjoc201507013 |
|
(b) Sayah, R.; Glegola, K.; Framery, E.; Dufaud, V. Adv. Synth. Catal. 2007, 349, 373.
doi: 10.6023/cjoc201507013 |
|
|
(c) Gholinejad, M.; Hamed F.; Biji, P. Dalton Trans. 2015, 44, 14293.
doi: 10.6023/cjoc201507013 |
|
|
(d) Zhang, Q.; Li, J.-H.; Zhao, X. Chin. J. Org. Chem. 2016, 36, 130 (in Chinese).
doi: 10.6023/cjoc201507013 |
|
|
(张强, 李继航赵鑫, 有机化学, 2016, 36, 130.)
doi: 10.6023/cjoc201507013 |
|
|
(e) Yang, P.-B.; Ma, R.; Bian, F.-L. ChemCatChem 2016, 8, 3746.
doi: 10.6023/cjoc201507013 |
|
|
(f) Sharma, S.; Nazir, R.; Pande, S.; Sarkar, B. R. ChemistrySelect 2017, 2, 8745.
doi: 10.6023/cjoc201507013 |
|
|
(g) Kunfi, A.; May, Z.; Németh, P.; London, G. J. Catal. 2018, 361, 84.
doi: 10.6023/cjoc201507013 |
|
|
(h) Liu, X.-M.; Tang, B.; Long, J.-L.; Zhang, W.; Liu, X. H.; Mirza, Z. Sci. Bull. 2018, 63, 502.
doi: 10.6023/cjoc201507013 |
|
|
(i) Fu, Y.-F.; Zou, Z.-J.; Tang, C.; Song, K.-P. Chin. J. Org. Chem. 2018, 38, 3106 (in Chinese).
doi: 10.6023/cjoc201507013 |
|
|
(付玉芳, 邹志娟, 唐成, 宋昆鹏, 有机化学, 2018, 38, 3106.)
doi: 10.6023/cjoc201507013 |
|
|
(j) Narkhede, N.; Uttam, B.; Rao, C. P. ACS Omega 2019, 4, 4908.
doi: 10.6023/cjoc201507013 |
|
| [21] |
(a) Wang, W.; Yang, Q.; Zhou, R.; Fu, H.-Y.; Zheng, X.-L.; Chen, H.; Li, R.-X. J. Organomet. Chem. 2012, 697, 1.
doi: 10.6023/cjoc201807040 |
|
(b) Wang, W.; Zhou, R.; Jiang, Z.-J.; Wang, K.; Fu, H.-Y.; Zheng, X.-L.; Chen, H.; Li, R.-X. Adv. Synth. Catal. 2014, 356, 616.
doi: 10.6023/cjoc201807040 |
|
|
(c) Wang, W.; Zhou, R.; Jiang, Z.-J.; Wang, X.; Fu, H.-Y.; Zheng, X.-L.; Chen, H.; Li, R.-X. Eur. J. Org. Chem. 2015, 2579.
doi: 10.6023/cjoc201807040 |
|
|
(d) Huang, J.; Fu, R.-H.; Jing, L.-H.; Qin, D.-B.; Huang, K.; Wang, W. Chin. J. Org. Chem. 2019, 39, 456 (in Chinese).
doi: 10.6023/cjoc201807040 |
|
|
(黄锦, 付荣辉, 敬林海, 秦大斌, 黄昆, 汪伟, 有机化学, 2019, 39, 456.)
doi: 10.6023/cjoc201807040 |
|
|
(e) He, H.-Y.; Wang, W.; Yu, X.-J.; Huang, J.; Jian, L.; Fu, H.-Y.; Zheng, X.-L.; Chen, H.; Li, R.-X. Eur. J. Org. Chem. 2016, 56169.
doi: 10.6023/cjoc201807040 |
|
| [22] |
Arumugam V.; Kaminsky W.; Bhuvanesh N. S. P.; Nallasamy D. RSC Adv. 2015, 5 59428.
doi: 10.1039/C5RA10973F |
| [23] | Lysén M.; Köhler K. Synthesis 2006, 4 692. |
| [24] |
Jansa J.; Jambor R. Appl. Organomet. Chem. 2016, 30 1036.
doi: 10.1002/aoc.3539 |
| [25] |
Ahmed J.; Chakraborty S.; Jose A.; Mandal S. K. J. Am. Chem. Soc. 2018, 140 8330.
doi: 10.1021/jacs.8b04786 |
| [26] |
Klein M.; Voigtmann U.; Haack T.; Erdinger L.; Boche G. Mutat. Res. 2000, 467 55.
doi: 10.1016/S1383-5718(00)00012-7 |
| [27] | Macé Y.; Raymondeau B.; Pradet C.; Blazejewski J. C.; Magnier E. Eur. J. Org. Chem. 2009 1390. |
| [28] |
Ernst J. B.; Rakers L.; Glorius F. Synthesis 2017, 49 260.
doi: 10.1055/s-0036-1588609 |
| [29] |
Duan X.-Y.; Li P.-B.; Zhu G.-R.; Fu C.-L.; Chen Q.; Huang X.; Ma S.-M. Org. Chem. Front. 2018, 5 3319.
doi: 10.1039/C8QO00781K |
| [30] |
Chiu C. C.; Chiu H. T.; Lee D. S.; Lu T. J. RSC Adv. 2018, 8 26407.
doi: 10.1039/C8RA04094J |
| [1] | 王静, 吴琳琳, 王倩. 新型茚并芴-6,12-二酮衍生物的合成与性能研究[J]. 有机化学, 2023, 43(1): 223-228. |
| [2] | 贾雪锋, 仝向娟. 铜(II)配合物催化Chan-Lam偶联反应研究进展[J]. 有机化学, 2022, 42(9): 2640-2658. |
| [3] | 邹晓亮, 徐森苗. 铱催化的(杂)芳烃远端区域选择性C—H硼化反应的最新进展[J]. 有机化学, 2021, 41(7): 2610-2620. |
| [4] | 许秀枝, 张帆, 黄胜, 张志强, 柯方. 水相中可见光催化卤代芳烃羟基化反应[J]. 有机化学, 2020, 40(9): 2912-2918. |
| [5] | 姚丹丹, 张金利, 徐亮. 二苯甲酮腙与芳基氯化物及芳基硼酸的碳氮键偶联反应[J]. 有机化学, 2020, 40(6): 1673-1679. |
| [6] | 段希焱, 刘宁, 王佳, 马军营. 铜催化下含氮化合物的Chan-Lam偶联反应的研究进展[J]. 有机化学, 2019, 39(3): 661-667. |
| [7] | 黄锦, 付荣辉, 敬林海, 秦大斌, 黄昆, 汪伟. 基于钯纳米粒子催化分子内Heck反应合成3-取代苯并呋喃衍生物的研究[J]. 有机化学, 2019, 39(2): 456-462. |
| [8] | 徐玉良, 方浩. 芳基硼酸类化合物合成研究进展[J]. 有机化学, 2018, 38(4): 738-751. |
| [9] | 董坤, 李秋云, 安康, 马俊逸, 白中胜, 刘乾才. 钯催化C3-对称9-芳基吖啶类衍生物的合成[J]. 有机化学, 2018, 38(2): 416-424. |
| [10] | 刘伯渠, 燕中飞, 权正军. 钯/乙酸亚铜共同促进的嘧啶硫醚的脱硫碳碳偶联反应[J]. 有机化学, 2018, 38(11): 3032-3038. |
| [11] | 付玉芳, 邹志娟, 唐成, 宋昆鹏. 杨梅状单分散微球负载Pd纳米颗粒用于室温下Suzuki偶联反应[J]. 有机化学, 2018, 38(11): 3106-3111. |
| [12] | 蒋海芳, 张敏, 张丽, 陈雅丽, 朱宁, 宋力平, 邓红梅. 3,4-二芳基-5-芳氧甲基异噁唑的合成[J]. 有机化学, 2017, 37(9): 2399-2408. |
| [13] | 闫小惠, 李加荣, 张奇, 史大昕. 微波促进下芳基硼酸合成芳香族硝基化合物的研究[J]. 有机化学, 2017, 37(6): 1450-1455. |
| [14] | 白亚丽, 李晓维, 肖雪冬, 刘佳琦, 杨俊娟, 王君文. 含羟基氮杂环卡宾的咪唑盐前体的合成及其原位产生的卡宾配体在Suzuki-Miyaura和Sonogashira反应中的应用[J]. 有机化学, 2017, 37(5): 1258-1265. |
| [15] | 袁航, 陈惠莲, 罗治斌, 高玉华, 陆鸿飞. 一种含吡啶配体氮杂环卡宾钯络合物(NHC)PdCl2(Py)的合成及其高效催化偶联反应[J]. 有机化学, 2017, 37(11): 2948-2955. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||