有机化学 ›› 2019, Vol. 39 ›› Issue (11): 3199-3206.DOI: 10.6023/cjoc201904029 上一篇 下一篇
研究论文
收稿日期:2019-04-11
发布日期:2019-07-03
通讯作者:
刘天宝,章敏
E-mail:tianbaoliu1979@126.com;287323206@qq.com
基金资助:
Liu Tianbao*( ), Peng Yanfen, Gui Meifang, Zhang Min*(
), Peng Yanfen, Gui Meifang, Zhang Min*( )
)
Received:2019-04-11
Published:2019-07-03
Contact:
Liu Tianbao,Zhang Min
E-mail:tianbaoliu1979@126.com;287323206@qq.com
Supported by:文章分享

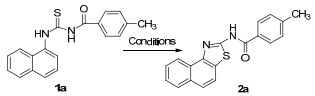
报道了在室温条件下,二醋酸碘苯促进3-[1-(4-取代萘基)]-1-芳酰基硫脲自身关环得到一系列2-芳酰氨基萘并[1,2-d]噻唑衍生物.该方法具有反应条件温和,反应迅速,操作简单,原子利用率高,无需金属催化以及底物范围广等优点.该方法也为萘并[1,2-d]噻唑衍生物的合成提供了新的高效途径.
刘天宝, 彭艳芬, 桂美芳, 章敏. 无金属催化快速合成2-芳酰氨基萘并[1, 2-d]噻唑[J]. 有机化学, 2019, 39(11): 3199-3206.
Liu Tianbao, Peng Yanfen, Gui Meifang, Zhang Min. Metal-Free Rapid Synthesis of 2-Aroylamino Naphtho[1, 2-d]thiazoles[J]. Chinese Journal of Organic Chemistry, 2019, 39(11): 3199-3206.
 | |||||
| Entry | IBD/equiv. | Temp./℃ | Time/min | Solvent | Yieldb/% |
| 1 | 1.0 | 80 | 30 | CH3CN | 68 |
| 2 | 1.1 | 80 | 30 | CH3CN | 74 |
| 3 | 1.2 | 80 | 30 | CH3CN | 83 |
| 4 | 1.3 | 80 | 30 | CH3CN | 75 |
| 5 | 1.4 | 80 | 30 | CH3CN | 67 |
| 6 | 1.2 | 70 | 30 | CH3CN | 83 |
| 7 | 1.2 | 60 | 30 | CH3CN | 82 |
| 8 | 1.2 | 50 | 30 | CH3CN | 86 |
| 9 | 1.2 | 40 | 30 | CH3CN | 85 |
| 10 | 1.2 | 30 | 30 | CH3CN | 86 |
| 11 | 1.2 | 20 | 30 | CH3CN | 86 |
| 12 | 1.2 | 14 | 30 | CH3CN | 44 |
| 13 | 1.2 | 20 | 30 | CH3CH2OH | 60 |
| 14 | 1.2 | 20 | 30 | CH3OH | 65 |
| 15 | 1.2 | 20 | 30 | THF | 43 |
| 16 | 1.2 | 20 | 30 | Petroleum ether | 22 |
| 17 | 1.2 | 20 | 30 | 1, 4-Dioxane | 40 |
| 18 | 1.2 | 20 | 30 | AcOH | 80 |
| 19 | 1.2 | 20 | 20 | CH3CN | 86 |
| 20 | 1.2 | 20 | 10 | CH3CN | 86 |
| 21 | 1.2 | 20 | 5 | CH3CN | 87 |
 | |||||
| Entry | IBD/equiv. | Temp./℃ | Time/min | Solvent | Yieldb/% |
| 1 | 1.0 | 80 | 30 | CH3CN | 68 |
| 2 | 1.1 | 80 | 30 | CH3CN | 74 |
| 3 | 1.2 | 80 | 30 | CH3CN | 83 |
| 4 | 1.3 | 80 | 30 | CH3CN | 75 |
| 5 | 1.4 | 80 | 30 | CH3CN | 67 |
| 6 | 1.2 | 70 | 30 | CH3CN | 83 |
| 7 | 1.2 | 60 | 30 | CH3CN | 82 |
| 8 | 1.2 | 50 | 30 | CH3CN | 86 |
| 9 | 1.2 | 40 | 30 | CH3CN | 85 |
| 10 | 1.2 | 30 | 30 | CH3CN | 86 |
| 11 | 1.2 | 20 | 30 | CH3CN | 86 |
| 12 | 1.2 | 14 | 30 | CH3CN | 44 |
| 13 | 1.2 | 20 | 30 | CH3CH2OH | 60 |
| 14 | 1.2 | 20 | 30 | CH3OH | 65 |
| 15 | 1.2 | 20 | 30 | THF | 43 |
| 16 | 1.2 | 20 | 30 | Petroleum ether | 22 |
| 17 | 1.2 | 20 | 30 | 1, 4-Dioxane | 40 |
| 18 | 1.2 | 20 | 30 | AcOH | 80 |
| 19 | 1.2 | 20 | 20 | CH3CN | 86 |
| 20 | 1.2 | 20 | 10 | CH3CN | 86 |
| 21 | 1.2 | 20 | 5 | CH3CN | 87 |
| [1] |
(a) Joy, H. B.; Bogert, M. T. J. Org. Chem. 1936, 1, 236.
doi: 10.1021/jo01232a002 |
|
(b) Keyes, G. H.; Brooker, L. G. S. J. Am. Chem. Soc. 1937, 59, 74.
doi: 10.1021/jo01232a002 |
|
|
(c) Akins, D. L.; özçelik, S.; Zhu, H.-R.; Guo, C. J. Phys. Chem. A 1997, 101, 3251.
doi: 10.1021/jo01232a002 |
|
|
(d) Urano, T.; Hino, E. Imaging Sci. J. 1999, 47, 127.
doi: 10.1021/jo01232a002 |
|
|
(e) Huang, W.; Zhang, X.-H.; Wang, L.-Y.; Zhai, G.-H.; Wen, Z.-Y.; Zhang, Z.-X. J. J. Mol. Struct. 2010, 977, 39.
doi: 10.1021/jo01232a002 |
|
| [2] |
(a) Perrone, R.; Berardi, F.; Colabufo, N. A.; Tortorella, V.; Fornaretto, M. G.; Caccia, C.; Mcarthur, R. A. Eur. J. Med. Chem. 1997, 32, 739.
doi: 10.1016/S0223-5234(97)88916-7 |
|
(b) Li, Z.-G.; Yang, Q.; Qian, X.-H. Bioorg. Med. Chem. 2005, 13, 3149.
doi: 10.1016/S0223-5234(97)88916-7 |
|
|
(c) Hu, H.; Owwns, E. A.; Su, H.-R.; Yan, L.-L.; Lecitz, A.; Zhao, X.-Y.; Henary, M.; Zheng, Y. J. G. J. Med. Chem. 2015, 58, 1228.
doi: 10.1016/S0223-5234(97)88916-7 |
|
| [3] |
(a) El-Shishtawy, R. M.; Asiri, A. M.; Basaif, S. A.; Sobahi, T. R. Spectrochim. Acta A 2010, 75, 1605.
doi: 10.1016/j.saa.2010.02.026 |
|
(b) Aiken, S.; Allsopp, B.; Booth, K.; Gabbutt, C. D.; Heron, B. M.; Rice, C. R. Tetrahedron 2014, 70, 9352.
doi: 10.1016/j.saa.2010.02.026 |
|
|
(c) Yang, W.; Liu, C.-L.; Gao, Q.-Y.; Du, J.-Y.; Shen, P.; Liu, Y.; Yang, C.-Y. Opt. Mater. 2017, 66, 623.
doi: 10.1016/j.saa.2010.02.026 |
|
|
(d) Liu, C.-L.; Yang, W.; Gao, Q.-Y.; Du, J.-Y.; Luo, H.-J.; Liu, Y.; Yang, C.-Y. J. Lumin. 2018, 197, 193.
doi: 10.1016/j.saa.2010.02.026 |
|
| [4] |
(a) Lau, P. T. S.; Gompf, T. E. J. Org. Chem. 1970, 35, 4103.
doi: 10.1021/jo00837a003 |
|
(b) Ulrich, P.; Cerami, A. J. Med. Chem. 1982, 25, 654.
doi: 10.1021/jo00837a003 |
|
|
(c) El-Taweel, F. M. A. A.; Elnagdi, M. H. J. Heterocycl. Chem. 2001, 38, 981.
doi: 10.1021/jo00837a003 |
|
|
(d) Al-Saleh, B.; El-Apasery, M. A.; Abdel-Aziz, R. S.; Elnagdi, M. H. J. Heterocycl. Chem. 2005, 42, 563.
doi: 10.1021/jo00837a003 |
|
| [5] |
Zhang L.-F.; Ni Z.-H.; Li D.-Y.; Qin Z.-H.; Wei X.-Y. Chin. Chem. Lett. 2012, 23 281.
doi: 10.1016/j.cclet.2011.12.004 |
| [6] |
Jonaghani M. Z.; Boeini H. Z. Spectrochim. Acta A 2017, 178 66.
doi: 10.1016/j.saa.2017.01.065 |
| [7] |
(a) Yoshimura, A.; Zhdankin, V. V. Chem. Rev. 2016, 116, 3328.
doi: 10.1021/acs.chemrev.5b00547 |
|
(b) Zhdankin, V. V.; Stang, P. J. Chem. Rev. 2008, 108, 5299.
doi: 10.1021/acs.chemrev.5b00547 |
|
| [8] |
(a) Cho, S. H.; Yoon, J.; Chang, S. J. Am. Chem. Soc. 2011, 133, 5996.
doi: 10.6023/cjoc201710010 |
|
(b) Farid, U.; Wirth, T. Angew. Chem., Int. Ed. 2012, 51, 3462.
doi: 10.6023/cjoc201710010 |
|
|
(c) Saito, E.; Matsumoto, Y.; Nakamura, A.; Namera, Y.; Nakada, M. Org. Lett. 2018, 20, 692.
doi: 10.6023/cjoc201710010 |
|
|
(d) Kitamura, T.; Miyake, A.; Muta, K.; Oyamada, J. J. Org. Chem. 2017, 82, 11721.
doi: 10.6023/cjoc201710010 |
|
|
(e) Liu, T.-B.; Peng, Y.-F.; Wang, Y.-J.; Yong, J.-Y.; Wang, X. Chin. J. Org. Chem. 2018, 38, 969 (in Chinese).
doi: 10.6023/cjoc201710010 |
|
|
(刘天宝, 彭艳芬, 王雅洁, 雍家远, 汪新, 有机化学, 2018, 38, 969.)
doi: 10.6023/cjoc201710010 |
|
| [9] |
(a) Alvarado, J.; Fournier, J.; Zakarian, A. Angew. Chem., Int. Ed. 2016, 55, 11625.
doi: 10.1002/anie.201605648 |
|
(b) Zhang, H.; Shen, J.; Cheng, G.; Feng, Y.; Cui, X. Org. Lett. 2018, 20, 664.
doi: 10.1002/anie.201605648 |
|
|
(c) Zhang, X.; Hou, W.; Zhang-Negrerie, D.; Zhao, K.; Du, Y. Org. Lett. 2015, 17, 5252.
doi: 10.1002/anie.201605648 |
|
|
(d) Zheng, Y.; Li, X.; Ren, C.; Zhang-Negrerie, D.; Du, Y.; Zhao, K. J. Org. Chem. 2012, 77, 10353.
doi: 10.1002/anie.201605648 |
|
|
(e) Zhang, N.; Cheng, R.; Zhang-Negrerie, D.; Du, Y.; Zhao, K. J. Org. Chem. 2014, 79, 10581.
doi: 10.1002/anie.201605648 |
|
| [10] |
(a) Mariappan, A.; Rajaguru, K.; Roja, S. S.; Muthusubramanian, S.; Bhuvanesh, N. Eur. J. Org. Chem. 2016, 81, 302.
doi: 10.1016/j.tet.2008.06.023 |
|
(b) Downer-Riley, N. K.; Jackson, Y. A. Tetrahedron 2008, 64, 7741.
doi: 10.1016/j.tet.2008.06.023 |
|
|
(c) Guo, W.-S.; Gong, H.; Zhang, Y.-A.; Wen, L.-R.; Li, M. Org. Lett. 2018, 20, 6394.
doi: 10.1016/j.tet.2008.06.023 |
|
|
(d) Chinchilla, R.; Nájera, C.; Yus, M. Chem. Rev. 2004, 104, 2667.
doi: 10.1016/j.tet.2008.06.023 |
|
|
(e) Xie, H.; Cai, J.-H.; Wang, Z.-L.; Huang, H.-W.; Deng, G.-J. Org. Lett. 2016, 18, 2196.
doi: 10.1016/j.tet.2008.06.023 |
|
|
(f) Wipf, P.; Venkatraman, S. J. Org. Chem. 1996, 61, 8004.
doi: 10.1016/j.tet.2008.06.023 |
|
|
(g) Kumar, D.; Kumar, N. M.; Chang, K.-H.; Gupta, R.; Shah, K. Bioorg. Med. Chem. Lett. 2011, 21, 5897.
doi: 10.1016/j.tet.2008.06.023 |
|
|
(h) Bose, D. S.; Idrees, M. J. Org. Chem. 2006, 71, 8261.
doi: 10.1016/j.tet.2008.06.023 |
|
| [11] |
Kumar D.; Kumar N. M.; Chang K.-H.; Gupta R.; Shah K. Bioorg. Med. Chem. Lett. 2011, 21 5897.
doi: 10.1016/j.bmcl.2011.07.089 |
| [12] | Liu T.-B.; Peng Y.-F. Chin. J. Chem. Educ. 2018, 39 36. |
| 刘 天宝; 彭 艳芬 化学教育 2018, 39 36. |
| [1] | 陈珊, 陈志林, 胡琼, 蒙艳双, 黄悦, 陶萍芳, 卢丽如, 黄国保. 含双硫脲基团分子钳在非极性溶剂中识别中性分子[J]. 有机化学, 2024, 44(1): 277-281. |
| [2] | 纪健, 刘进华, 管丛, 陈绪文, 赵芸, 刘顺英. 原位生成的磺酸催化N-磺酰基-1,2,3-三氮唑与醇偶联高区域选择性合成N2-取代1,2,3-三氮唑[J]. 有机化学, 2023, 43(3): 1168-1176. |
| [3] | 马彪, 章淼淼, 李占宇, 彭进松, 陈春霞. 无过渡金属催化的Suzuki-Type交叉偶联反应研究进展[J]. 有机化学, 2023, 43(2): 455-470. |
| [4] | 赵瑜, 段玉荣, 史时辉, 白育斌, 黄亮珠, 杨晓军, 张琰图, 冯彬, 张建波, 张秋禹. 可见光促进高价碘(III)试剂参与反应的研究进展[J]. 有机化学, 2023, 43(12): 4106-4140. |
| [5] | 石发胜, 王圣文, 徐欢, 路星星, 杨新玲, 孙腾达, 王长凯, 张晓鸣, 杨青, 凌云. 新型缩氨基硫脲类化合物的设计、合成及杀菌活性研究[J]. 有机化学, 2022, 42(7): 2106-2116. |
| [6] | 张智鑫, 翟彤仪, 朱伯汉, 钱鹏程, 叶龙武. 无金属催化炔酰胺分子内[4+2]环化反应合成四氢吲哚衍生物[J]. 有机化学, 2022, 42(5): 1501-1508. |
| [7] | 陈任宏, 吴桂贞, 杨凯, 叶斌, 陈庆凤, 汪朝阳. 一锅法合成N-呋喃酮基磺酰腙类化合物[J]. 有机化学, 2021, 41(7): 2750-2759. |
| [8] | 马海, 于广浩, 隋峰, 杨米一, 刘丽, 李慧杰, 李峰, 赵庆贺. 三乙胺催化的γ-羟基-α,β-不饱和酮与三氟甲基酮通过半缩酮中间体的级联反应[J]. 有机化学, 2021, 41(4): 1614-1621. |
| [9] | 王琦, 朱柏燃, 杨光, 马献涛, 徐清. 无碱条件下直接多组分反应选择性合成非对称含氮杂芳基硫醚[J]. 有机化学, 2021, 41(3): 1193-1199. |
| [10] | 谢坤宸, 江铭轩, 陈晓岚, 吕琪妍, 於兵. α-酮酸在无金属有机光合成中的应用[J]. 有机化学, 2021, 41(12): 4575-4587. |
| [11] | 张燕, 王芸芸, 赵雨珣, 张成龙, 谷文, 王忠龙, 朱永强, 王石发. 樟脑基缩氨基硫脲衍生物通过活性氧(ROS)介导的线粒体途径诱导人乳腺癌细胞的G2期阻滞和凋亡[J]. 有机化学, 2020, 40(8): 2374-2386. |
| [12] | 刘天宝, 彭娜, 王攀攀, 彭艳芬, 桂美芳, 章敏. 一种新的萘并[2,1-d]噻唑类化合物的合成方法[J]. 有机化学, 2020, 40(5): 1355-1360. |
| [13] | 刘耀宗, 许鹏飞, 马建军, 李晓明, 梁睿渊, 滕志君. 双官能团硫脲催化吲哚-3-酮对β,γ-不饱和酮酯的不对称Michael加成反应研究[J]. 有机化学, 2020, 40(5): 1378-1383. |
| [14] | 白冰, 王龙, 杨静, 蔡莉莉, 刘前进, 席高磊, 赵志伟, 毛多斌, 陈芝飞. 手性硫脲-酰胺催化1,3-二酮对硝基烯烃的不对称Michael加成反应[J]. 有机化学, 2019, 39(4): 1053-1063. |
| [15] | 张学博, 马航宇, 孙腾达, 雷鹏, 杨新玲, 张晓鸣, 凌云. 新型哌啶基肉桂醛缩氨基硫脲衍生物的设计、合成及抑菌活性研究[J]. 有机化学, 2019, 39(10): 2965-2972. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||