有机化学 ›› 2023, Vol. 43 ›› Issue (11): 3784-3805.DOI: 10.6023/cjoc202304008 上一篇 下一篇
综述与进展
收稿日期:2023-04-06
修回日期:2023-05-27
发布日期:2023-06-26
基金资助:
Huaiyuan Zhang( ), Nuo Xu, Rongping Tang, Xingli Shi
), Nuo Xu, Rongping Tang, Xingli Shi
Received:2023-04-06
Revised:2023-05-27
Published:2023-06-26
Contact:
E-mail: Supported by:文章分享

不对称去芳构化反应可以将平面、非手性的芳烃类化合物转变为具有三维结构的手性化合物, 因此该类反应成为制备手性分子、药物和天然产物的一种重要策略. 手性高价碘试剂由于具有反应条件温和、环境友好及对映选择高等优点, 被广泛用于不对称氧化反应中. 就近20年来手性高价碘试剂诱导的去芳构化反应进行综述, 根据手性骨架的不同, 分为手性乳酸酯衍生物、联萘、酒石酸、螺环、杂环, 及其他骨架如糖、[2,2]-对环芳烃和三蝶烯等, 从合成的方法、诱导的不对称反应及代表性的实例详细介绍了每类手性试剂. 此外, 还总结了手性高价碘试剂诱导的去芳构化反应在天然产物合成中的应用.
张怀远, 许诺, 唐蓉萍, 石星丽. 手性高价碘试剂诱导的不对称去芳构化反应研究进展[J]. 有机化学, 2023, 43(11): 3784-3805.
Huaiyuan Zhang, Nuo Xu, Rongping Tang, Xingli Shi. Recent Advances in Asymmetric Dearomatization Reactions Induced by Chiral Hypervalent Iodine Reagents[J]. Chinese Journal of Organic Chemistry, 2023, 43(11): 3784-3805.

| [1] |
(a) Birch, A. J. J. Chem. Soc. 1944, 430.
pmid: 30792297 |
|
(b) Birch, A. J. Pure Appl. Chem. 1996, 68, 553.
doi: 10.1351/pac199668030553 pmid: 30792297 |
|
|
(c) Heravi, M. M.; Fard, M. V.; Faghihi, Z. Curr. Org. Chem. 2015, 19, 1491.
doi: 10.2174/1385272819666150608220335 pmid: 30792297 |
|
|
(d) Peters, B. K.; Rodriguez, K. X.; Reisberg, S. H.; Beil, S. B.; Hickey, D. P.; Kawamata, Y.; Collins, M.; Starr, J.; Chen, L.; Udyavara, S.; Klunder, K.; Gorey, T. J.; Anderson, S. L.; Neurock, M.; Minteer, S. D.; Baran, P. S. Science 2019, 363, 838.
doi: 10.1126/science.aav5606 pmid: 30792297 |
|
|
(e) Chatterjee, A.; König, B. Angew. Chem., Int. Ed. 2019, 58, 14289.
doi: 10.1002/anie.v58.40 pmid: 30792297 |
|
| [2] |
(a) Buchner, E.; Curtius, T. Ber. Dtsch. Chem. Ges. 1885, 18, 2371.
doi: 10.1002/cber.v18:2 |
|
(b) Lebel, H.; Marcoux, J.-F.; Molinaro, C.; Charette, A. B. Chem. Rev. 2003, 103, 977.
doi: 10.1021/cr010007e |
|
|
(c) Reisman, S. E.; Nani, R. R.; Levin, S. Synlett 2011, 2437.
|
|
|
(d) Ford, A.; Miel, H.; Ring, A.; Slattery, C. N.; Maguire, A. R.; McKervey, M. A. Chem. Rev. 2015, 115, 9981.
doi: 10.1021/acs.chemrev.5b00121 |
|
| [3] |
(a) Reimer, K.; Tiemann, F. Ber. Dtsch. Chem. Ges. 1876, 9, 824.
doi: 10.1002/cber.v9:1 |
|
(b) Wynberg, H. Chem. Rev. 1960, 60, 169.
doi: 10.1021/cr60204a003 |
|
|
(c) Wynberg, H. Compr. Org. Synth. 1991, 2, 769.
|
|
| [4] |
(a) Nemoto, T.; Hamada, Y. J. Synth. Org. Chem.,Jpn. 2015, 73, 977.
doi: 10.5059/yukigoseikyokaishi.73.977 |
|
(b) Wu, W.-T.; Zhang, L.; You, S.-L. Chem. Soc. Rev. 2016, 45, 1570.
doi: 10.1039/C5CS00356C |
|
| [5] |
(a) Roche, S. P.; Porco Jo, J. A. Angew. Chem., Int. Ed. 2011, 50, 4068.
doi: 10.1002/anie.v50.18 |
|
(b) Zhuo, C.-X.; Zhang, W.; You, S.-L. Angew. Chem., Int. Ed. 2012, 51, 12662.
doi: 10.1002/anie.v51.51 |
|
|
(c) Abou-Hamdan, H.; Kouklovsky, C.; Vincent, G. Synlett 2020, 31, 1775.
doi: 10.1055/s-0040-1707152 |
|
|
(d) Xia, Z.-L; Xu-Xu, Q.-F.; Zheng, C.; You, S.-L. Chem. Soc. Rev. 2020, 49, 286.
doi: 10.1039/C8CS00436F |
|
| [6] |
(a) Hauser, C. R.; Van Eenam, D. N. J. Am. Chem. Soc. 1957, 79, 5512.
doi: 10.1021/ja01577a050 |
|
(b) Burdon, M. G.; Moffatt, J. G. J. Am. Chem. Soc. 1965, 87, 4656.
doi: 10.1021/ja00948a055 |
|
|
(c) Berger, R.; Ziller, J. W.; Van Vranken, D. L. J. Am. Chem. Soc. 1998, 120, 841.
doi: 10.1021/ja973734t |
|
|
(d) McComas, C. C.; Van Vranken, D. L. Tetrahedron Lett. 2003, 44, 8203.
doi: 10.1016/j.tetlet.2003.09.079 |
|
|
(e) Linton, E. C.; Kozlowski, M. C. J. Am. Chem. Soc. 2008, 130, 16162.
doi: 10.1021/ja807026z |
|
|
(f) Huang, S.; Kötzner, L.; Kanta De, C.; List, B. J. Am. Chem. Soc. 2015, 137, 3446.
doi: 10.1021/ja511200j |
|
|
(g) Peruzzi, M. T.; Lee, S. J.; Gagné, M. R. Org. Lett. 2017, 19, 6256.
doi: 10.1021/acs.orglett.7b03306 |
|
|
(h) Alshreimi, A. S.; Zhang, G.; Reidl, T. W.; Peña, R. L.; Koto, N.-G.; Islam, S. M.; Wink, D. J.; Anderson, L. L. Angew. Chem., Int. Ed. 2020, 59, 15244.
doi: 10.1002/anie.v59.35 |
|
|
(i) Shi, J.; Li, L.; Shan, C.; Wang, J.; Chen, Z.; Gu, R.; He, J.; Tan, M.; Lan, Y.; Li, Y. J. Am. Chem. Soc. 2021, 143, 2178.
doi: 10.1021/jacs.0c11119 |
|
|
(j) Hu, M.; Liu, Y.; Liang, Y.; Dong, T.; Kong, L.; Bao, M.; Wang, Z.-X.; Peng, B. Nat. Commun. 2022, 13, 4719.
doi: 10.1038/s41467-022-32426-6 |
|
| [7] |
(a) Zhuo, C.-X.; Zheng, C.; You, S.-L. Acc. Chem. Res. 2014, 47, 2558.
doi: 10.1021/ar500167f |
|
(b) Zheng, C.; You, S.-L. Chem 2016, 1, 830.
doi: 10.1016/j.chempr.2016.11.005 |
|
|
(c) Park, S.; Chang, S. Angew. Chem., Int. Ed. 2017, 56, 7720.
doi: 10.1002/anie.v56.27 |
|
|
(d) Shi, J.; Li, L.; Shan, C.; Chen, Z.; Dai, L.; Tan, M.; Lan, Y.; Li, Y. J. Am. Chem. Soc. 2021, 143, 10530.
doi: 10.1021/jacs.1c04389 |
|
| [8] |
(a) Parker, K. A.; Fokas, D. J. Am. Chem. Soc. 1992, 114, 9688.
doi: 10.1021/ja00050a075 pmid: 15831754 |
|
(b) Charest, M. G.; Lerner, C. D.; Brubaker, J. D.; Siegel, D. R.; Myers, A. G. Science 2005, 308, 395.
pmid: 15831754 |
|
|
(c) Sullivan, B.; Carrera, I.; Drouin, M.; Hudlicky, T. Angew. Chem., Int. Ed. 2009, 48, 4229.
doi: 10.1002/anie.v48:23 pmid: 15831754 |
|
|
(d) Varghese, V.; Hudlicky, T. Angew. Chem., Int. Ed. 2014, 53, 4355.
doi: 10.1002/anie.v53.17 pmid: 15831754 |
|
|
(e) Tissot, M.; Phipps, R. J.; Lucas, C.; Leon, R. M.; Pace, R. D. M.; Ngouansavanh, T.; Gaunt, M. J. Angew. Chem., Int. Ed. 2014, 53, 13498.
doi: 10.1002/anie.v53.49 pmid: 15831754 |
|
| [9] |
(a) Roche, S. P.; Tendoung, J.-J. Y.; Tréguier, B. Tetrahedron 2015, 71, 3549.
doi: 10.1016/j.tet.2014.06.054 |
|
(b) Wu, W.-T.; Zhang, L.; You, S.-L. Acta Chim. Sinica 2017, 75, 419. (in Chinese)
doi: 10.6023/A17020049 |
|
|
(吴文挺, 张立明, 游书力, 化学学报, 2017, 75, 419.)
doi: 10.6023/A17020049 |
|
|
(c) Huang, G.; Yin, B. Adv. Synth. Catal. 2019, 361, 405.
doi: 10.1002/adsc.v361.3 |
|
|
(d) Lu, L.; Zheng, Z.; Yang, Y.; Liu, B.; Yin, B. Chin. J. Chem. 2021, 39, 2207.
doi: 10.1002/cjoc.v39.8 |
|
| [10] |
(a) Southgate, E. H.; Pospech, J.; Fu, J.; Holycross, D. R.; Sarlah, D. Nat. Chem. 2016, 8, 922.
doi: 10.1038/nchem.2594 pmid: 32383862 |
|
(b) Hernandez, L. W.; Pospech, J.; Klöckner, U.; Bingham, T. W.; Sarlah, D. J. Am. Chem. Soc. 2017, 139, 15656.
doi: 10.1021/jacs.7b10351 pmid: 32383862 |
|
|
(c) Southgate, E. H.; Holycross, D. R.; Sarlah, D. Angew. Chem., Int. Ed. 2017, 56, 15049
doi: 10.1002/anie.v56.47 pmid: 32383862 |
|
|
(d) Hernandez, L. W.; Klöckner, U.; Pospech, J.; Hauss, L.; Sarlah, D. J. Am. Chem. Soc. 2018, 140, 4503.
doi: 10.1021/jacs.8b01726 pmid: 32383862 |
|
|
(e) Bingham, T. W.; Hernandez, L. W.; Olson, D. G.; Svec, R. L.; Hergenrother, P. J.; Sarlah, D. J. Am. Chem. Soc. 2019, 141, 657.
doi: 10.1021/jacs.8b12123 pmid: 32383862 |
|
|
(f) Siddiqi, Z.; Wertjes, W. C.; Sarlah, D. J. Am. Chem. Soc. 2020, 142, 10125.
doi: 10.1021/jacs.0c02724 pmid: 32383862 |
|
|
(g) Ito, T.; Harada, S.; Homma, H.; Takenaka, H.; Hirose, S.; Nemoto, T. J. Am. Chem. Soc. 2021, 143, 604.
doi: 10.1021/jacs.0c10682 pmid: 32383862 |
|
| [11] |
(a) Oguma, T.; Katsuki, T. J. Am. Chem. Soc. 2012, 134, 20017.
doi: 10.1021/ja310203c pmid: 25853771 |
|
(b) Zheng, J.; Wang, S.-B.; Zheng, C.; You, S.-L. J. Am. Chem. Soc. 2015, 137, 4880.
doi: 10.1021/jacs.5b01707 pmid: 25853771 |
|
|
(c) Nan, J.; Liu, J.; Zheng, H.; Zuo, Z.; Hou, L.; Hu, H.; Wang, Y.; Luan, X. Angew. Chem., Int. Ed. 2015, 54, 2356.
doi: 10.1002/anie.v54.8 pmid: 25853771 |
|
|
(d) Wu, W.-T.; Xu, R.-Q.; Zhang, L.; You, S.-L. Chem. Sci. 2016, 7, 3427.
doi: 10.1039/C5SC04130A pmid: 25853771 |
|
|
(e) Cheng, Q.; Wang, Y.; You, S.-L. Angew. Chem., Int. Ed. 2016, 55, 3496.
doi: 10.1002/anie.v55.10 pmid: 25853771 |
|
|
(f) Shen, D.; Chen, Q.; Yan, P.; Zeng, X.; Zhong, G. Angew. Chem., Int. Ed. 2017, 56, 3242.
doi: 10.1002/anie.v56.12 pmid: 25853771 |
|
|
(g) Xu, R.-Q.; Yang, P.; You, S.-L. Chem. Commun. 2017, 53, 7553.
doi: 10.1039/C7CC04022A pmid: 25853771 |
|
|
(h) An, J.; Parodi, A.; Monari, M.; Reis, M. C.; Lopez, C. S.; Bandini, M. Chem.-Eur. J. 2017, 23, 17473.
doi: 10.1002/chem.v23.69 pmid: 25853771 |
|
|
(i) An, J.; Lombardi, L.; Grilli, S.; Bandini, M. Org. Lett. 2018, 20, 7380.
doi: 10.1021/acs.orglett.8b03018 pmid: 25853771 |
|
|
(j) Pedrazzani, R.; An, J.; Monari, M; Bandini, M. Eur. J. Org. Chem. 2021, 2021, 1732.
doi: 10.1002/ejoc.v2021.11 pmid: 25853771 |
|
| [12] |
(a) Yin, Q.; Wang, S.-G.; Liang, X.-W.; Gao, D.-W.; Zheng, J.; You, S.-L. 2015, 6, 4179.
|
|
(b) Zhu, G.; Bao, G.; Li, Y.; Yang, J.; Sun, W.; Li, J.; Hong, L.; Wang, R. Org. Lett. 2016, 18, 5288
doi: 10.1021/acs.orglett.6b02609 |
|
|
(c) Xia, Z.-L.; Zheng, C.; Xu, R.-Q.; You, S.-L. Nat. Commun. 2019, 10, 3150.
doi: 10.1038/s41467-019-11109-9 |
|
|
(d) Yang, B.; Zhai, X.; Feng, S.; Hu, D.; Deng, Y.; Shao, Z. Org. Lett. 2019, 21, 330.
doi: 10.1021/acs.orglett.8b03934 |
|
| [13] |
Lewis, S. E. In Asymmetric Dearomatization Reactions, Ed.: You, S.-L., Wiley-VCH, Weinheim, 2016, pp. 279-346.
|
| [14] |
(a) Wirth, T. Hypervalent Iodine Chemistry in Topics in Current Chemistry, Vol. 373, Springer, Switzerland, 2016.
|
|
(b) Wirth, T. Angew. Chem., nt. Ed. 2005, 44, 3656.
|
|
|
(c) Zheng, Z. S.; Zhang-Negrerie, D.; Du, Y. F.; Zhao, K. Sci. China: Chem. 2014, 57, 189.
doi: 10.1007/s11430-013-4635-0 |
|
|
(d) Liu, D.; He, J.; Zhang, C. Univ. Chem. 2019, 34, 1. (in Chinese)
|
|
|
(刘丹, 贺家豪, 张弛, 大学化学, 2019, 34, 1.)
|
|
|
(e) Zhdankin, V. V. ARKIVOC 2020, iv, 1.
|
|
|
(f) Zhang, D.; Shao, Y.; Zheng, H.; Zhou, B.; Xue, X.-S. Acta Chim. Sinica 2021, 79, 1394. (in Chinese)
doi: 10.6023/A21080358 |
|
|
(张丹琪, 邵英博, 郑汉良, 周碧莹, 薛小松, 化学学报, 2021, 79, 1394.)
doi: 10.6023/A21080358 |
|
| [15] |
(a) Mizar, P.; Wirth, T. Angew. Chem., Int. Ed. 2014, 53, 5993.
doi: 10.1002/anie.v53.23 pmid: 26378799 |
|
(b) Suzuki, S.; Kamo, T.; Fukushi, K.; Hiramatsu, T.; Tokunaga, E.; Dohi, T.; Kita, Y.; Shibata, N. Chem. Sci. 2014, 5, 2754.
doi: 10.1039/C3SC53107D pmid: 26378799 |
|
|
(c) Brenet, S.; Minozzi, C.; Clarens, B.; Amiri, L.; Berthiol, F. Synthesis 2015, 47, 3859.
doi: 10.1055/s-00000084 pmid: 26378799 |
|
|
(d) Basdevant, B.; Legault, C. Y. Org. Lett. 2015, 17, 4918.
doi: 10.1021/acs.orglett.5b02501 pmid: 26378799 |
|
|
(e) Cao, Y.; Zhang, X.; Lin, G.; Zhang-Negrerie, D.; Du, Y. Org. Lett. 2016, 18, 5580.
doi: 10.1021/acs.orglett.6b02816 pmid: 26378799 |
|
|
(f) Pluta, R.; Krach, P. E.; Cavallo, L.; Falivene, L.; Rueping, M. ACS Catal. 2018, 8, 2582.
doi: 10.1021/acscatal.7b03118 pmid: 26378799 |
|
|
(g) Wang, Y.; Yuan, H.; Lu, H.; Zheng, W.-H. Org. Lett. 2018, 20, 2555.
doi: 10.1021/acs.orglett.8b00711 pmid: 26378799 |
|
| [16] |
(a) Silva, Jr., L. F.; Olofsson, B. Nat. Prod. Rep. 2011, 28, 1722.
doi: 10.1039/c1np00028d pmid: 21829843 |
|
(b) Maertens, G.; L’Homme, C.; Canesi, S. Front. Chem. 2015, 2, 1.
pmid: 21829843 |
|
| [17] |
(a) Zhang, H.; Su, Y.; Wang, K.-H.; Huang, D.; Li, J.; Hu, Y. Org. Biomol. Chem. 2017, 15, 5337.
doi: 10.1039/C7OB00855D |
|
(b) Zhang, H.; Huang, D.; Wang, K.-H.; Li, J.; Su, Y.; Hu, Y. J. Org. Chem. 2017, 82, 1600.
doi: 10.1021/acs.joc.6b02781 |
|
|
(c) Zhang, H.; Wang, K.-H.; Wang, J.; Su, Y.; Huang, D.; Hu, Y. Org. Biomol. Chem. 2019, 17, 2940.
doi: 10.1039/C9OB00236G |
|
|
(d) Zhang, H.; Cormanich, R. A.; Wirth, T. Chem.-Eur. J. 2022, 28, e202103623.
doi: 10.1002/chem.v28.5 |
|
|
(e) Zhang, H.; Wirth, T. Chem.-Eur. J. 2022, 28, e202200181.
doi: 10.1002/chem.v28.21 |
|
| [18] |
(a) Zhdankin, V. V.; Stang, P. J. Chem. Rev. 2002, 102, 2523.
pmid: 34334960 |
|
(b) Merritt, E. A.; Olofsson, B. Angew. Chem., Int. Ed. 2009, 48, 9052.
doi: 10.1002/anie.v48:48 pmid: 34334960 |
|
|
(c) Parra, A. Chem. Rev. 2019, 119, 12033.
doi: 10.1021/acs.chemrev.9b00338 pmid: 34334960 |
|
|
(d) Xiao, X.; Wengryniuk, S. E. Synlett 2021, 32, 752.
doi: 10.1055/s-0037-1610760 pmid: 34334960 |
|
|
(e) Singh, F. V.; Shetgaonkar, S. E.; Krishnan, M.; Wirth, T. Chem. Soc. Rev. 2022, 51, 8102.
doi: 10.1039/D2CS00206J pmid: 34334960 |
|
|
(f) Kumar, R.; Singh, F. V.; Takenaga, N.; Dohi, T. Chem.-Asian J. 2022, 17, e202101115.
doi: 10.1002/asia.v17.4 pmid: 34334960 |
|
| [19] |
Uyanik, M.; Yasui, T.; Ishihara, K. Angew. Chem., Int. Ed. 2010, 49, 2175.
doi: 10.1002/anie.v49:12 |
| [20] |
Uyanik, M.; Yasui, T.; Ishihara, K. Angew. Chem., Int. Ed. 2013, 52, 9215.
doi: 10.1002/anie.v52.35 |
| [21] |
Haubenreisser, S.; Wöste, T. H.; Martínez, C.; Ishihara, K.; Muniz, K. Angew. Chem., Int. Ed. 2016, 55, 413.
doi: 10.1002/anie.v55.1 |
| [22] |
Dohi, T.; Maruyama, A.; Takenaga, N.; Senami, K.; Minamitsuji, Y.; Fujioka, H.; Caemmerer, S. B.; Kita, Y. Angew. Chem., Int. Ed. 2008, 47, 3787.
doi: 10.1002/anie.v47:20 |
| [23] |
Uyanik, M.; Yasui, T.; Ishihara, K. Tetrahedron 2010, 66, 5841.
doi: 10.1016/j.tet.2010.04.060 |
| [24] |
X-Ray structure acquired from Cambridge Crystallographic Database (CCDC 917160).
|
| [25] |
Zhang, D.-Y.; Xu, L.; Wu, H.; Gong, L.-Z. Chem.-Eur. J. 2015, 21, 10314.
doi: 10.1002/chem.v21.29 |
| [26] |
Yoshida, Y.; Magara, A.; Mino, T.; Sakamoto, M. Tetrahedron Lett. 2016, 57, 5103.
doi: 10.1016/j.tetlet.2016.10.016 |
| [27] |
Boppisetti, J. K.; Birman, V. B. Org. Lett. 2009, 11, 1221.
doi: 10.1021/ol8029092 pmid: 19231848 |
| [28] |
Uyanik, M.; Sasakura, N.; Mizuno, M.; Ishihara, K. ACS Catal. 2017, 7, 872.
doi: 10.1021/acscatal.6b03380 |
| [29] |
Jain, N.; Xu, S.; Ciufolini, M. A. Chem.-Eur. J. 2017, 23, 4542.
doi: 10.1002/chem.v23.19 |
| [30] |
Jain, N.; Ciufolini, M. A. Synthesis 2018, 50, 3322.
doi: 10.1055/s-0037-1610214 |
| [31] |
Jain, N.; Hein, J. E.; Ciufolini, M. A. Synlett 2019, 30, 1222.
doi: 10.1055/s-0037-1611831 |
| [32] |
Uyanik, M.; Yasui, T.; Ishihara, K. J. Org. Chem. 2017, 82, 11946.
doi: 10.1021/acs.joc.7b01941 |
| [33] |
Muñiz, K.; Fra, L. Synthesis 2017, 49, 2901.
doi: 10.1055/s-0036-1588808 |
| [34] |
Volp, K. A.; Harned, A. M. Chem. Commun. 2013, 49, 3001.
doi: 10.1039/c3cc00013c |
| [35] |
Hashimoto, T.; Shimazaki, Y.; Omatsu, Y.; Maruoka, K. Angew. Chem., Int. Ed. 2018, 57, 7200.
doi: 10.1002/anie.v57.24 |
| [36] |
Shimazaki, Y.; Wata, C.; Hashimoto, T.; Maruoka, K. Asian J. Org. Chem. 2021, 10, 1638.
doi: 10.1002/ajoc.v10.7 |
| [37] |
Zheng, H.; Cai, L.; Pan, M.; Uyanik, M.; Ishihara, K.; Xue, X.-S. J. Am. Chem. Soc. 2023, 145, 7301.
doi: 10.1021/jacs.2c13295 |
| [38] |
Quideau, S.; Lyvinec, G.; Marguerit, M.; Bathany, K.; Ozanne- Beaudenon, A.; Buffeteau, T.; Cavagnat, D.; Chenede, A. Angew. Chem., Int. Ed. 2009, 48, 4605.
doi: 10.1002/anie.v48:25 |
| [39] |
Bosset, C.; Coffinier, R.; Peixoto, P. A.; El Assal, M.; Miqueu, K.; Sotiropoulos, J. M.; Pouysegu, L.; Quideau, S. Angew. Chem., Int. Ed. 2014, 53, 9860.
doi: 10.1002/anie.v53.37 |
| [40] |
Bekkaye, M.; Masson, G. Synthesis 2016, 48, 302.
doi: 10.1055/s-00000084 |
| [41] |
Dohi, T.; Sasa, H.; Miyazaki, K.; Fujitake, M.; Takenaga, N.; Kita, Y. J. Org. Chem. 2017, 82, 11954.
doi: 10.1021/acs.joc.7b02037 |
| [42] |
Ogasawara, M.; Sasa, H.; Hu, H.; Amano, Y.; Nakajima, H.; Takenaga, N.; Nakajima, K.; Kita, Y.; Takahashi, T.; Dohi, T. Org. Lett. 2017, 19, 4102.
doi: 10.1021/acs.orglett.7b01876 |
| [43] |
Kürti, L.; Herczegh, P.; Visy, J.; Simonyi, M.; Antus, S.; Pelter, A. J. Chem. Soc., Perkin Trans. 1999, 1, 379.
|
| [44] |
Dohi, T.; Takenaga, N.; Nakae, T.; Toyoda, Y.; Yamasaki, Y.; Shiro, M.; Fujioka, H.; Maruyama, A.; Kita, Y. J. Am. Chem. Soc. 2013, 135, 4558.
doi: 10.1021/ja401074u |
| [45] |
Zheng, H.; Sang, Y.; Houk, K. N.; Xue, X.-S.; Cheng, J.-P. J. Am. Chem. Soc. 2019, 141, 16046.
doi: 10.1021/jacs.9b08243 |
| [46] |
Hempel, C.; Maichle-Mössmer, C.; Pericàs, M. A.; Nachtsheim, B. J. Adv. Synth. Catal. 2017, 359, 2931.
doi: 10.1002/adsc.v359.17 |
| [47] |
Abazid, A. H.; Nachtsheim, B. J. Angew. Chem., Int. Ed. 2020, 59, 1479.
doi: 10.1002/anie.v59.4 |
| [48] |
Murray, S. J.; Ibrahim, H. Chem. Commun. 2015, 51, 2376.
doi: 10.1039/C4CC09724F |
| [49] |
Antien, K.; Pouysegu, L.; Deffieux, D.; Massip, S.; Peixoto, P. A.; Óuideau, S. Chem.-Eur. J. 2019, 25, 2852.
doi: 10.1002/chem.201805761 pmid: 30589145 |
| [50] |
Wang, Y.; Zhao, C.-Y.; Wang, Y.-P.; Zheng, W.-H. Synthesis 2019, 51, 3675.
doi: 10.1055/s-0037-1611902 |
| [51] |
Imrich, M. R.; Ziegler, T. Tetrahedron Lett. 2019, 60, 150954.
doi: 10.1016/j.tetlet.2019.150954 |
| [52] |
Imrich, M. R.; Biehler, L. E.; Maichle-Mössmer, C.; Ziegler, T. Molecules 2019, 24, 3883.
doi: 10.3390/molecules24213883 |
| [53] |
Tariq, M. U.; Moran, W. J. Tetrahedron 2020, 76, 131634.
doi: 10.1016/j.tet.2020.131634 |
| [54] |
Yang, G.-H.; Zheng, H.; Li, X.; Cheng, J.-P. ACS Catal. 2020, 10, 2324.
doi: 10.1021/acscatal.9b05443 |
| [55] |
Khan, N.; Itaya, K.; Wirth, T. ChemistryOpen 2022, 11, e202200145.
doi: 10.1002/open.v11.7 |
| [56] |
Coffinier, R.; El Assal, M.; Peixoto, P. A.; Bosset, C.; Miqueu, K.; Sotiropoulos, J.-M.; Pouysegu, L.; Quideau, S. Org. Lett. 2016, 18, 1120.
doi: 10.1021/acs.orglett.6b00224 pmid: 26907848 |
| [57] |
Zdero, C.; Bohlmann, F.; Niemeyer, H. M. Phytochemistry 1991, 30, 1597.
doi: 10.1016/0031-9422(91)84215-E |
| [58] |
Bérubé, A.; Drutu, I.; Wood, J. L. Org. Lett. 2006, 8, 5421.
doi: 10.1021/ol061737h |
| [59] |
El Assal, M.; Peixoto, P. A.; Coffinier, R.; Garnier, T.; Deffieux, D.; Miqueu, K.; Sotiropoulos, J.-M.; Pouységu, L.; Quideau, S. J. Org. Chem. 2017, 82, 11816.
doi: 10.1021/acs.joc.7b02366 |
| [60] |
Tanaka, M.; Nara, F.; Suzuki-Konagai, K.; Hosoya, T.; Ogita, T. J. Am. Chem. Soc. 1997, 119, 7871.
doi: 10.1021/ja9713385 |
| [61] |
Saito, S.; Tanaka, N.; Fujimoto, K.; Kogen, H. Org. Lett. 2000, 2, 505.
pmid: 10814362 |
| [62] |
Nara, F.; Tanaka, M.; Hosoya, T.; Suzuki-Konagai, K.; Ogita, T. J. Antibiot. 1999, 52, 525.
pmid: 10470675 |
| [63] |
Nara, F.; Tanaka, M.; Masuda-Inoue, S.; Yamasato, Y.; Doi-Yoshio- ka, H.; Suzuki-Konagai, K.; Kumakura, S.; Ogita, T. J. Antibiot. 1999, 52, 531.
pmid: 10470676 |
| [64] |
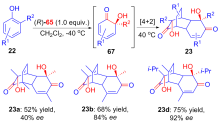
Suzuki, T.; Watanabe, S.; Uyanik, M.; Ishihara, K.; Kobayashi, S.; Tanino, K. Org. Lett. 2018, 20, 3919.
doi: 10.1021/acs.orglett.8b01502 |
| [65] |
Adeboya, M. O.; Edwards, R. L.; Lassøe, T.; Maitland, D. J.; Shields, L.; Whalley, A. J. S. J. Chem. Soc., Perkin Trans. 1 1996, 1419.
|
| [66] |
Liu, L.; Han, Y.; Xiao, J.; Li, L.; Guo, L.; Jiang, X.; Kong, L.; Che, Y. J. Nat. Prod. 2016, 79, 2616.
doi: 10.1021/acs.jnatprod.6b00550 |
| [67] |
Pan, Y.; Liu, L.; Guan, F.; Li, E.; Jin, J.; Li, J.; Che, Y.; Liu, G. ACS Chem. Biol. 2018, 13, 703.
doi: 10.1021/acschembio.7b01059 |
| [1] | 于士航, 刘嘉威, 安碧玉, 边庆花, 王敏, 钟江春. 黑腹尼虎天牛接触性信息素的不对称合成[J]. 有机化学, 2024, 44(1): 301-308. |
| [2] | 王化坤, 任晓龙, 宣宜宁. 卤盐催化的α,β-环氧羧酸酯与异氰酸酯[3+2]环加成反应研究[J]. 有机化学, 2024, 44(1): 251-258. |
| [3] | 丁卫忠, 张炳文, 薛彦青, 林雨琦, 汤志军, 王婧, 杨文超, 王晓峰, 刘文. 禾谷镰刀菌中一个新的聚酮类化合物[J]. 有机化学, 2023, 43(9): 3319-3322. |
| [4] | 吴秀蓉, 肖朝江, 沈怡, 汤红霞, 朱俊逸, 姜北. 植物来源抗疟倍半萜类天然产物研究(1972~2022)[J]. 有机化学, 2023, 43(8): 2764-2789. |
| [5] | 王玉超, 刘晋彪, 何智涛. 钯催化共轭二烯的不对称氢官能团化[J]. 有机化学, 2023, 43(8): 2614-2627. |
| [6] | 宋亭谕, 李冉, 黄利华, 贾世琨, 梅光建. N—N单键阻转异构体的催化不对称合成[J]. 有机化学, 2023, 43(6): 1977-1990. |
| [7] | 罗诚, 尹艳丽, 江智勇. P-手性膦氧化物的不对称合成研究进展[J]. 有机化学, 2023, 43(6): 1963-1976. |
| [8] | 蒙玲, 汪君. 硫代黄烷酮类衍生物的合成研究进展[J]. 有机化学, 2023, 43(3): 873-891. |
| [9] | 匡鑫, 丁昌华, 吴奕晨, 王鹏. 手性烯丙基硅烷的催化对映选择性合成[J]. 有机化学, 2023, 43(10): 3367-3387. |
| [10] | 濮留洋, 李芷悦, 李利民, 马玉翠, 马民, 胡胜全, 吴正治. 秋水仙碱及其天然类似物(–)-N-乙酰秋水酚甲醚的不对称合成[J]. 有机化学, 2023, 43(1): 313-319. |
| [11] | 姚良才, 桂敬汉. 自由基多烯环化反应在天然产物全合成中的应用[J]. 有机化学, 2022, 42(9): 2703-2714. |
| [12] | 孔祥凯, 张逸鹏, 党菱婧, 陈文, 张洪彬. 吲哚生物碱Vindoline与Vindorosine的合成研究进展[J]. 有机化学, 2022, 42(9): 2728-2744. |
| [13] | 高冉, 田伟生. 苦楝甾醇及2α,3α,20R-三羟基孕甾-16β-甲基丙烯酸酯的合成[J]. 有机化学, 2022, 42(8): 2521-2526. |
| [14] | 毛沅浩, 高延峰, 苗志伟. 过渡金属催化不对称环化反应合成七元环化合物研究进展[J]. 有机化学, 2022, 42(7): 1904-1924. |
| [15] | 石发胜, 王圣文, 徐欢, 路星星, 杨新玲, 孙腾达, 王长凯, 张晓鸣, 杨青, 凌云. 新型缩氨基硫脲类化合物的设计、合成及杀菌活性研究[J]. 有机化学, 2022, 42(7): 2106-2116. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||