有机化学 ›› 2023, Vol. 43 ›› Issue (11): 3713-3727.DOI: 10.6023/cjoc202305014 上一篇 下一篇
综述与进展
收稿日期:2023-05-13
修回日期:2023-06-26
发布日期:2023-07-12
文章分享

近年来通过二氧化硫插入合成磺酰类化合物的合成方法受到了研究者的关注. 多种二氧化硫替代物参与的磺酰化反应被相继报道, 并成功用于多种磺酰类化合物如砜、磺酰氟和磺酰胺等的合成. 其中部分二氧化硫替代物展现出了双功能的作用——既作为二氧化硫源用于构建磺酰基, 又作为体系中的还原剂. 具有还原性的二氧化硫阴离子自由基在这些反应中起到了关键作用, 提高了磺酰化反应的效率和原子经济性. 重点介绍了近年来这类双功能二氧化硫替代物在磺酰类化合物合成中的研究进展.
吴宇恒, 颜岩, 寮渭巍. 双功能二氧化硫替代物在合成磺酰类化合物中的研究进展[J]. 有机化学, 2023, 43(11): 3713-3727.
Yuheng Wu, Yan Yan, Weiwei Liao. Recent Advances of Bifunctional Sulfur Dioxide Surrogates in Synthesis of Sulfonyl Compounds[J]. Chinese Journal of Organic Chemistry, 2023, 43(11): 3713-3727.

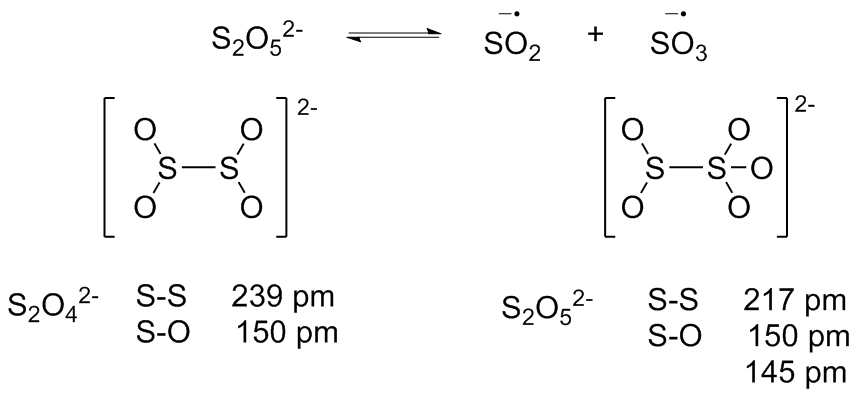

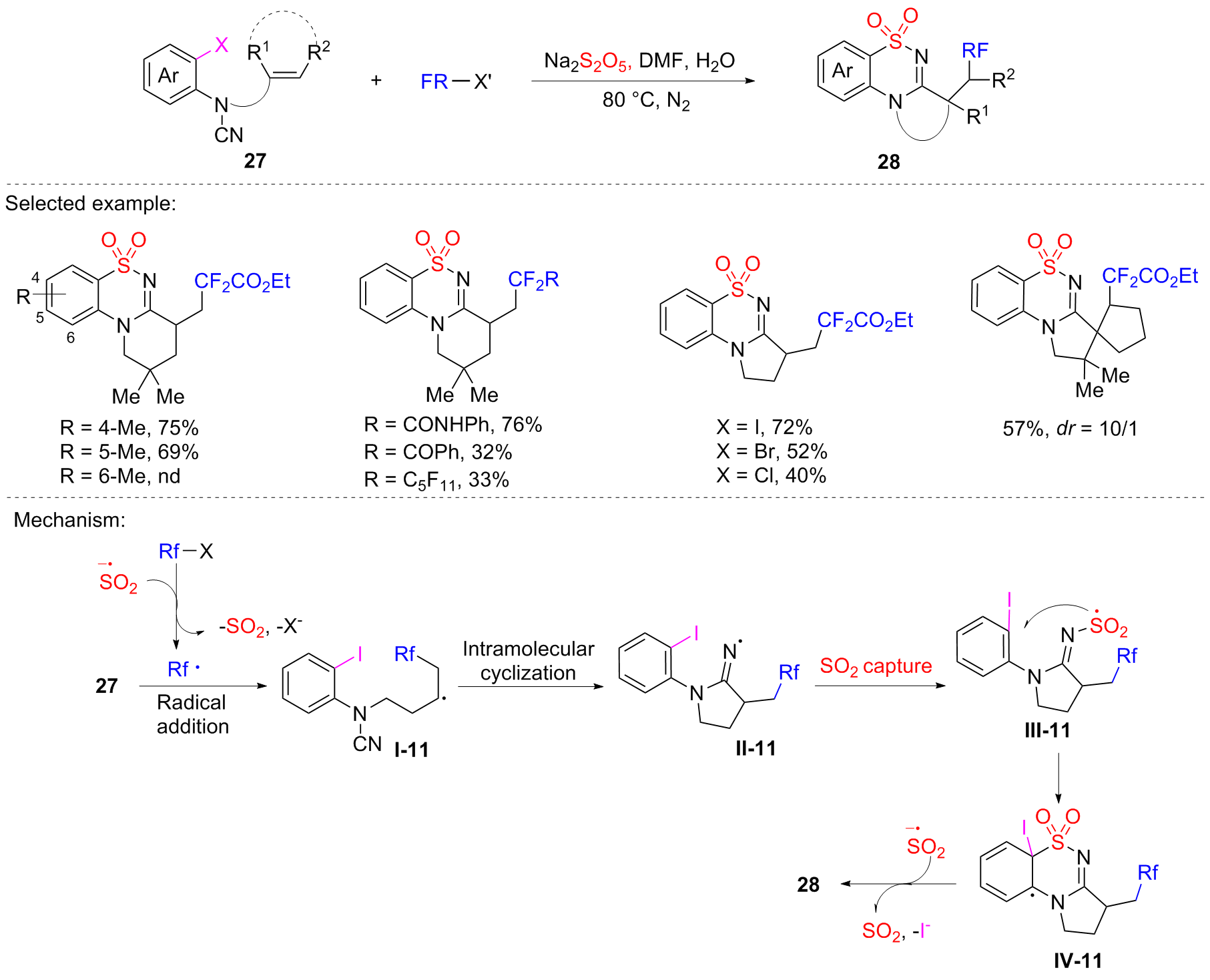
| [1] |
(a) Devendar, P.; Yang, G.-F. Top. Curr. Chem. 2017, 375, 82.
|
|
(b) Mustafa, M.; Winum, J.-Y. Expert Opin. Drug Discovery 2022, 17, 501.
doi: 10.1080/17460441.2022.2044783 |
|
|
(c) Chen, S.-Y.; G, W.; Fu, Y.-Z. Chem. Res. Chin. Univ. 2023, 44, 178. (in Chinese)
|
|
|
(任思远, 郭玮, 付永柱, 高等学校化学学报, 2023, 44, 178.)
|
|
| [2] |
Serafini, M.; Cargnin, S.; Massarotti, A.; Pirali, T.; Genazzani, A. A. J. Med. Chem. 2020, 63, 10170.
doi: 10.1021/acs.jmedchem.0c00415 pmid: 32352778 |
| [3] |
Das, P.; Delost, M. D.; Qureshi, M. H.; Smith, D. T.; Njardarson, J. T. J. Med. Chem. 2019, 62, 4265.
doi: 10.1021/acs.jmedchem.8b01610 |
| [4] |
Ahmad, I.; Shagufta Int. J. Pharm. Pharm. Sci. 2015, 7, 19.
|
| [5] |
Cao, S.; Murphy, B. T.; Foster, C.; Lazo, J. S.; Kingston, D. G. Bioorg. Med. Chem. 2009, 17, 2276.
doi: 10.1016/j.bmc.2008.10.090 |
| [6] |
Mitchell, G.; Bartlett, D. W.; Fraser, T. E. M.; Hawkes, T. R.; Holt, D. C.; Townson, J. K.; Wichert, R. A. Pest Manage. Sci. 2001, 57, 120.
doi: 10.1002/(ISSN)1526-4998 |
| [7] |
(a) Vree, T. B.; Van Der Ven André, J. A. M. J. Pharm. Pharmacol. 2010, 51, 239.
doi: 10.1211/0022357991772402 |
|
(b) Kondrack, R.; Mohiuddin, S. Expert. Opin. Drug Metab. Toxicol. 2009, 5, 1125.
doi: 10.1517/17425250903136730 |
|
| [8] |
Krasselt, M.; Baerwald, C. Expert Opin Pharmacol. 2019, 20, 1689.
doi: 10.1080/14656566.2019.1645123 |
| [9] |
Nguyen, B.; Emmett, E. J.; Willis, M. C. J. Am. Chem. Soc. 2010, 132, 16372.
doi: 10.1021/ja1081124 pmid: 21028814 |
| [10] |
(a) Santos, P. S.; Mello, M. T. S. J. Mol. Struct. 1988, 178, 121.
doi: 10.1016/0022-2860(88)85010-5 pmid: 35170616 |
|
(b) Seyed Hashtroudi, M.; Fathi Vavsari, V.; Balalaie, S. Org. Biomol. Chem. 2022, 20, 2149.
doi: 10.1039/d1ob02199k pmid: 35170616 |
|
|
(c) Sahoo, A. K.; Dahiya, A.; Rakshit, A.; Patel, B. K. SynOpen 2021, 05, 232.
doi: 10.1055/a-1577-9755 pmid: 35170616 |
|
|
(d) Kotha, S.; Khedkar, P. Chem. Rev. 2012, 112, 1650.
doi: 10.1021/cr100175t pmid: 35170616 |
|
|
(e) Ye, S.; Qiu, G.; Wu, J. Chem. Commun. 2019, 55, 1013.
doi: 10.1039/C8CC09250H pmid: 35170616 |
|
|
(f) Ye, S.; Yang, M.; Wu, J. Chem. Commun. (Camb.) 2020, 56, 4145.
doi: 10.1039/D0CC01775B pmid: 35170616 |
|
|
(g) Ali, R. ChemistrySelect 2020, 5, 10795.
doi: 10.1002/slct.v5.34 pmid: 35170616 |
|
|
(h) He, F.-S.; Yang, M.; Ye, S.-Q.; Wu, J. Chin. Chem. Lett. 2021, 32, 461.
doi: 10.1016/j.cclet.2020.04.043 pmid: 35170616 |
|
|
(i) Wang, M.; Jiang, X. Chem. Record 2021.
pmid: 35170616 |
|
|
(j) Zeng, D.; Wang, M.; Deng, W.-P.; Jiang, X. Org. Chem. Front. 2020, 7, 3956.
doi: 10.1039/D0QO00987C pmid: 35170616 |
|
| [11] |
Khelili, S.; Kihal, N.; Yekhlef, M.; De Tullio, P.; Lebrun, P.; Pirotte, B. Eur. J. Med. Chem. 2012, 54, 873.
doi: 10.1016/j.ejmech.2012.05.011 pmid: 22647221 |
| [12] |
Shalimov, A. A.; Chudakova, T. I.; Vlasenko, Y. G.; Sinitsa, A. D.; Onys’ko, P. P. Chem. Heterocycl. Compd. 2016, 52, 267.
doi: 10.1007/s10593-016-1873-z |
| [13] |
Manisalidis, I.; Stavropoulou, E.; Stavropoulos, A.; Bezirtzoglou, E. Front Public Health 2020, 8.
|
| [14] |
Zhang, C.-P.; Chen, Q.-Y.; Guo, Y.; Xiao, J.-C.; Gu, Y.-C. Chem. Soc. Rev. 2012, 41, 4536.
doi: 10.1039/c2cs15352a |
| [15] |
Qiu, G.; Zhou, K.; Wu, J. Chem. Commun. 2018, 54, 12561.
doi: 10.1039/C8CC07434H |
| [16] |
Li, Y.-W.; Liu, T.; Qiu, G.-Y.-S.; Wu, J. Adv. Synth. Catal. 2019, 361, 1154.
doi: 10.1002/adsc.v361.5 |
| [17] |
Li, Y.; Chen, S.; Wang, M.; Jiang, X.-F. Angew. Chem., Int. Ed. 2020, 59, 8907.
doi: 10.1002/anie.v59.23 |
| [18] |
Li, Y.; Wang, M.; Jiang, X.-F. Org. Lett. 2021, 23, 4657.
doi: 10.1021/acs.orglett.1c01393 |
| [19] |
Liu, Y.; Lin, Q.; Xiao, Z.; Zheng, C.; Guo, Y.; Chen, Q. Y.; Liu, C. Chem.-Eur. J. 2019, 25, 1824.
doi: 10.1002/chem.v25.7 |
| [20] |
Ma, Z.-H.; Liu, Y.-A.; Ma, X.-Y.; Hu, X.-J.; Guo, Y.; Chen, Q.-Y.; Liu, C. Org. Chem. Front. 2022, 9, 1115.
doi: 10.1039/D1QO01655E |
| [21] |
Wu, F.-H. H., B.-N.; Huang, W.-Y. Chin. J. Org. Chem. 1993, 13, 449. (in Chinese)
|
|
(吴范宏, 黄炳南, 黄维垣, 有机化学, 1993, 13, 449.)
|
|
| [22] |
Huang, B.-N. W., F.-H., Zhou, C.-M. In the 7th National Conference on Spectroscopy, Zhengzhou, 1992, p. 527. (in Chinese)
|
|
(黄炳南, 吴范宏, 周澄明, 第七届全国波谱学学术会议, 郑州, 1992, p. 527.)
|
|
| [23] |
You, G.; Xi, D.; Sun, J.; Hao, L.; Xia, C. Org. Biomol. Chem. 2019, 17, 9479.
doi: 10.1039/C9OB02106J |
| [24] |
Huang, C.-M.; Li, J.; Wang, S.-Y.; Ji, S.-J. Chin. Chem. Lett. 2020, 31, 1923.
doi: 10.1016/j.cclet.2019.12.032 |
| [25] |
Zhong, T.; Pang, M.-K.; Chen, Z.-D.; Zhang, B.; Weng, J.; Lu, G. Org. Lett. 2020, 22, 3072.
doi: 10.1021/acs.orglett.0c00823 pmid: 32227908 |
| [26] |
Liu, S.; Huang, Y.-G.; Xu, X.-H.; Qing, F.-L. J. Fluorine Chem. 2020, 240, 109653.
doi: 10.1016/j.jfluchem.2020.109653 |
| [27] |
He, F.-S.; Yao, Y.-F.; Xie, W.-L.; Wu, J. Adv. Synth. Catal. 2020, 362, 4744.
doi: 10.1002/adsc.v362.21 |
| [28] |
Yao, Y.-F.; Yin, Z.-Q.; Chen, W.-Y.; Xie, W.-L.; He, F. S.; Wu, J. Adv. Synth. Catal. 2020, 363, 570.
doi: 10.1002/adsc.v363.2 |
| [29] |
Huang, J. P. A.; Ding, F.; Chen, Z.-Y.; Yang, G.-G.; Wu, J. Org. Chem. Front. 2021, 8, 1461.
doi: 10.1039/D0QO01546F |
| [30] |
Chen, K.; Chen, W.; Han, B.; Chen, W.; Liu, M.; Wu, H. Org. Lett. 2020, 22, 1841.
doi: 10.1021/acs.orglett.0c00183 pmid: 32073282 |
| [31] |
Li, Y.-P.; Wang, M.; Jiang, X.-F. Chin. J. Chem. 2020, 38, 1521.
doi: 10.1002/cjoc.v38.12 |
| [32] |
Wang, M.; Chen, S.; Jiang, X.-F. Org. Lett. 2017, 19, 4916.
doi: 10.1021/acs.orglett.7b02388 |
| [33] |
Wu, Y.-H.; Li, C.-J.; Wei, Z.-L.; Liao, W.-W. Org. Lett. 2022, 24, 9112.
doi: 10.1021/acs.orglett.2c03771 |
| [34] |
Shavnya, A.; Coffey, S. B.; Hesp, K. D.; Ross, S. C.; Tsai, A. S. Org. Lett. 2016, 18, 5848.
pmid: 27788009 |
| [35] |
Zhang, W.; Luo, M.-M. Chem. Commun. 2016, 52, 2980.
doi: 10.1039/C5CC09830K |
| [36] |
Wang, M.; Tang, B.-C.; Wang, J.-G.; Xiang, J.-C.; Guan, A.-Y.; Huang, P.-P.; Guo, W.-Y.; Wu, Y.-D.; Wu, A.-X. Chem. Commun. 2018, 54, 7641.
doi: 10.1039/C8CC03778G |
| [37] |
Nguyen, V. D.; Nguyen, V. T.; Haug, G. C.; Dang, H. T.; Arman, H. D.; Ermler, W. C.; Larionov, O. V. ACS Catal. 2019, 9, 4015.
doi: 10.1021/acscatal.9b00464 |
| [38] |
He, F.-S.; Zhang, M.; Zhang, M.-K.; Luo, X.-X.; Wu, J. Org. Chem. Front. 2021, 8, 3746.
doi: 10.1039/D1QO00556A |
| [39] |
Chen, X.-L.; Wu, C.-Y.; Ma, J.-T.; Zhuang, S.-Y.; Yu, Z.-C.; Wu, Y.-D.; Wu, A.-X. Org. Lett. 2022, 24, 223.
doi: 10.1021/acs.orglett.1c03877 |
| [40] |
Ye, S.; Li, Y.; Wu, J.; Li, Z. Chem. Commun. 2019, 55, 2489.
doi: 10.1039/C9CC00008A |
| [41] |
Li, Y.-W.; Liu, J. B.; He, F. S.; Wu, J. Chin. J. Chem. 2020, 38, 361.
doi: 10.1002/cjoc.v38.4 |
| [42] |
Chen, S.-H.; Li, Y.-P.; Wang, M.; Jiang, X.-F. Green Chem. 2020, 22, 322.
doi: 10.1039/C9GC03841H |
| [43] |
Zhang, H.; Wang, M.; Jiang, X.-F. Green Chem. 2020, 22, 8238.
doi: 10.1039/D0GC03135F |
| [1] | 危斌, 周子龙, 秦景灏, 严泽宇, 郭嘉程, 雷澍, 谢叶香, 欧阳旋慧, 宋仁杰. 氧杂蒽与亚磺酸钠的电化学氧化C(sp3)—H磺酰化反应[J]. 有机化学, 2023, 43(1): 186-194. |
| [2] | 王川川, 马志伟, 侯学会, 杨龙华, 陈亚静. N-Ts氰胺在有机合成中的研究与应用[J]. 有机化学, 2023, 43(1): 74-93. |
| [3] | 魏琬絜, 詹磊, 高雷, 黄国保, 马献力. 电化学合成C-磺酰基化合物的研究进展[J]. 有机化学, 2023, 43(1): 17-35. |
| [4] | 徐琳琳, 兰美君, 张慕雨, 张永琪, 冯宇豪, 荣良策, 张金鹏. 芳基乙烯β-H区域选择性三氟甲基磺酰化反应[J]. 有机化学, 2022, 42(7): 2134-2139. |
| [5] | 冯易浇, 何静, 韦玥婷, 汤婷, 李春天, 刘平. 一锅两步策略高效合成3-芳基-4-(芳硫基)-1H-吡唑-5-胺衍生物[J]. 有机化学, 2022, 42(1): 226-234. |
| [6] | 任尚峰, 王玉超, 刘晋彪, 邱观音生. N-羟乙基-N-芳基丙炔酰胺的芳基磺酰化及螺-三环化反应[J]. 有机化学, 2021, 41(9): 3652-3659. |
| [7] | 刘宇, 陈赞, 陈镤, 熊碧权, 谢军, 刘岸, 梁云, 唐课文. 可见光催化炔烃串联氰基烷基磺酰化/环化[J]. 有机化学, 2021, 41(6): 2290-2301. |
| [8] | 周翔, 余茹鉴, 王金涛, 廖向文, 熊艳师. 铜催化亚磺酸钠盐参与的萘胺远程磺酰化反应[J]. 有机化学, 2021, 41(11): 4370-4377. |
| [9] | 王向阳, 高君青, 徐学涛, 方萍, 梅天胜. 铜催化的5-氯-8-氨基喹啉导向的邻位磺酰化[J]. 有机化学, 2021, 41(1): 384-393. |
| [10] | 刘爱遥, 刘江, 梅海波, Gerd-Volker Röschenthaler, 韩建林. Selectfluor作用下二芳基二硫醚和醇的双亚磺酰化反应制备亚磺酸酯[J]. 有机化学, 2020, 40(7): 1926-1933. |
| [11] | 唐裕才, 冉书童, 王萍, 陈飘. I2O5促进炔烃与磺酰肼碘磺酰化反应合成(E)-β-碘代烯基砜[J]. 有机化学, 2019, 39(4): 1116-1121. |
| [12] | 董道青, 陈文静, 陈德茂, 李丽霞, 李光辉, 王祖利, 邓企, 龙姝. KIO3促进的直接合成硫化或磺酰化吡唑啉酮及其抗菌活性[J]. 有机化学, 2019, 39(11): 3190-3198. |
| [13] | 傅颖, 赵兴玲, 侯博. 有机磺酰氯参与的磺酰化及脱磺酰化反应[J]. 有机化学, 2016, 36(6): 1184-1196. |
| [14] | 王大伟, 余晓丽, 葛冰洋, 苗红艳, 丁玉强. 铑催化苯醌磺酰化反应合成磺酰基醌类衍生物[J]. 有机化学, 2015, 35(3): 676-680. |
| [15] | 张诗浓, 杨胜虎, 黄乐浩, 赵保丽, 程凯, 齐陈泽. 芳基磺酰和亚磺酸类化合物参与的偶联反应研究进展[J]. 有机化学, 2015, 35(11): 2259-2274. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||
