有机化学 ›› 2023, Vol. 43 ›› Issue (1): 17-35.DOI: 10.6023/cjoc202205018 上一篇 下一篇
综述与进展
魏琬絜a, 詹磊a, 高雷a, 黄国保b,*( ), 马献力a,*(
), 马献力a,*( )
)
收稿日期:2022-05-13
修回日期:2022-07-14
发布日期:2022-08-25
通讯作者:
黄国保, 马献力
基金资助:
Wanjie Weia, Lei Zhana, Lei Gaoa, Guobao Huangb( ), Xianli Maa(
), Xianli Maa( )
)
Received:2022-05-13
Revised:2022-07-14
Published:2022-08-25
Contact:
Guobao Huang, Xianli Ma
Supported by:文章分享
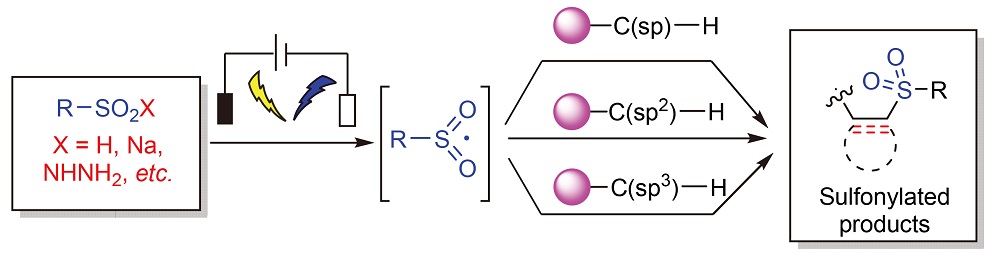
磺酰基化合物是一类重要的有机硫化合物, 在医药、农药和功能材料等领域中均具有广泛的应用, 因此, 有效的磺酰基化合物的合成策略已成为化学工作者们广泛研究的热点. 有机电化学合成是一种绿色、温和、高效的合成策略, 其在磺酰基化合物的合成中显示出了巨大的潜力. 本综述介绍了近年来利用电化学手段合成C-磺酰基化合物的反应. 按照电化学合成C(sp)-磺酰基化合物、C(sp2)-磺酰基化合物以及C(sp3)-磺酰基化合物的反应进行了分类归纳讨论, 并对相应的反应机理进行了阐述, 为今后此类反应在有机合成中的应用提供参考.
魏琬絜, 詹磊, 高雷, 黄国保, 马献力. 电化学合成C-磺酰基化合物的研究进展[J]. 有机化学, 2023, 43(1): 17-35.
Wanjie Wei, Lei Zhan, Lei Gao, Guobao Huang, Xianli Ma. Research Progress of Electrochemical Synthesis of C-Sulfonyl Compounds[J]. Chinese Journal of Organic Chemistry, 2023, 43(1): 17-35.
| [1] |
(a) Curti, C.; Laget, M.; Carle, A. O.; Gellis, A.; Vanelle, P. Eur. J. Med. Chem. 2007, 42, 880.
pmid: 17320245 |
|
(b) Meadows, D. C.; Sanchez, T.; Neamati, N.; North, T. W.; Hague, J. G. Bioorg. Med. Chem. 2007, 15, 1127.
doi: 10.1016/j.bmc.2006.10.017 pmid: 17320245 |
|
|
(c) Frankel, B. A.; Bentley, M.; Kruger, R. G.; McCafferty, D. G. J. Am. Chem. Soc. 2004, 126, 3404.
doi: 10.1021/ja0390294 pmid: 17320245 |
|
| [2] |
Devendar, P.; Yang, G. F. Top. Curr. Chem. 2017, 375, 82.
|
| [3] |
(a) Sasabe, H.; Seino, Y.; Kimura, M.; Kido, J. Chem. Mater. 2012, 24, 1404.
doi: 10.1021/cm3006748 |
|
(b) Turkoglu, G.; Cinar, M. E.; Ozturk, T. Top. Curr. Chem. 2017, 375, 84.
|
|
| [4] |
(a) Zhao, C.; Rakesh, K. P.; Ravidar, L.; Fang, W. Y.; Qin, H. L. Eur. J. Med. Chem. 2019, 162, 679.
doi: 10.1016/j.ejmech.2018.11.017 |
|
(b) Man, H. W.; Schafer, P.; Wong, L. M.; Patterson, R. T.; Corral, L. G.; Raymon, H.; Blease, K.; Leisten, J.; Shirley, M. A.; Tang, Y.; Babusis, D. M.; Chen, R.; Stirling, D.; Muller, G. W. J. Med. Chem. 2009, 52, 1522.
doi: 10.1021/jm900210d |
|
| [5] |
Julia, M.; Paris, J. M. Tetrahedron Lett. 1973, 49, 4833.
|
| [6] |
(a) Wang, Z.-Q.; Hou, C.; Zhong, Y.-F.; Lu, Y.-X.; Mo, Z.-Y.; Pan, Y.-M.; Tang, H.-T. Org. Lett. 2019, 21, 9841.
doi: 10.1021/acs.orglett.9b03682 |
|
(b) He, M.-X.; Mo, Z.-Y.; Wang, Z.-Q.; Cheng, S.-Y.; Xie, R.-R.; Tang, H.-T.; Pan, Y.-M. Org. Lett. 2020, 22, 724.
doi: 10.1021/acs.orglett.9b04549 |
|
|
(c) Meng, X.-J.; Zhong, P.-F.; Wang, Y.-M.; Wang, H.-S.; Tang, H.-T.; Pan, Y.-M. Adv. Synth. Catal. 2020, 362, 506.
doi: 10.1002/adsc.201901115 |
|
|
(d) Li, Q.-Y.; Cheng, S.-Y.; Tang, H.-T.; Pan, Y.-M. Green Chem. 2019, 21, 5517.
doi: 10.1039/C9GC03028J |
|
|
(e) Zhong, P.-F.; Lin, H.-M.; Wang, L.-W.; Mo, Z.-Y.; Meng, X.-J.; Tang, H.-T.; Pan, Y.-M. Green Chem. 2020, 22, 6334.
doi: 10.1039/D0GC02125C |
|
|
(f) Wu, Y.; Chen, J.-Y.; Liao, H.-R.; Shu, X.-R.; Duan, L.-L.; Yang, X.-F.; He, W.-M. Green Synth. Catal. 2021, 2, 233.
|
|
|
(g) Li, Q.-Y.; Swaroop, T. R; Hou, C.; Wang, Z.-Q.; Pan, Y.-M.; Tang, H.-T. Adv. Synth. Catal. 2019, 361, 1761.
doi: 10.1002/adsc.201801723 |
|
|
(h) Chen, N.; Xu, H.-C. Green Synth. Catal. 2021, 2, 165.
|
|
|
(i) He, M.-X.; Zhong, P.-F.; Liu, H.-F.; Ou, C.-H.; Pan, Y.-M.; Tang, H.-T. Green Synth. Catal. 2022, DOI: 10.1016/j.gresc.2022.03.002.
doi: 10.1016/j.gresc.2022.03.002 |
|
|
(j) Wang, X.-Y.; Zhong, Y.-F.; Mo, Z.-Y.; Wu, S.-H.; Xu, Y.-L.; Tang, H.-T.; Pan, Y.-M. Adv. Synth. Catal. 2021, 363, 208.
doi: 10.1002/adsc.202001192 |
|
|
(k) Yang, Z.; Yu, Y.; Lai, L.; Zhou, L.; Ye, K.; Chen, F.-E. Green Synth. Catal. 2021, 2, 19.
|
|
|
(k) Mei, H.; Pajkert, R.; Wang, L.; Li, Z.; Röschenthaler, G.-V.; Han, J. Green Chem. 2020, 22, 3028.
doi: 10.1039/D0GC01025A |
|
| [7] |
(a) Todoroki, H.; Iwatsu, M.; Urabe, D.; Inoue, M. J. Org. Chem. 2014, 79, 8835.
doi: 10.1021/jo501666x pmid: 12608817 |
|
(b) Kawai, H.; Yuan, Z.; Tokunaga, E.; Shibata, N. Org. Lett. 2012, 14, 5330.
doi: 10.1021/ol3025154 pmid: 12608817 |
|
|
(c) Riddell, N.; Tam, W. J. Org. Chem. 2006, 71, 1934.
pmid: 12608817 |
|
|
(d) Huang, X.; Duan, D.; Zheng, W. J. Org. Chem. 2003, 68, 1958.
pmid: 12608817 |
|
|
(e) Xie, M.; Wang, J.; Gu, X.; Sun, Y.; Wang, S. Org. Lett. 2006, 8, 431.
doi: 10.1021/ol052640i pmid: 12608817 |
|
|
(f) Zhang, S.; Ye, X.; Wojtas, L.; Hao, W.; Shi, X. Green Synth. Catal. 2021, 2, 82.
pmid: 12608817 |
|
| [8] |
(a) Guo, A.; Han, Ji. B.; Zhu, L.; Wei, Y.; Tang, X. Y. Org. Lett. 2019, 21, 2927.
doi: 10.1021/acs.orglett.9b00985 pmid: 30924668 |
|
(b) Jin, W.; Wu, M.; Xiong, Z.; Zhu, G. Chem. Commun. 2018, 54, 7924.
doi: 10.1039/C8CC03105C pmid: 30924668 |
|
|
(c) Schwarz, J.; König, B. ChemPhotoChem 2017, 1, 237.
doi: 10.1002/cptc.201700034 pmid: 30924668 |
|
|
(d) Wang, X.; Wu, S.; Zhong, Y.; Wang, Y.; Pan, Y.; Tang, H. Chin. Chem. Lett. 2022, DOI: 10.1016/j.cclet.2022.05.051.
doi: 10.1016/j.cclet.2022.05.051 pmid: 30924668 |
|
| [9] |
Chen, H.; Zhang, L. Angew. Chem., Int. Ed. 2015, 54, 11775.
doi: 10.1002/anie.201504511 |
| [10] |
Mo, Z.-Y.; Zhang, Y.-Z.; Huang, G.-B.; Wang, X.-Y.; Pan, Y.-M.; Tang, H.-T. Adv. Synth. Catal. 2020, 362, 2160.
doi: 10.1002/adsc.201901607 |
| [11] |
Meng, X.; Xu, H.; Cao, X.; Cai, X. M.; Luo, J.; Wang, F.; Huang, S. Org. Lett. 2020, 22, 6827.
doi: 10.1021/acs.orglett.0c02341 |
| [12] |
Zhong, Q.; Zhao, Y.; Sheng, S.; Chen, J. Synth. Commun. 2020, 50, 161.
doi: 10.1080/00397911.2019.1686527 |
| [13] |
Terent’ev, A. O.; Mulina, O. M.; Pirgach, D. A.; Ilovaisky, A. I.; Syroeshkin, M. A.; Kapustina, N. I.; Nikishin, G. I. Tetrahedron 2017, 73, 6871.
doi: 10.1016/j.tet.2017.10.047 |
| [14] |
Kim, H. S.; Lee, S. Eur. J. Org. Chem. 2019, 41, 6951.
|
| [15] |
Kong, X.; Yu, K.; Chen, Q.; Xu, B. Asian J. Org. Chem. 2020, 9, 1760.
doi: 10.1002/ajoc.202000403 |
| [16] |
Zhang, X.; Lu, D.; Wang, Z. Eur. J. Org. Chem. 2021, 30, 4284.
|
| [17] |
Yuan, Y.; Yu, Y.; Qiao, J.; Liu, P.; Yu, B.; Zhang, W.; Liu, H.; He, M.; Huang, Z.; Lei, A. Chem. Commun. 2018, 54, 11471.
doi: 10.1039/C8CC06451B |
| [18] |
Zhang, Y.-Z.; Mo, Z.-Y.; Wang, H.-S.; Wen, X.-A.; Tang, H.-T.; Pan, Y.-M. Green Chem. 2019, 21, 3807.
doi: 10.1039/C9GC01201J |
| [19] |
Mahanty, k.; Maiti, D.; Sarkar, S. D. J. Org. Chem. 2020, 85, 369.
|
| [20] |
Wen, J.; Shi, W.; Zhang, F.; Liu, D.; Tang, S.; Wang, H.; Lin, X.-M.; Lei, A. Org. Lett. 2017, 19, 3131.
doi: 10.1021/acs.orglett.7b01256 |
| [21] |
Lu, F.; Li, J.; Wang, T.; Li, Z.; Jiang, M.; Hu, X.; Pei, H.; Yuan, F.; Lu, L.; Lei, A. Asian J. Org. Chem. 2019, 8, 1838.
doi: 10.1002/ajoc.201900447 |
| [22] |
Jiang, M.; Yuan, Y.; Wang, T.; Xiong, Y.; Li, J.; Guo, H.; Lei, A. Chem. Commun. 2019, 55, 13852.
doi: 10.1039/C9CC07777D |
| [23] |
Xiao, H.-L.; Yang, C.-W.; Zhang, N.-T.; Zeng, C.-C.; Hu, L.-M.; Tian, H.-Y.; Daniel Little, R. Tetrahedron 2013, 69, 658.
doi: 10.1016/j.tet.2012.11.005 |
| [24] |
Luo, Y.-C.; Pan, X.-J.; Yuan, G.-Q. Tetrahedron 2015, 71, 2119.
doi: 10.1016/j.tet.2015.02.048 |
| [25] |
Qian, Peng.; Bi, M.; Su, J.; Zha, Z.; Wang, Z. J. Org. Chem. 2016, 81, 4876.
doi: 10.1021/acs.joc.6b00661 pmid: 27175916 |
| [26] |
Nikl, J.; Lips, S.; Schollmeyer, D.; Franke, R.; Waldvogel, S. R. Chem.-Eur. J. 2019, 25, 6891.
doi: 10.1002/chem.201900850 |
| [27] |
Sun, X.; Zhang, F.; Yan, K.; Feng, W.; Sun, X.; Yang, J.; Wen, J. Adv. Synth. Catal. 2021, 363, 3485.
doi: 10.1002/adsc.202100366 |
| [28] |
Salmas, R. E.; Seeman, P.; Aksoydan, B.; Erol, I.; Kantarcioglu, I.; Stein, M.; Yurtsever, M.; Durdagi, S. ACS Chem. Neurosci. 2017, 8, 1404.
doi: 10.1021/acschemneuro.7b00070 |
| [29] |
Nugent, T. C.; El-Shazly, M. Adv. Synth. Catal. 2010, 352, 753.
doi: 10.1002/adsc.200900719 |
| [30] |
Gu, Q.; Wang, X.; Liu, X.; Wu, G.; Xie, Y.; Shao, Y.; Zhao, Y.; Zeng, X. Org. Biomol. Chem. 2021, 19, 8295.
doi: 10.1039/D1OB01485D |
| [31] |
Yuan, Y.; Cao, Y.; Lin, Y.; Li, Y.; Huang, Z.; Lei, A. ACS Catal. 2018, 8, 10871.
doi: 10.1021/acscatal.8b03302 |
| [32] |
He, T. J.; Zhong, W. Q.; Huang, J. M. Chem. Commun. 2020, 56, 2735.
doi: 10.1039/C9CC09551A |
| [33] |
Wei, W.-J.; Zhong, Y.-J.; Feng, Y.-F.; Gao, L.; Tang, H.-T.; Pan, Y.-M.; Ma, X.-L.; Mo, Z.-Y. Adv. Synth. Catal. 2021, 364, 726.
doi: 10.1002/adsc.202101289 |
| [34] |
Pan, X.; Gao, J.; Yuan, G. Tetrahedron 2015, 71, 5525.
doi: 10.1016/j.tet.2015.06.063 |
| [35] |
Zheng, M.; Yuan, X.; Cui, Y.; Qiu, J.; Li, G.; Guo, K. Org. Lett. 2018, 20, 7784.
doi: 10.1021/acs.orglett.8b03191 |
| [36] |
Yavari, I.; Shaabanzadeh, S. Org. Lett. 2020, 22, 464.
doi: 10.1021/acs.orglett.9b04221 pmid: 31910023 |
| [37] |
Yu, M.; Wang, H.; Gao, Y.; Bu, F.; Cong, H.; Lei, A. Cell Rep. Phys. Sci. 2021, 2, 100476.
|
| [38] |
Luo, X.; Wang, S.; Lei, A. Adv. Synth. Catal. 2022, 364, 1016.
doi: 10.1002/adsc.202101393 |
| [1] | 吴宇恒, 颜岩, 寮渭巍. 双功能二氧化硫替代物在合成磺酰类化合物中的研究进展[J]. 有机化学, 2023, 43(11): 3713-3727. |
| [2] | 危斌, 周子龙, 秦景灏, 严泽宇, 郭嘉程, 雷澍, 谢叶香, 欧阳旋慧, 宋仁杰. 氧杂蒽与亚磺酸钠的电化学氧化C(sp3)—H磺酰化反应[J]. 有机化学, 2023, 43(1): 186-194. |
| [3] | 王川川, 马志伟, 侯学会, 杨龙华, 陈亚静. N-Ts氰胺在有机合成中的研究与应用[J]. 有机化学, 2023, 43(1): 74-93. |
| [4] | 徐琳琳, 兰美君, 张慕雨, 张永琪, 冯宇豪, 荣良策, 张金鹏. 芳基乙烯β-H区域选择性三氟甲基磺酰化反应[J]. 有机化学, 2022, 42(7): 2134-2139. |
| [5] | 冯易浇, 何静, 韦玥婷, 汤婷, 李春天, 刘平. 一锅两步策略高效合成3-芳基-4-(芳硫基)-1H-吡唑-5-胺衍生物[J]. 有机化学, 2022, 42(1): 226-234. |
| [6] | 任尚峰, 王玉超, 刘晋彪, 邱观音生. N-羟乙基-N-芳基丙炔酰胺的芳基磺酰化及螺-三环化反应[J]. 有机化学, 2021, 41(9): 3652-3659. |
| [7] | 蒙泽银, 冯承涛, 徐坤. 基于电化学方法构建碳-氮键的最新研究进展[J]. 有机化学, 2021, 41(7): 2535-2570. |
| [8] | 周翔, 余茹鉴, 王金涛, 廖向文, 熊艳师. 铜催化亚磺酸钠盐参与的萘胺远程磺酰化反应[J]. 有机化学, 2021, 41(11): 4370-4377. |
| [9] | 杨光, 王衍伟, 仇友爱. 光电协同催化有机合成研究进展[J]. 有机化学, 2021, 41(10): 3935-3947. |
| [10] | 王向阳, 高君青, 徐学涛, 方萍, 梅天胜. 铜催化的5-氯-8-氨基喹啉导向的邻位磺酰化[J]. 有机化学, 2021, 41(1): 384-393. |
| [11] | 刘爱遥, 刘江, 梅海波, Gerd-Volker Röschenthaler, 韩建林. Selectfluor作用下二芳基二硫醚和醇的双亚磺酰化反应制备亚磺酸酯[J]. 有机化学, 2020, 40(7): 1926-1933. |
| [12] | 王向阳, 徐学涛, 王振华, 方萍, 梅天胜. 过渡金属催化的不对称电化学进展[J]. 有机化学, 2020, 40(11): 3738-3747. |
| [13] | 唐裕才, 冉书童, 王萍, 陈飘. I2O5促进炔烃与磺酰肼碘磺酰化反应合成(E)-β-碘代烯基砜[J]. 有机化学, 2019, 39(4): 1116-1121. |
| [14] | 董道青, 陈文静, 陈德茂, 李丽霞, 李光辉, 王祖利, 邓企, 龙姝. KIO3促进的直接合成硫化或磺酰化吡唑啉酮及其抗菌活性[J]. 有机化学, 2019, 39(11): 3190-3198. |
| [15] | 傅颖, 赵兴玲, 侯博. 有机磺酰氯参与的磺酰化及脱磺酰化反应[J]. 有机化学, 2016, 36(6): 1184-1196. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||