有机化学 ›› 2021, Vol. 41 ›› Issue (5): 2127-2133.DOI: 10.6023/cjoc202008051 上一篇 下一篇
研究简报
收稿日期:2020-08-27
修回日期:2020-12-13
发布日期:2020-12-31
通讯作者:
许招会, 肖强
基金资助:
Zhaohui Xua,*( ), Huatao Yea, Wenfeng Zhanga, Qiang Xiaob,*(
), Huatao Yea, Wenfeng Zhanga, Qiang Xiaob,*( )
)
Received:2020-08-27
Revised:2020-12-13
Published:2020-12-31
Contact:
Zhaohui Xu, Qiang Xiao
About author:Supported by:文章分享
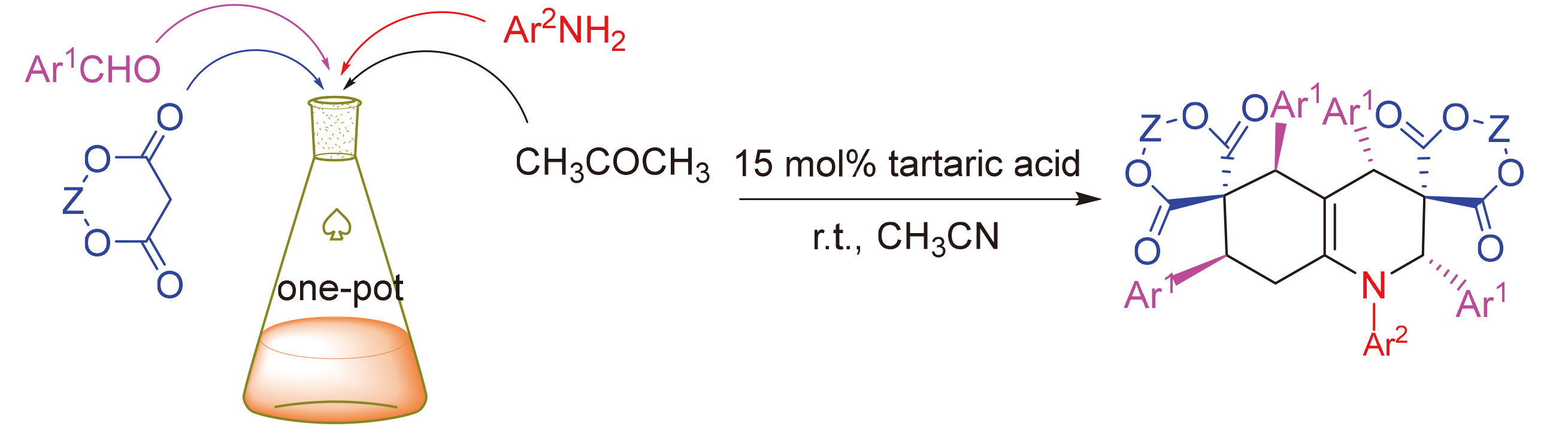
在酒石酸催化作用下, 以1,3-二噁烷-4,6-二酮、芳香醛、芳香胺和丙酮为原料, 通过四组分反应有效地合成了11种双螺环四氢喹啉双(1,3-二噁烷-4,6-二酮)衍生物. 该方法具有产物收率高、适用范围较广、反应温和、操作简单及环境友好等优点, 同时对反应机理进行了推测.
许招会, 叶华涛, 张文峰, 肖强. 酒石酸催化四组分反应合成双螺环四氢喹啉双(1,3-二噁烷-4,6-二酮)衍生物[J]. 有机化学, 2021, 41(5): 2127-2133.
Zhaohui Xu, Huatao Ye, Wenfeng Zhang, Qiang Xiao. A Four-Component Reaction for the Synthesis of Dispirotetrahydro-quinoline-bis(1,3-dioxane-4,6-dione) Derivatives Catalyzed by Tartaric Acid[J]. Chinese Journal of Organic Chemistry, 2021, 41(5): 2127-2133.
| Entry | Solvent | Catalyst (mol%) | Time/h | Yieldb/% |
|---|---|---|---|---|
| 1 | H2O | None | 32 | 12 |
| 2 | CH3CH2OH | None | 32 | 21 |
| 3 | CH3COCH3 | None | 32 | 24 |
| 4 | CH3CN | None | 32 | 35 |
| 5 | CH3CN | ZnSO4?7H2O (15) | 24 | 0 |
| 6 | CH3CN | B(OH)3 (15) | 24 | 0 |
| 7 | CH3CN | Iodine (15) | 24 | 52 |
| 8 | CH3CN | Malonic acid (15) | 24 | 46 |
| 9 | CH3CN | Benzoic acid (15) | 24 | 60 |
| 10 | CH3CN | CCl3CO2H (15) | 24 | 69 |
| 11 | CH3CN | L-Proline | 24 | 54 |
| 12 | CH3CN | Tartaric acid (15) | 20 | 85 |
| 13 | CH3CN | Tartaric acid (10) | 24 | 63 |
| 14 | CH3CN | Tartaric acid (20) | 24 | 85 |
| 15 | CH3CN | Tartaric acid (15) | 16 | 72 |
| 16 | CH3CN | Tartaric acid (15) | 24 | 84 |
| Entry | Solvent | Catalyst (mol%) | Time/h | Yieldb/% |
|---|---|---|---|---|
| 1 | H2O | None | 32 | 12 |
| 2 | CH3CH2OH | None | 32 | 21 |
| 3 | CH3COCH3 | None | 32 | 24 |
| 4 | CH3CN | None | 32 | 35 |
| 5 | CH3CN | ZnSO4?7H2O (15) | 24 | 0 |
| 6 | CH3CN | B(OH)3 (15) | 24 | 0 |
| 7 | CH3CN | Iodine (15) | 24 | 52 |
| 8 | CH3CN | Malonic acid (15) | 24 | 46 |
| 9 | CH3CN | Benzoic acid (15) | 24 | 60 |
| 10 | CH3CN | CCl3CO2H (15) | 24 | 69 |
| 11 | CH3CN | L-Proline | 24 | 54 |
| 12 | CH3CN | Tartaric acid (15) | 20 | 85 |
| 13 | CH3CN | Tartaric acid (10) | 24 | 63 |
| 14 | CH3CN | Tartaric acid (20) | 24 | 85 |
| 15 | CH3CN | Tartaric acid (15) | 16 | 72 |
| 16 | CH3CN | Tartaric acid (15) | 24 | 84 |
| Entry | Compound 1 | Ar1 (2) | Ar2 (3) | Time/h | Product | Yieldb/% |
|---|---|---|---|---|---|---|
| 1 | 1a | C6H5 (2a) | C6H5 (3a) | 20 | 5a | 85 |
| 2 | 1a | 4-FC6H4 (2b) | C6H5 (3a) | 16 | 5b | 74 |
| 3 | 1a | 4-ClC6H4 (2c) | C6H5 (3a) | 18 | 5c | 81 |
| 4 | 1a | 4-MeC6H4 (2d) | C6H5 (3a) | 24 | 5d | 78 |
| 5 | 1a | 4-CH3OC6H4 (2f) | C6H5 (3a) | 30 | 5e | 75 |
| 6c | 1a | 4-(CH3)2NC6H4 (2g) | C6H5 (3a) | 24 | — | — |
| 7c | 1a | 2-Furyl (2h) | C6H5 (3a) | 24 | — | — |
| 8 | 1a | C6H5 (2a) | 4-FC6H4 (3b) | 24 | 5f | 68 |
| 9 | 1a | C6H5 (2a) | 4-BrC6H4 (3c) | 24 | 5g | 71 |
| 10 | 1a | C6H5 (2a) | 4-ClC6H4 (3d) | 24 | 5h | 73 |
| 11 | 1a | C6H5 (2a) | 4-CH3OC6H4 (3e) | 30 | 5i | 69 |
| 12 | 1b | C6H5 (2a) | C6H5 (3a) | 20 | 5j | 83 |
| 13 | 1c | C6H5 (2a) | C6H5 (3a) | 20 | 5k | 86 |
| Entry | Compound 1 | Ar1 (2) | Ar2 (3) | Time/h | Product | Yieldb/% |
|---|---|---|---|---|---|---|
| 1 | 1a | C6H5 (2a) | C6H5 (3a) | 20 | 5a | 85 |
| 2 | 1a | 4-FC6H4 (2b) | C6H5 (3a) | 16 | 5b | 74 |
| 3 | 1a | 4-ClC6H4 (2c) | C6H5 (3a) | 18 | 5c | 81 |
| 4 | 1a | 4-MeC6H4 (2d) | C6H5 (3a) | 24 | 5d | 78 |
| 5 | 1a | 4-CH3OC6H4 (2f) | C6H5 (3a) | 30 | 5e | 75 |
| 6c | 1a | 4-(CH3)2NC6H4 (2g) | C6H5 (3a) | 24 | — | — |
| 7c | 1a | 2-Furyl (2h) | C6H5 (3a) | 24 | — | — |
| 8 | 1a | C6H5 (2a) | 4-FC6H4 (3b) | 24 | 5f | 68 |
| 9 | 1a | C6H5 (2a) | 4-BrC6H4 (3c) | 24 | 5g | 71 |
| 10 | 1a | C6H5 (2a) | 4-ClC6H4 (3d) | 24 | 5h | 73 |
| 11 | 1a | C6H5 (2a) | 4-CH3OC6H4 (3e) | 30 | 5i | 69 |
| 12 | 1b | C6H5 (2a) | C6H5 (3a) | 20 | 5j | 83 |
| 13 | 1c | C6H5 (2a) | C6H5 (3a) | 20 | 5k | 86 |
| [1] |
Michael, J. P. Nat. Prod. Rep. 1999, 16, 697.
pmid: 10641323 |
| [2] |
Fokialakis, N.; Magiatis, P.; Chinou, I.; Mitaku, S.; Tillequin, F. Chem. Pharm. Bull. 2002, 50, 413.
pmid: 11911210 |
| [3] |
Schiff Jr, J. P. Am. J. Pharm. Educ. 2006, 70, 98.
pmid: 17149427 |
| [4] |
Hamon, M.; Mallat, M.; Herbet, A.; Nelson, D. L.; Audinot, M.; Pichat, L.; Glowinski, J. J. Neurochem. 1981, 36, 613.
pmid: 7463079 |
| [5] |
Miller, K. J.; King, A.; Demchyshyn, L.; Niznik, H.; Teitler, M. Eur. J. Pharmacol. 1992, 227, 99.
pmid: 1330643 |
| [6] |
Hirasawa, Y.; Kobayashi, J. I.; Morita, H. Org. Lett. 2006, 8, 123.
pmid: 16381583 |
| [7] |
Bredberg, U.; Eyjolfsdottir, G. S.; Paalzow, L.; Tfelt-Hansen, P.; Tfelt-Hansen, V. Eur. J. Clin. Pharmacol. 1986, 30, 75.
pmid: 3709634 |
| [8] |
Nishiyama, T. T.; Hashiguchi, Y. Y.; Sakata, S. T.; Sakaguchi, T. T. Polym. Degrad. Stab. 2003, 79, 225.
doi: 10.1016/S0141-3910(02)00285-9 |
| [9] |
Chande, S. M.; Khanwelkar, R. R. Tetrahedron Lett. 2005, 46, 7787.
|
| [10] |
Ivanov, A. S. Chem. Soc. Rev. 2008, 37, 789.
doi: 10.1039/b716020h |
| [11] |
Pizzirani, D.; Roberti, M.; Recanatini, M. Tetrahedron Lett. 2007, 48, 7120.
doi: 10.1016/j.tetlet.2007.07.214 |
| [12] |
Pizzirani, D.; Roberti, M.; Grimaudo, S.; Di Cristina, A.; Pipitone, R. M.; Tolomeo, M.; Recanatini, M. J. Med. Chem. 2009, 52, 6936.
doi: 10.1021/jm900907s |
| [13] |
Lashkari, M.; Maghsoodlou, M. T.; Hazeri, N.; Habibi-Khorassani, S. M.; Akbarzadeh-Torbati, N.; García-Granda, S.; Torre-Fernán- dez, L. J. Heterocycl. Chem. 2015, 52, 873.
doi: 10.1002/jhet.1984 |
| [14] |
Salahi, S.; Hazeri, N.; Maghsoodlou, M. T.; García-Granda, S.; Torre-Fernández, L. J. Chem. Res. 2014, 38, 383.
doi: 10.3184/174751914X14017157492019 |
| [15] |
Hazeri, N.; Lashkari, M.; García-Granda, S.; Torre-Fernández, L. Aust. J. Chem. 2014, 67, 1656.
doi: 10.1071/CH13713 |
| [16] |
Salahi, S.; Maghsoodlou, M. T.; Hazeri, N.; Lashkari, M.; Garcia-Granda, S.; Torre-Fernandez, L. Chin. J. Catal. 2015, 36, 1023.
doi: 10.1016/S1872-2067(15)60846-4 |
| [17] |
Salahi, S.; Hazeri, N.; Maghsoodlou, M. T.; Lashkari, M.; Torbati, N. A.; Garcia-Granda, S.; Torre-Fernandez, L. J. Chil. Chem. Soc. 2018, 63, 4159.
doi: 10.4067/S0717-97072018000404159 |
| [18] |
Fatahpour, M.; Lashkari, M.; Hazeri, N.; Sadeh, F. N.; Maghsoodlou, M. T. Org. Prep. Proced. Int. 2019, 51, 576.
doi: 10.1080/00304948.2019.1677992 |
| [19] |
Salahi, S.; Maghsoodlou, M. T.; Hazeri, N.; Lashkari, M.; Torbati, N. A.; Kazemian, M.A. García-Granda, S.; Torre-Fernández, L. J. Saudi Chem. Soc. 2016, 20, 349.
doi: 10.1016/j.jscs.2014.11.002 |
| [20] |
Zhou, Q.; Wang, Q. A.; Jia, C. H. Food Res. Dev. 2010, 31, 26. (in Chinese).
|
|
(周强, 汪秋安, 贾超华, 食品研究与开发, 2010, 31, 26.)
|
|
| [21] |
Fan, N. L.; Chen, F. B.; Xu, Z. H.; Xiao, Q. Chin. J. Synth. Chem. 2018, 26, 479. (in Chinese).
|
|
(范乃立, 陈飞彪, 许招会, 肖强, 合成化学, 2018, 26, 479.)
|
|
| [22] |
Xu, Z. H.; Li, Y. J.; Liu, D. Y.; Xiao, Q. Chin. J. Org. Chem. 2018, 38, 3118. (in Chinese).
doi: 10.6023/cjoc201804005 |
|
(许招会, 李瑜钰, 刘德永, 肖强, 有机化学, 2018, 38, 3118.)
doi: 10.6023/cjoc201804005 |
|
| [23] |
Kodama, T.; Moquist, P. N.; Schaus, S. E. Org. Lett. 2011, 13, 6316.
doi: 10.1021/ol2028702 |
| [24] |
Lu, N.; Chen, D. Z.; Zhang, G. Q. Int. J. Quantum. Chem. 2011, 111, 2031.
doi: 10.1002/qua.v111.9 |
| [25] |
Khandebharad, A. U.; Sarda, S. R.; Gill, C. H. Res. J. Chem. Sci. 2015, 5, 27.
|
| [26] |
Aboonajmi, J.; Maghsoodou, M. T.; Hazeri, N. Res. Chem. Intermed. 2015, 41, 8057.
doi: 10.1007/s11164-014-1877-1 |
| [27] |
Nidhi, G.; Virendrak, K. T. Synth. Commun. 2011, 41, 2800.
doi: 10.1080/00397911.2010.515358 |
| [28] |
Niralwad, K. S.; Shingate, B. B.; Shingare, M. S. J. Korean Chem. Soc. 2011, 55, 486.
doi: 10.5012/jkcs.2011.55.3.486 |
| [29] |
Yan, N.; Xiong, B.; Liao, W. L.; Xu, Z. H. Chin. J. Org. Chem. 2010, 30, 1391. (in Chinese).
|
|
(严楠, 熊斌, 廖维林, 许招会, 有机化学, 2010, 30, 1391.)
|
|
| [30] |
Zeng, W. L.; Cai, X.; Guo, H. M. Chin. J. Struct. Chem. 2013, 32, 1603.
|
| [31] |
Fan, N. L.; Chen, F. B.; Xu, Z. H.; Xiao, Q. Chin. J. Synth. Chem. 2017, 26, 479. (in Chinese).
|
|
(范乃立, 陈飞彪, 许招会, 肖强, 合成化学, 2017, 26, 479.)
|
| [1] | 李阳, 袁锦鼎, 赵頔. 低共熔溶剂1,3-二甲基脲/L-(+)-酒石酸中(E)-2-苯乙烯基喹啉-3-羧酸类衍生物的绿色合成[J]. 有机化学, 2023, 43(9): 3268-3276. |
| [2] | 罗享豪, 谢益碧, 黄年玉, 王龙. 基于原位捕获异腈的Ugi四组分反应及其后修饰串联反应: 一锅法合成含氮杂环化合物[J]. 有机化学, 2022, 42(3): 838-846. |
| [3] | 刘金妮, 谢益碧, 阳青青, 黄年玉, 王龙. 基于原位捕获胺的Ugi四组分反应及其后修饰串联环化反应:“一锅法”合成六元、七元杂环化合物[J]. 有机化学, 2021, 41(6): 2374-2383. |
| [4] | 郭小燕, 方帅军, 钱红飞, 冯高峰. 基于Ugi四组分反应合成结构多样的新型分散染料[J]. 有机化学, 2021, 41(4): 1703-1711. |
| [5] | 宋盼, 王超玉, 王鹏, 刘晓燕, 徐括喜. 基于吖啶的手性荧光传感器的合成及其对酒石酸识别性能研究[J]. 有机化学, 2016, 36(4): 782-786. |
| [6] | 张金鹏, 高亚年, 陈明, 姜灵, 夏盛, 荣良策. 无催化剂条件下有效的四组分反应合成2,3-二氢噻吩衍生物[J]. 有机化学, 2014, 34(9): 1895-1899. |
| [7] | 全 旭 ; 林成刚 ; 徐 娟; 史海健*. 外消旋2-氨基-1-(2,2-二甲基-4H-1,3-苯并二氧芑-6-基)乙醇的拆分研究[J]. 有机化学, 2009, 29(04): 648-652. |
| [8] | 惠爱玲a; 张金堂b ; 汪志勇*,b. 酒石酸衍生物促进的醛酮不对称烷基加成反应研究进展[J]. 有机化学, 2009, 29(03): 334-340. |
| [9] | 彭阳峰,何佺,王家荣,高浩其,蔡水洪,田禾. 通过形成二酪氨酸酯酒石酸盐法制备D-酪氨酸的新方法[J]. 有机化学, 2006, 26(01): 69-76. |
| [10] | 车超, 张钟宁, 黄桂兰, 王信星. 手性酒石酸酯对不对称环氧化反应动力学拆分DL-1-十四烯-3-醇的催化选择性[J]. 有机化学, 2004, 24(10): 1281-1283. |
| [11] | 车超,代星,毛淑芬,徐彦军,覃兆海. 手性仲丁胺的制备拆分和光学纯度的测定[J]. 有机化学, 2003, 23(4): 390-392. |
| [12] | 施秀芳,张明杰,杜伟奇. 一种简易的光活性1,1′-联二萘酚合成方法[J]. 有机化学, 2003, 23(2): 192-194. |
| [13] | 孙小玲,吴毓林. 重要手性合成砌块R-丁三醇的合成及纯化[J]. 有机化学, 2002, 22(7): 501-503. |
| [14] | 王忠义,尤田耙,尤凌峰. 3, 6-二芳基-5, 6-二氢均三唑[3, 4-b][1, 3, 4]噻二唑的合成 及生物活性[J]. 有机化学, 1999, 19(3): 288-292. |
| [15] | 胡艾希,范国枝,赵海涛. (2S)-(+)-2-溴-1-(6'-甲氧基-2'-萘基)丙-1-酮的不对称合成[J]. 有机化学, 1999, 19(1): 93-96. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||