有机化学 ›› 2022, Vol. 42 ›› Issue (6): 1677-1686.DOI: 10.6023/cjoc202201048 上一篇 下一篇
研究论文
高潮a,b, 司晓杰a,b, 池玲玲a,b, 王浩a,b, 戴洪林a,b, 刘丽敏a,b, 汪正捷a,b, 张洋a,b, 王涛a,b, 周耀传a, 郑甲信a,b, 可钰a,b,c,d,*( ), 刘宏民a,b,c,d,*(
), 刘宏民a,b,c,d,*( ), 张秋荣a,b,c,d,*(
), 张秋荣a,b,c,d,*( )
)
收稿日期:2022-01-28
修回日期:2022-03-08
发布日期:2022-03-21
通讯作者:
可钰, 刘宏民, 张秋荣
基金资助:
Chao Gaoa,b, Xiaojie Sia,b, Lingling Chia,b, Hao Wanga,b, Honglin Daia,b, Limin Liua,b, Zhengjie Wanga,b, Yang Zhanga,b, Tao Wanga,b, Yaochuan Zhoua, Jiaxin Zhenga,b, Yu Kea,b,c,d( ), Hongmin Liua,b,c,d(
), Hongmin Liua,b,c,d( ), Qiurong Zhanga,b,c,d(
), Qiurong Zhanga,b,c,d( )
)
Received:2022-01-28
Revised:2022-03-08
Published:2022-03-21
Contact:
Yu Ke, Hongmin Liu, Qiurong Zhang
Supported by:文章分享
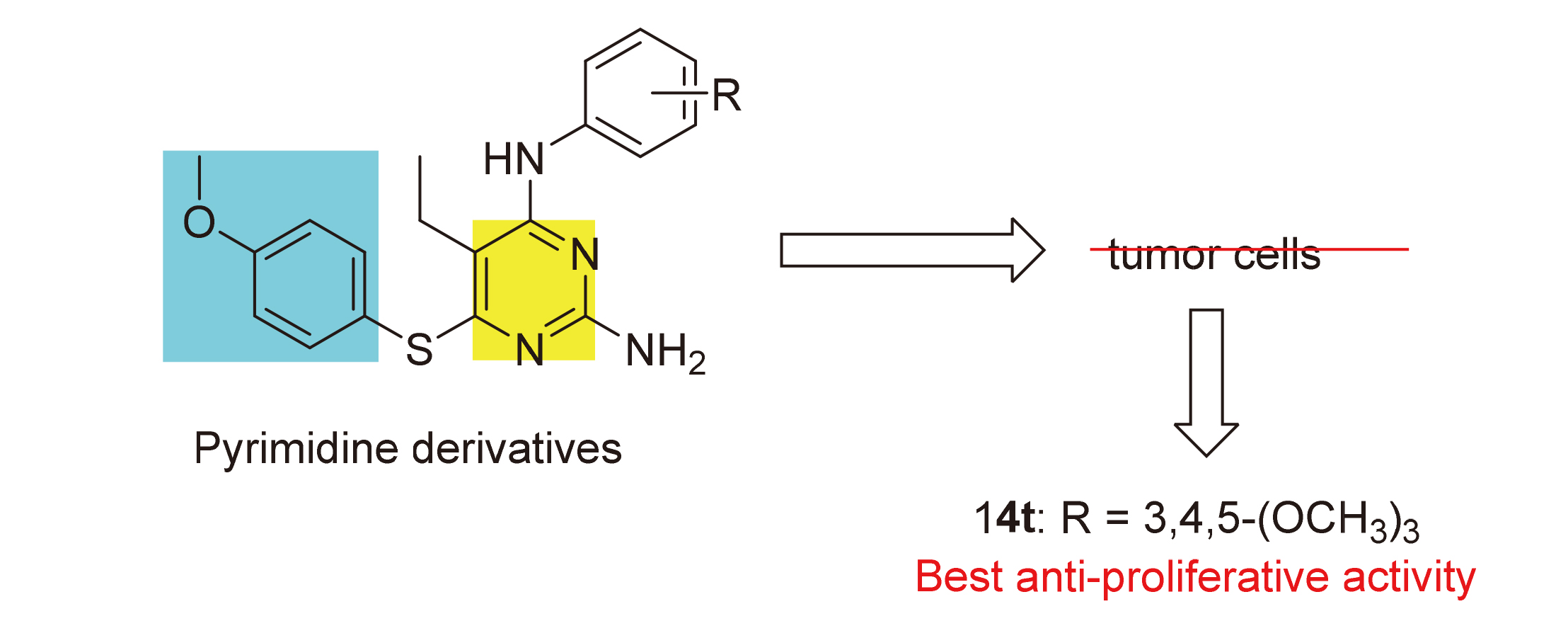
为了寻找高效的新型抗肿瘤药物, 设计并合成了一系列含苯甲醚结构的2,4,5,6-四取代嘧啶衍生物, 并采用噻唑蓝(MTT)法测定了目标化合物对PC-3(人前列腺癌细胞)、MGC-803(人胃癌细胞)、MCF-7(人乳腺癌细胞)、HGC-27(人未分化胃癌细胞)四种人肿瘤细胞的抗增殖活性. 结果显示部分化合物表现出中度至强效的抗增殖活性, 其中5-乙基- 6-((4-甲氧基苯基)硫代)-N4-(3,4,5-三甲氧基苯基)嘧啶-2,4-二胺(14t)对HGC-27细胞具有最好的抗增殖活性, IC50值为(0.98±0.12) μmol•L–1, 抗增殖活性明显优于阳性对照5-氟尿嘧啶. 进一步抗肿瘤机制研究表明, 化合物14t可以显著抑制HGC-27细胞的克隆形成和迁移, 诱导细胞凋亡. 同时化合物14t可以下调抗凋亡蛋白Bcl-2的表达, 上调促凋亡蛋白Bax和P53的表达.
高潮, 司晓杰, 池玲玲, 王浩, 戴洪林, 刘丽敏, 汪正捷, 张洋, 王涛, 周耀传, 郑甲信, 可钰, 刘宏民, 张秋荣. 含苯甲醚结构的2,4,5,6-四取代嘧啶衍生物的合成及抗增殖活性研究[J]. 有机化学, 2022, 42(6): 1677-1686.
Chao Gao, Xiaojie Si, Lingling Chi, Hao Wang, Honglin Dai, Limin Liu, Zhengjie Wang, Yang Zhang, Tao Wang, Yaochuan Zhou, Jiaxin Zheng, Yu Ke, Hongmin Liu, Qiurong Zhang. Synthesis and Antiproliferative Activity of 2,4,5,6-Tetrasubstituted Pyrimidine Derivatives Containing Anisole[J]. Chinese Journal of Organic Chemistry, 2022, 42(6): 1677-1686.
| Compd. | R | IC50a/(μmol·L–1) | |||
|---|---|---|---|---|---|
| PC-3 | MGC-803 | MCF-7 | HGC-27 | ||
| 14a | — | >50 | >50 | >50 | >50 |
| 14b | 2-F | 15.70±1.19 | 25.36±0.76 | 27.67±1.44 | 30.96±1.49 |
| 14c | 3-F | 19.03±0.99 | 39.79±1.60 | 45.20±1.66 | 37.87±1.44 |
| 14d | 4-F | 20.67±1.03 | 44.66±1.65 | >50 | 35.73±1.55 |
| 14e | 2-Cl | 11.13±1.05 | 20.68±1.32 | 23.65±1.64 | 14.32±1.16 |
| 14f | 3-Cl | >50 | 24.89±1.40 | 41.63±1.62 | >50 |
| 14g | 4-Cl | 26.58±1.42 | >50 | 27.72±1.44 | 49.93±1.60 |
| 14h | 2-Br | 10.08±1.00 | 14.59±1.16 | 33.74±1.53 | 12.22±1.09 |
| 14i | 3-Br | >50 | >50 | >50 | >50 |
| 14j | 4-Br | 12.39±0.97 | 17.99±1.25 | 35.95±1.14 | 28.75±1.46 |
| 14k | 2-CH3 | >50 | 40.01±1.60 | >50 | >50 |
| 14l | 3-CH3 | >50 | >50 | >50 | >50 |
| 14m | 4-CH3 | >50 | >50 | >50 | >50 |
| 14n | 2-OCH3 | 5.22±0.72 | 10.06±1.00 | 7.79±0.89 | 5.15±0.71 |
| 14o | 3-OCH3 | 8.41±0.92 | 32.69±1.51 | 17.53±1.24 | 27.55±1.44 |
| 14p | 4-OCH3 | 10.70±1.03 | 18.18±1.26 | 15.36±1.19 | 11.75±1.07 |
| 14q | 3,4-Cl2 | 10.91±1.04 | 13.77±1.14 | 6.64±0.88 | 11.52±1.06 |
| 14r | 2,4-Cl2 | >50 | >50 | 42.73±1.63 | >50 |
| 14s | 3-Cl-4-F | 27.97±0.90 | 42.36±1.63 | 29.99±1.48 | >50 |
| 14t | 3,4,5-(OCH3)3 | 5.59±0.75 | 2.41±0.38 | 5.94±0.77 | 0.98±0.12 |
| 5-Fub | — | 6.39±0.71 | 10.64±1.09 | 10.23±0.68 | 7.25±0.72 |
| Compd. | R | IC50a/(μmol·L–1) | |||
|---|---|---|---|---|---|
| PC-3 | MGC-803 | MCF-7 | HGC-27 | ||
| 14a | — | >50 | >50 | >50 | >50 |
| 14b | 2-F | 15.70±1.19 | 25.36±0.76 | 27.67±1.44 | 30.96±1.49 |
| 14c | 3-F | 19.03±0.99 | 39.79±1.60 | 45.20±1.66 | 37.87±1.44 |
| 14d | 4-F | 20.67±1.03 | 44.66±1.65 | >50 | 35.73±1.55 |
| 14e | 2-Cl | 11.13±1.05 | 20.68±1.32 | 23.65±1.64 | 14.32±1.16 |
| 14f | 3-Cl | >50 | 24.89±1.40 | 41.63±1.62 | >50 |
| 14g | 4-Cl | 26.58±1.42 | >50 | 27.72±1.44 | 49.93±1.60 |
| 14h | 2-Br | 10.08±1.00 | 14.59±1.16 | 33.74±1.53 | 12.22±1.09 |
| 14i | 3-Br | >50 | >50 | >50 | >50 |
| 14j | 4-Br | 12.39±0.97 | 17.99±1.25 | 35.95±1.14 | 28.75±1.46 |
| 14k | 2-CH3 | >50 | 40.01±1.60 | >50 | >50 |
| 14l | 3-CH3 | >50 | >50 | >50 | >50 |
| 14m | 4-CH3 | >50 | >50 | >50 | >50 |
| 14n | 2-OCH3 | 5.22±0.72 | 10.06±1.00 | 7.79±0.89 | 5.15±0.71 |
| 14o | 3-OCH3 | 8.41±0.92 | 32.69±1.51 | 17.53±1.24 | 27.55±1.44 |
| 14p | 4-OCH3 | 10.70±1.03 | 18.18±1.26 | 15.36±1.19 | 11.75±1.07 |
| 14q | 3,4-Cl2 | 10.91±1.04 | 13.77±1.14 | 6.64±0.88 | 11.52±1.06 |
| 14r | 2,4-Cl2 | >50 | >50 | 42.73±1.63 | >50 |
| 14s | 3-Cl-4-F | 27.97±0.90 | 42.36±1.63 | 29.99±1.48 | >50 |
| 14t | 3,4,5-(OCH3)3 | 5.59±0.75 | 2.41±0.38 | 5.94±0.77 | 0.98±0.12 |
| 5-Fub | — | 6.39±0.71 | 10.64±1.09 | 10.23±0.68 | 7.25±0.72 |
| Compd. | IC50/(μmol·L–1) | |
|---|---|---|
| GES-1 | HEEC | |
| 14t | 43.98±1.64 | >100 |
| 5-Fu | 13.30±1.12 | >100 |
| Compd. | IC50/(μmol·L–1) | |
|---|---|---|
| GES-1 | HEEC | |
| 14t | 43.98±1.64 | >100 |
| 5-Fu | 13.30±1.12 | >100 |
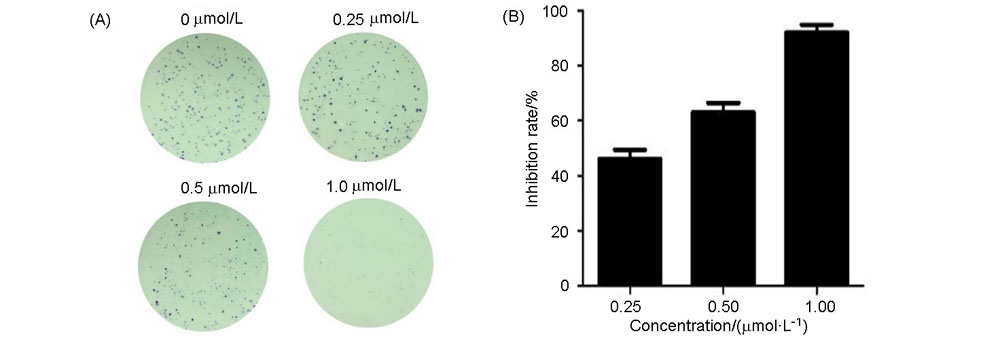

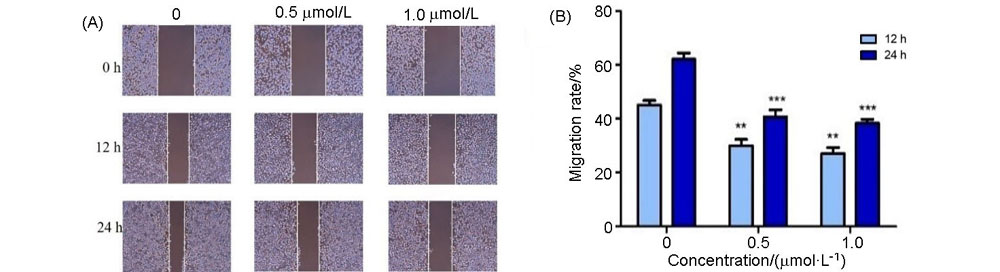



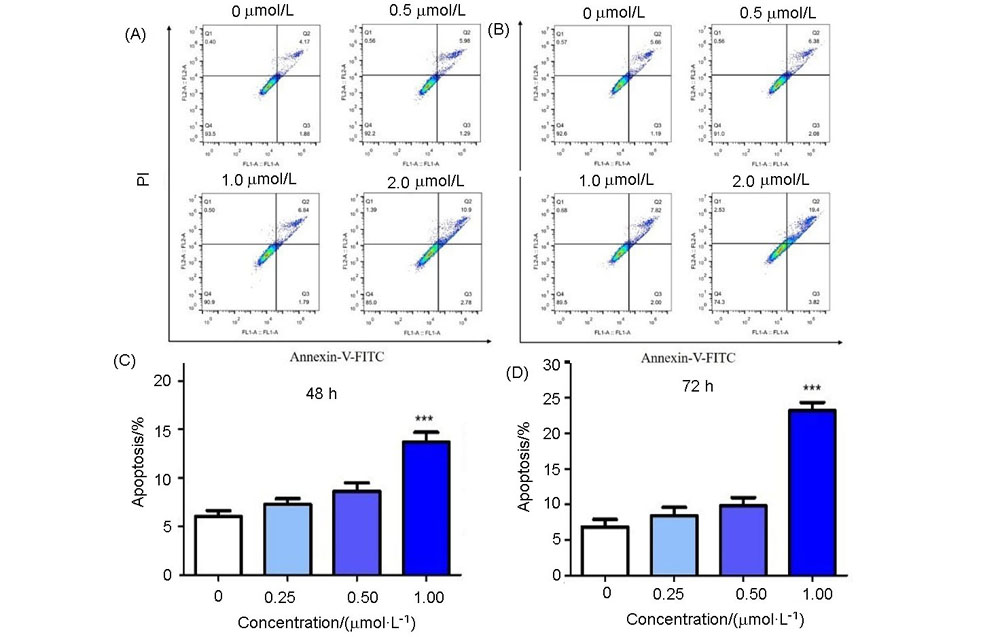
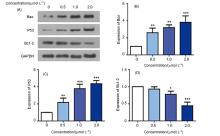
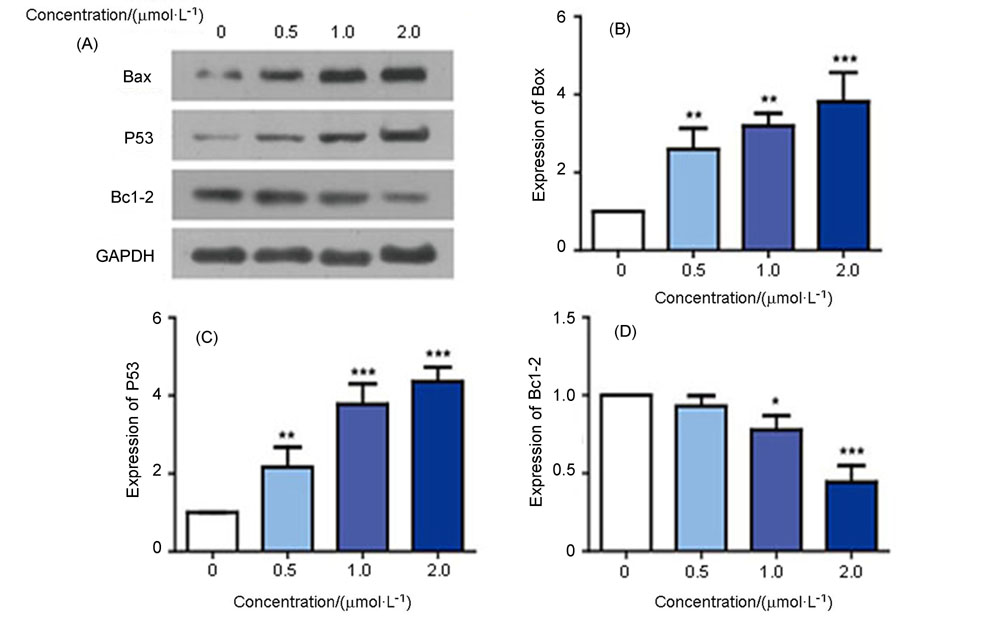
| [1] |
Sung, H.; Ferlay, J.; Siegel, R. L.; Laversanne, M.; Soerjomataram, I.; Jemal, A.; Bray, F. CA Cancer J Clin. 2021, 71, 209.
doi: 10.3322/caac.21660 |
| [2] |
Mao, J. J.; Pillai, G. G.; Andrade, C. J.; Ligibel, J. A.; Basu, P.; Cohen, L.; Khan, I. A.; Mustian, K. M.; Puthiyedath, R.; Dhiman, K. S.; Lao, L.; Ghelman, R.; Caceres Guido, P.; Lopez, G.; Gallego-Perez, D. F.; Salicrup, L. A. CA Cancer J Clin. 2022, 72, 144.
doi: 10.3322/caac.21706 |
| [3] |
Tilaoui, M.; Ait Mouse, H.; Zyad, A. Front Pharmacol. 2021, 12, 719694.
doi: 10.3389/fphar.2021.719694 |
| [4] |
Gu, X.; Huang, Z.; Ren, Z.; Tang, X.; Xue, R.; Luo, X.; Peng, S.; Peng, H.; Lu, B.; Tian, J.; Zhang, Y. J. Med. Chem. 2017, 60, 928.
doi: 10.1021/acs.jmedchem.6b01075 |
| [5] |
Meng, Y.; Li, E.; Zhang, Y.; Liu, S.; Bao, C.; Yang, P.; Zhang, L.; Zhang, D.; Wang, J.; Chen, Y.; Li, N.; Xin, J.; Zhao, P.; Ke, Y.; Zhang, Q.; Liu, H. Chin. J. Org. Chem. 2019, 39, 2541. (in Chinese)
doi: 10.6023/cjoc201903022 |
|
( 孟娅琪, 李二冬, 张洋, 刘栓, 包崇男, 杨鹏, 张路野, 张丹青, 王继宽, 陈雅欣, 栗娜, 辛景超, 赵培荣, 可钰, 张秋荣, 刘宏民, 有机化学, 2019, 39, 2541.)
|
|
| [6] |
Ma, L. Y.; Zheng, Y. C.; Wang, S. Q.; Wang, B.; Wang, Z. R.; Pang, L. P.; Zhang, M.; Wang, J. W.; Ding, L.; Li, J.; Wang, C.; Hu, B.; Liu, Y.; Zhang, X. D.; Wang, J. J.; Wang, Z. J.; Zhao, W.; Liu, H. M. J. Med. Chem. 2015, 58, 1705.
doi: 10.1021/acs.jmedchem.5b00037 pmid: 25610955 |
| [7] |
Guillemont, J.; Pasquier, E.; Palandjian, P.; Vernier, D.; Gaurrand, S.; Lewi, P. J.; Heeres, J.; de Jonge, M. R.; Koymans, L. M.; Daeyaert, F. F.; Vinkers, M. H.; Arnold, E.; Das, K.; Pauwels, R.; Andries, K.; de Bethune, M. P.; Bettens, E.; Hertogs, K.; Wigerinck, P.; Timmerman, P.; Janssen, P. A. J. Med. Chem. 2005, 48, 2072.
pmid: 15771449 |
| [8] |
Wang, L.; Tang, J.; Huber, A. D.; Casey, M. C.; Kirby, K. A.; Wilson, D. J.; Kankanala, J.; Xie, J.; Parniak, M. A.; Sarafianos, S. G.; Wang, Z. Eur. J. Med. Chem. 2018, 156, 652.
doi: S0223-5234(18)30595-6 pmid: 30031976 |
| [9] |
Kumar, N.; Chauhan, A.; Drabu, S. Biomed. Pharmacother. 2011, 65, 375.
doi: 10.1016/j.biopha.2011.04.023 |
| [10] |
Tale, R. H.; Rodge, A. H.; Hatnapure, G. D.; Keche, A. P. Bioorg. Med. Chem. Lett. 2011, 21, 4648.
doi: 10.1016/j.bmcl.2011.03.062 |
| [11] |
Fouda, A. M.; Abbas, H. S.; Ahmed, E. H.; Shati, A. A.; Alfaifi, M. Y.; Elbehairi, S. E. I. Molecules 2019, 24, 1080.
doi: 10.3390/molecules24061080 |
| [12] |
Shaaban, O. G.; Issa, D. A. E.; El-Tombary, A. A.; Abd El Wahab, S. M.; Abdel Wahab, A. E.; Abdelwahab, I. A. Bioorg. Chem. 2019, 88, 102934.
doi: 10.1016/j.bioorg.2019.102934 |
| [13] |
Cassidy, J.; Clarke, S.; Diaz-Rubio, E.; Scheithauer, W.; Figer, A.; Wong, R.; Koski, S.; Rittweger, K.; Gilberg, F.; Saltz, L. Br. J. Cancer 2011, 105, 58.
doi: 10.1038/bjc.2011.201 |
| [14] |
Passaro, A.; Guerini-Rocco, E.; Pochesci, A.; Vacirca, D.; Spitaleri, G.; Catania, C. M.; Rappa, A.; Barberis, M.; de Marinis, F. Pharmacol. Res. 2017, 117, 406.
doi: 10.1016/j.phrs.2017.01.003 |
| [15] |
Finlay, M. R.; Anderton, M.; Ashton, S.; Ballard, P.; Bethel, P. A.; Box, M. R.; Bradbury, R. H.; Brown, S. J.; Butterworth, S.; Campbell, A.; Chorley, C.; Colclough, N.; Cross, D. A.; Currie, G. S.; Grist, M.; Hassall, L.; Hill, G. B.; James, D.; James, M.; Kemmitt, P.; Klinowska, T.; Lamont, G.; Lamont, S. G.; Martin, N.; McFarland, H. L.; Mellor, M. J.; Orme, J. P.; Perkins, D.; Perkins, P.; Richmond, G.; Smith, P.; Ward, R. A.; Waring, M. J.; Whittaker, D.; Wells, S.; Wrigley, G. L. J. Med. Chem. 2014, 57, 8249.
doi: 10.1021/jm500973a |
| [16] |
Cross, D. A.; Ashton, S. E.; Ghiorghiu, S.; Eberlein, C.; Nebhan, C. A.; Spitzler, P. J.; Orme, J. P.; Finlay, M. R.; Ward, R. A.; Mellor, M. J.; Hughes, G.; Rahi, A.; Jacobs, V. N.; Red Brewer, M.; Ichihara, E.; Sun, J.; Jin, H.; Ballard, P.; Al-Kadhimi, K.; Rowlinson, R.; Klinowska, T.; Richmond, G. H.; Cantarini, M.; Kim, D. W.; Ranson, M. R.; Pao, W. Cancer Discovery 2014, 4, 1046.
doi: 10.1158/2159-8290.CD-14-0337 |
| [17] |
Jabbour, E. Am. J. Hematol. 2016, 91, 59.
doi: 10.1002/ajh.24249 pmid: 26769227 |
| [18] |
Kategaya, L.; Di Lello, P.; Rougé, L.; Pastor, R.; Clark, K. R.; Drummond, J.; Kleinheinz, T.; Lin, E.; Upton, J.-P.; Prakash, S.; Heideker, J.; McCleland, M.; Ritorto, M. S.; Alessi, D. R.; Trost, M.; Bainbridge, T. W.; Kwok, M. C. M.; Ma, T. P.; Stiffler, Z.; Brasher, B.; Tang, Y.; Jaishankar, P.; Hearn, B. R.; Renslo, A. R.; Arkin, M. R.; Cohen, F.; Yu, K.; Peale, F.; Gnad, F.; Chang, M. T.; Klijn, C.; Blackwood, E.; Martin, S. E.; Forrest, W. F.; Ernst, J. A.; Ndubaku, C.; Wang, X.; Beresini, M. H.; Tsui, V.; Schwerdtfeger, C.; Blake, R. A.; Murray, J.; Maurer, T.; Wertz, I. E. Nature 2017, 550, 534.
doi: 10.1038/nature24006 |
| [19] |
Di Lello, P.; Pastor, R.; Murray, J. M.; Blake, R. A.; Cohen, F.; Crawford, T. D.; Drobnick, J.; Drummond, J.; Kategaya, L.; Kleinheinz, T.; Maurer, T.; Rouge, L.; Zhao, X.; Wertz, I.; Ndubaku, C.; Tsui, V. J. Med. Chem. 2017, 60, 10056.
doi: 10.1021/acs.jmedchem.7b01293 |
| [20] |
Modranka, J.; Drogosz-Stachowicz, J.; Pietrzak, A.; Janecka, A.; Janecki, T. Eur. J. Med. Chem. 2021, 219, 113429.
doi: 10.1016/j.ejmech.2021.113429 |
| [21] |
Barghash, R. F.; Eldehna, W. M.; Kovalova, M.; Vojackova, V.; Krystof, V.; Abdel-Aziz, H. A. Eur. J. Med. Chem. 2022, 227, 113952.
doi: 10.1016/j.ejmech.2021.113952 |
| [22] |
Li, J.; Hu, X.; Luo, T.; Lu, Y.; Feng, Y.; Zhang, H.; Liu, D.; Fan, X.; Wang, Y.; Jiang, L.; Wang, Y.; Hao, X.; Shi, T.; Wang, Z. Eur. J. Med. Chem. 2021, 226, 113817.
doi: 10.1016/j.ejmech.2021.113817 |
| [23] |
Ren, Y.; Ruan, Y.; Cheng, B.; Li, L.; Liu, J.; Fang, Y.; Chen, J. Bioorg. Med. Chem. 2021, 46, 116376.
doi: 10.1016/j.bmc.2021.116376 |
| [24] |
Ma, J.; Liang, W.; Qiang, Y.; Li, L.; Du, J.; Pan, C.; Chen, B.; Zhang, C.; Chen, Y.; Wang, Q. Cell Commun. Signal. 2021, 19, 122.
doi: 10.1186/s12964-021-00804-0 |
| [25] |
Fu, S.; Chen, X.; Lo, H. W.; Lin, J. Cancer Lett. 2019, 448, 11.
doi: 10.1016/j.canlet.2019.01.026 |
| [26] |
Legraverend, M.; Bisagni, E. Tetrahedron Lett. 1985, 26, 2001.
doi: 10.1016/S0040-4039(00)98364-3 |
| [27] |
Legraverend, M.; Ngongo-Tekam, R. M.; Bisagni, E.; Zerial, A. J Med. Chem. 1985, 28, 1477.
pmid: 2995667 |
| [28] |
Jansa, P.; Holy, A.; Dracinsky, M.; Kolman, V.; Janeba, Z.; Kostecka, P.; Kmonickova, E.; Zidek, Z. Med. Chem. Res. 2014, 23, 4482.
doi: 10.1007/s00044-014-1018-9 pmid: 32214763 |
| [1] | 冯康博, 陈炯, 古双喜, 王海峰, 陈芬儿. 全连续流反应技术在药物合成中的新进展(2019~2022)[J]. 有机化学, 2024, 44(2): 378-397. |
| [2] | 李鹏辉, 谢青洋, 万福贤, 张元红, 姜林. 含环丙基的新型取代嘧啶-5-甲酰胺的合成及杀菌活性研究[J]. 有机化学, 2024, 44(2): 650-656. |
| [3] | 邹发凯, 王能中, 姚辉, 王慧, 刘明国, 黄年玉. 1β-/3R-芳基硫代糖的区域与立体选择性合成[J]. 有机化学, 2024, 44(2): 593-604. |
| [4] | 李路瑶, 贺忠文, 张振国, 贾振华, 罗德平. 三芳基碳正离子在有机合成中的应用[J]. 有机化学, 2024, 44(2): 421-437. |
| [5] | 梅青刚, 李清寒. 可见光促进C(3)(杂)芳硫基吲哚化合物的合成研究进展[J]. 有机化学, 2024, 44(2): 398-408. |
| [6] | 杨维清, 葛宴兵, 陈元元, 刘萍, 付海燕, 马梦林. 1,8-萘酰亚胺衍生物的设计、合成及其对半胱氨酸的识别研究[J]. 有机化学, 2024, 44(1): 180-194. |
| [7] | 赵茜帆, 陈永正, 张世明. 碳基非金属催化剂在有机合成领域的应用及机理研究[J]. 有机化学, 2024, 44(1): 137-147. |
| [8] | 陈珊, 陈志林, 胡琼, 蒙艳双, 黄悦, 陶萍芳, 卢丽如, 黄国保. 含双硫脲基团分子钳在非极性溶剂中识别中性分子[J]. 有机化学, 2024, 44(1): 277-281. |
| [9] | 王化坤, 任晓龙, 宣宜宁. 卤盐催化的α,β-环氧羧酸酯与异氰酸酯[3+2]环加成反应研究[J]. 有机化学, 2024, 44(1): 251-258. |
| [10] | 金玉坤, 任保轶, 梁福顺. 可见光介导的三氟甲基的选择性C-F键断裂及其在偕二氟类化合物合成中的应用[J]. 有机化学, 2024, 44(1): 85-110. |
| [11] | 马翠云, 罗海澜, 张福华, 郭丹, 陈树兴, 王飞. 3-Pyrrolyl BODIPY的绿色生物合成、光物理性质及应用研究[J]. 有机化学, 2024, 44(1): 216-223. |
| [12] | 王博珍, 张婕, 粘春惠, 金茗茗, 孔苗苗, 李物兰, 何文斐, 吴建章. 含有3,4-二氯苯基的酰胺类化合物的合成及抗肿瘤活性研究[J]. 有机化学, 2024, 44(1): 232-241. |
| [13] | 于士航, 刘嘉威, 安碧玉, 边庆花, 王敏, 钟江春. 黑腹尼虎天牛接触性信息素的不对称合成[J]. 有机化学, 2024, 44(1): 301-308. |
| [14] | 李阳, 袁锦鼎, 赵頔. 低共熔溶剂1,3-二甲基脲/L-(+)-酒石酸中(E)-2-苯乙烯基喹啉-3-羧酸类衍生物的绿色合成[J]. 有机化学, 2023, 43(9): 3268-3276. |
| [15] | 岁丹丹, 岑南楠, 龚若蕖, 陈阳, 陈文博. 无支持电解质条件下连续流电化学合成三氟甲基化氧化吲哚[J]. 有机化学, 2023, 43(9): 3239-3245. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||