有机化学 ›› 2021, Vol. 41 ›› Issue (1): 144-157.DOI: 10.6023/cjoc202006014 上一篇 下一篇
综述与进展
收稿日期:2020-06-10
修回日期:2020-07-24
发布日期:2020-08-11
通讯作者:
黄菲
作者简介:基金资助:
Feiyu Wanga, Zhipeng Zhanga,c, Fei Huanga,b,*( )
)
Received:2020-06-10
Revised:2020-07-24
Published:2020-08-11
Contact:
Fei Huang
Supported by:文章分享

对近10年来均相过渡金属、非金属及多相催化剂催化重氮酯O—H插入反应的研究进展进行综述. 重点阐述了各类催化剂的结构、催化体系及其在药物研发和有机合成方面的应用. 底物重氮酯易于制备, 催化剂廉价易得, 反应过程中形成的卡宾中间体反应活性高, 因此O—H插入反应可在温和条件下发生, 高效构筑C—O键, 并获得可观的收率和对映选择性, 有利于手性药物的开发和合成. 最后, 对O—H插入反应及产物的绿色合成进行展望.
王飞雨, 张志朋, 黄菲. 基于重氮酯的O—H插入反应研究进展[J]. 有机化学, 2021, 41(1): 144-157.
Feiyu Wang, Zhipeng Zhang, Fei Huang. Research Progress of O—H Insertion Reaction Based on Diazo Ester[J]. Chinese Journal of Organic Chemistry, 2021, 41(1): 144-157.
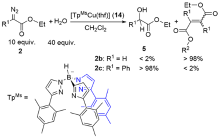
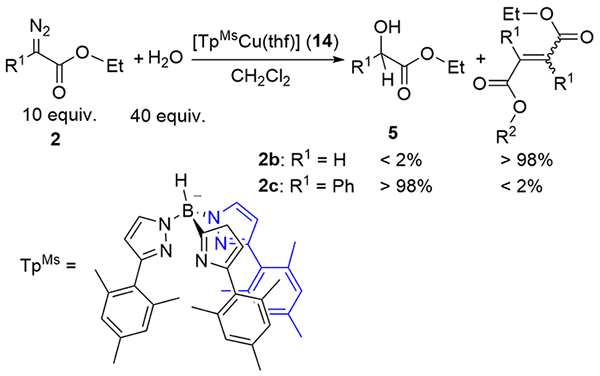
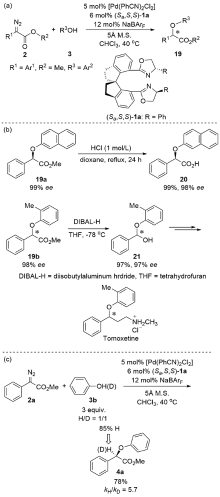
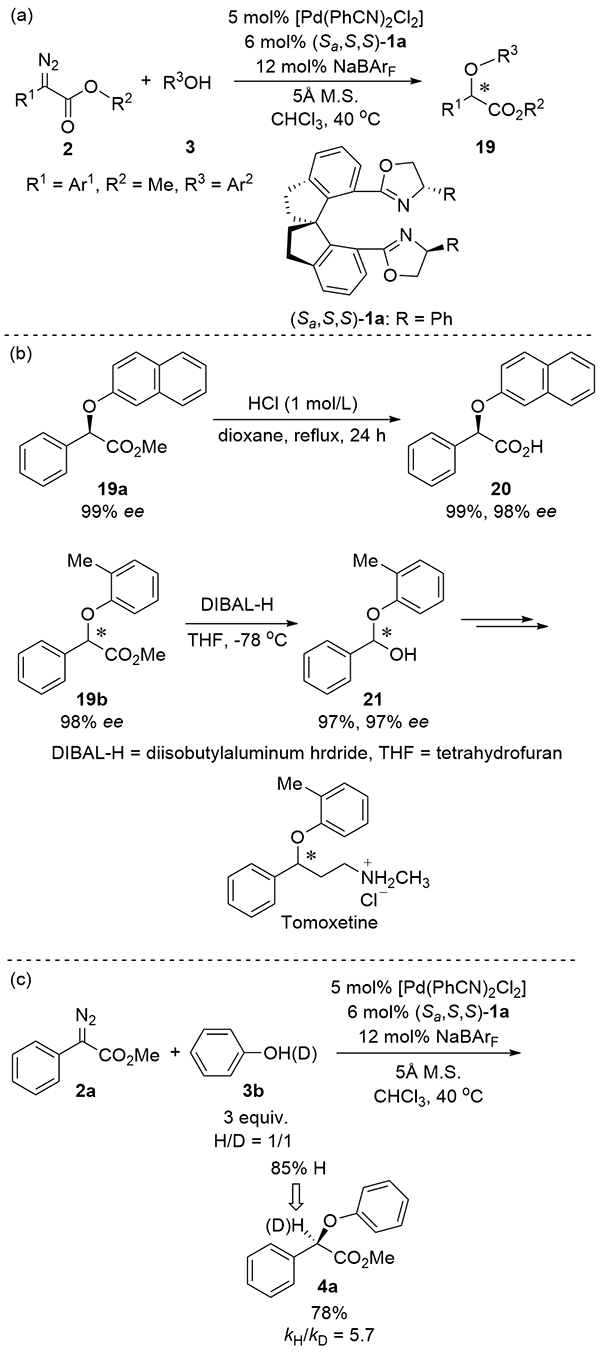
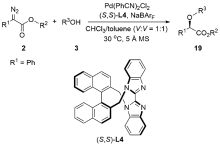
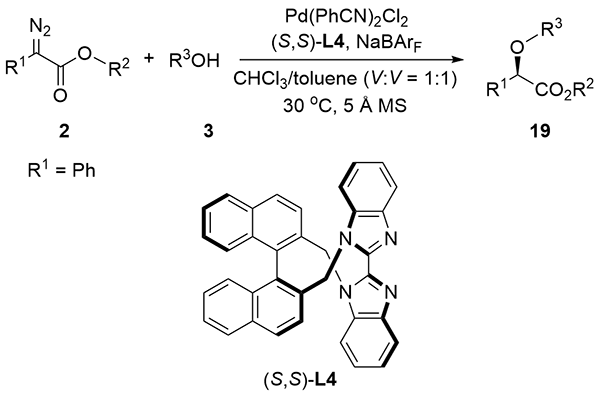
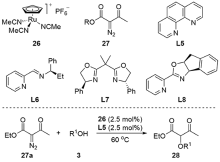

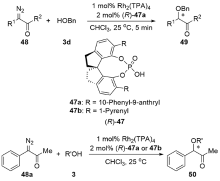
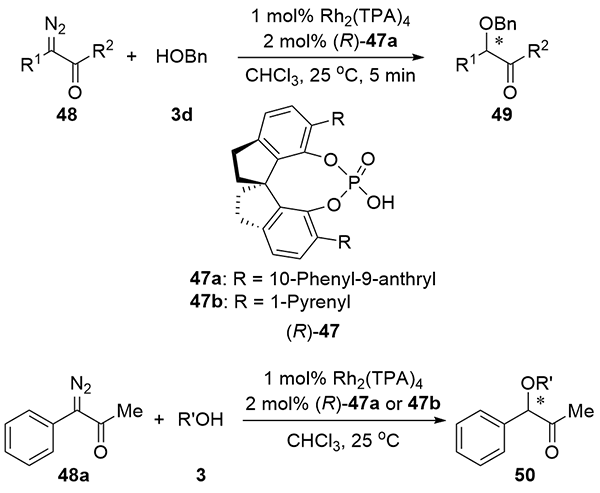
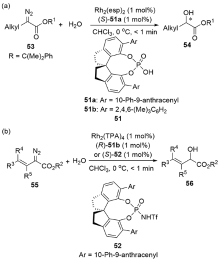
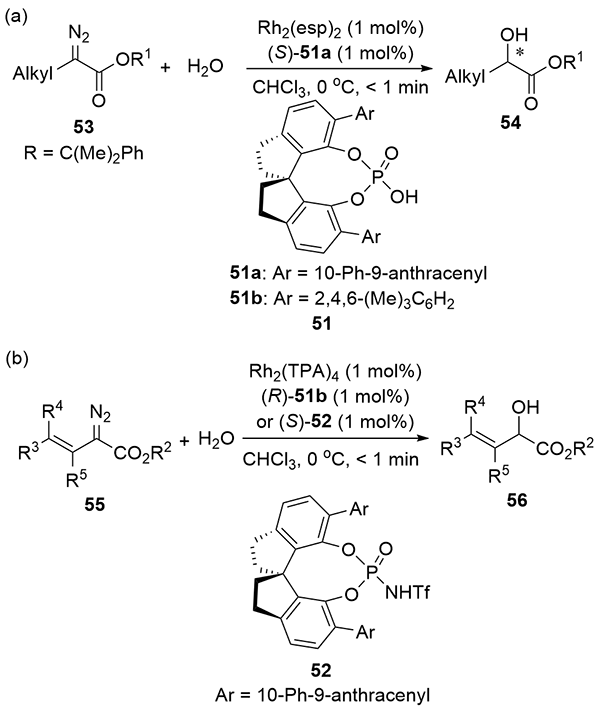
| [1] |
Mix K.A.; Aronoff M.R.; Raines R.T. ACS Chem. Biol. 2016, 11, 3233.
|
| [2] |
Doyle M.P.; McKervey M.A. Chem. Commun. 1997, 983.
|
| [3] |
(a) Doscher M.S.; Wilcox P.E. J. Biol. Chem. 1961, 236, 1328.
|
|
(b) Riehm J.P.; Scheraga H.A. Biochemistry 1965, 4, 772.
|
|
|
(c) Bayley H.; Knowles J.R. Methods Enzymol. 1977, 46, 69.
|
|
|
(d) Chowdhry V.; Westheimer F.H. Rev. Biochem. 1979, 48, 293.
|
|
| [4] |
(a) Nozaki H.; Moriuti S.; Takaya H.; Noyori R. Tetrahedron Lett. 1966, 7, 5239.
|
|
(b) Wolff L. Justus Liebigs Ann. Chem. 1902, 325, 129.
|
|
|
(c) Kirmse W. Eur. J. Org. Chem. 2002, 2193.
|
|
|
(d) Guo X.; Hu W.H. Acc. Chem. Res. 2013, 46, 2427.
|
|
|
(e) Qi C.R.; Yan D.H.; Xiong W.F.; Jiang H.F. Chin. J. Chem. 2018, 36, 399.
|
|
| [5] |
(a) Dzik W.I.; Xu X.; Zhang X.P.; Reek J.N.H.; Bruin B. J. Am. Chem. Soc. 2010, 132, 10891.
|
|
(b) Knight A.M.; Kan S.B.J.; Lewis R.D.; Brandenberg O.F.; Chen K.; Arnold F.H. ACS Cent. Sci. 2018, 4, 372.
|
|
| [6] |
Tyman J.H.P. Synthetic and Natural Phenols, Elsevier, Amsterdam , 1996.
|
| [7] |
(a) Lei Z.; Chen W.G.; Zhang M.; Napoli J.L. Biochemistry 2003, 42, 4190.
|
|
(b) Gregoire F.M.; Zhang F.; Clarke H.J.; Gustafson T.A.; Sears D.D.; Favelyukis S.; Lenhard J.; Rentzeperis D.; Clemens L.E.; Mu Y.; Lavan B.E. Mol. Endocrinol. 2009, 23, 975.
|
|
|
(c) Brodsky E.S.; Klyuev N.A.; Smirnova O.B.; Dovgilievitz A.V.; Grandberg I.I. Int. J. Environ. Anal. Chem. 1994, 56, 11.
|
|
| [8] |
Zhu S.F.; Cai Y.; Mao H.X.; Xie J.H.; Zhou Q.L. Nat. Chem. 2010, 2, 546.
|
| [9] |
Mbuvi H.M.; Klobukowski E.R.; Roberts G.M.; Woo L.K. J. Porphyrins Phthalocyanines 2010, 14, 284.
|
| [10] |
Zhu S.F.; Chen W.Q.; Zhang Q.Q.; Mao H.X.; Zhou Q.L. Synlett 2011, 919.
|
| [11] |
Pereira A.; Champouret Y.; Martín C.; Alvarez E.; Etienne M.; Belderraín T.R.; Perez. P. J. Chem.-Eur. J. 2015, 21, 9769.
|
| [12] |
Xie X.L.; Zhu S.F.; Guo J.X.; Cai Y.; Zhou Q.L. Angew. Chem., Int. Ed. 2014, 53, 2978.
|
| [13] |
Devine P.N.; Heid R.M.; Tschaen D.M. Tetrahedron 1997, 53, 6739.
|
| [14] |
Gao X.; Wu B.; Huang W.X.; Chen M.W.; Zhou Y.G. Angew. Chem., Int. Ed. 2015, 54, 11956.
|
| [15] |
Shen H.Q.; Xie H.P.; Sun L.; Zhou Y.G. Organometallics 2019, 38, 3902.
|
| [16] |
Liu Y.; Luo Z.J.; Zhang J.Z.H.; Xia F. J. Phys. Chem. A 2016, 120, 6485.
|
| [17] |
(a) Gorin D.J.; Toste F.D. Nature 2007, 446, 395.
|
|
(b) Fürstner A.; Davies P.W. Angew. Chem., Int. Ed. 2007, 46, 3410.
|
|
|
(c) Jimenez-Núnez E.; Echavarren A.M. Chem. Rev. 2008, 8, 3326.
|
|
|
(d) Rudolph M.; Hashmi A.S.K. Chem. Soc. Rev. 2012, 41, 2448.
|
|
|
Hashmi A.S.K.; Toste F.D. Modern Gold Catalyzed Synthesis, Wiley-VCH, Weinheim, 2012.
|
|
|
(f) Dorel R.; Echavarren A. M. Chem. Rev. 2015, 115, 9028.
|
|
| [18] |
(a) Zhou Y.B.; Trewyn B.G.; Angelici R.J.; Woo L.K. J. Am. Chem. Soc. 2009, 131, 11734.
|
|
(b) Qian D.Y.; Zhang J.L. Chem. Soc. Rev. 2015, 44, 677.
|
|
|
(c) Wang Y.H.; Muratore M.E.; Echavarren A.M. Chem.-Eur. J. 2015, 21, 7332.
|
|
|
(d) Xie J.; Pan C.D.; Abdukadera A.; Zhu C.J. Chem. Soc. Rev. 2014, 43, 5245.
|
|
|
(e) Wei F.; Song C.L.; Ma Y.D.; Zhou L.; Tung C.H.; Xu Z.H. Sci. Bull. 2015, 60, 1479.
|
|
|
(f) Sugimoto K.; Matsuya Y. Tetrahedron Lett. 2017, 58, 4420.
|
|
|
(g) Kawada Y.; Ohmura S.; Kobayashi M.; Nojo W.; Kondo M.; Matsuda Y.; Zhou J.; Inuki S.; Oishi S.; Wang C.; Saito T.; Uchiyama M.; Suzuki T.; Ohno H. Chem. Sci. 2018, 9, 8416.
|
|
|
(h) Hashmi A.S.K.; Rudolph M. Chem. Soc. Rev. 2012, 41, 2448.
|
|
|
(i) Gorin D.J.; Sherry B.D.; Toste F.D. Chem. Rev. 2008, 108, 3351.
|
|
|
(j) Arcadi A. Chem. Rev. 2008, 108, 3266.
|
|
|
(k) JimØnez-NfflÇez E.; Echavarren A.M. Chem. Rev. 2008, 108, 3326.
|
|
|
(l) Hashmi A.S.K. Chem. Rev. 2007, 107, 3180.
|
|
|
(m) Zhang L.M.; Sun J.W.; Kozmin S.A. Adv. Synth. Catal. 2006, 348, 2271.
|
|
| [19] |
Xi Y.M.; Su Y.J.; Yu Z.Y.; Dong B.L.; McClain E.J.; Lan Y.; Shi X.D. Angew. Chem., Int. Ed. 2014, 53, 9817.
|
| [20] |
Zeineddine A.; Rekhroukh F.; Carrizo E.D.S.; Ladeira S.M.; Miqueu K.; Amgoune A.; Bourissou D. Angew. Chem., Int. Ed. 2018, 57, 1306.
|
| [21] |
Harada S.; Tanikawa K.; Homma H.; Sakai C.; Ito T.; Nemoto T. Chem.-Eur. J. 2019, 25, 12058.
|
| [22] |
Austeri M.; Rix D.; Zeghida W.; Lacour J. Org. Lett. 2011, 13, 1394.
|
| [23] |
Mercier A.; Yeo W.C.; Chou J.; Chaudhuri P.D.; Bernardinelli G.; Kundig E.P. Chem. Commun. 2009, 5227.
|
| [24] |
San H.H.; Wang S.J.; Jiang M.; Tang X.Y. Org. Lett. 2018, 20, 4672.
|
| [25] |
(a) Shibuya M.; Okamoto M.; Fujita S.; Abe M.; Yamamoto Y. ACS Catal. 2018, 8, 4189.
|
|
(b) Yu Z.; Li Y.; Shi J.; Ma B.; Liu L.; Zhang J. Angew. Chem., Int. Ed. 201 6, 55, 14807.
|
|
| [26] |
Couch E.D.; Auvil T.J.; Mattson A.E. Chem.-Eur. J. 2014, 20, 8283.
|
| [27] |
(a) Hart H.; Lin L.T.W. Mol. Cryst. Liq. Cryst. 1986, 137, 277.
|
|
(b) Etter M.C.; Panunto T.W. J. Am. Chem. Soc. 1988, 110, 5896.
|
|
|
(c) Etter M.C.; Urbanczyk-Lipkowsa Z.; Zia-Ebrahimi M.; Panunto T.W. J. Am. Chem. Soc. 1990, 112, 8415.
|
|
|
(d) Etter M.C. Acc. Chem.Res. 1990, 23, 120.
|
|
|
(e) Etter M.C. J. Phys. Chem. 1991, 95, 4601.
|
|
|
(f) Bhattacharyya S.; Bhattacherjee A.; Shirhatti P.R.; Wategaonkar S. J. Phys. Chem. A 2013, 117, 8238.
|
|
|
(g) Howard D.L.; Kjaergaard H.G. Phys. Chem. Chem. Phys. 2008, 10, 4113.
|
|
|
(h) Wierzejewska M.; Sadyka M. J. Mol. Struct. 2006, 786, 33.
|
|
|
(i) Ueyama N.; Nishikawa N.; Yamada Y.; Okamura T.-A.; Nakamura A. J. Am. Chem. Soc. 1996, 118, 12826.
|
|
|
(j) Sherry A.D.; Purcell K.F. J. Am. Chem. Soc. 1972, 94, 1848.
|
|
| [28] |
Barluenga J.; Tomas-Gamasa M.; Aznar F.; Valdes C. Angew. Chem., Int. Ed. 2010, 49, 4993.
|
| [29] |
Cui H.; Wang Y.X.; Wang Y.H.; Fan Y.Z.; Zhang L.; Su C.Y. CrysEngComm 2016, 18, 2203.
|
| [30] |
Wang Y.X.; Cui H.; Zhang L.; Su C.Y. ChemCatChem 2018, 10, 3901.
|
| [31] |
Anding B.J.; Ellern A.; Woo L.K. Organometallics 2014, 33, 2219.
|
| [32] |
Zhao X.; Zhang Y.; Wang J. Chem. Commun. 2012, 48, 10162.
|
| [33] |
Li M.L.; Chen M.Q.; Xu B.; Zhu S.F.; Zhou Q.L. Acta Chim. Sinica 2018, 76, 883.
|
|
( 李茂霖, 陈梦青, 徐彬, 朱守非, 周其林, 化学学报, 2018, 76, 883.).
|
|
| [34] |
Li Y.; Zhao Y.T.; Zhou T.; Chen M.Q.; Li Y.P.; Huang M.Y.; Xu Z.C.; Zhu S.F.; Zhou Q.L. J. Am. Chem. Soc. 2020, 142, 10557.
|
| [35] |
Gallo R.D.C.; Burtoloso A.C.B. Green Chem. 2018, 20, 4547.
|
| [36] |
Rudrawar S.; Besra R.C.; Chakraborti A.K. Synthesis 2006, 2767.
|
|
(b) Chakraborti A.K.; Gulhane R. Chem. Commun. 2003, 1896.
|
|
|
(c) Chakraborti A.K.; Chankeshwara S.V. Org. Biomol. Chem. 2006, 4, 2769.
|
|
| [37] |
Zhang Z.P.; Yu Y.; Huang F.; Yi X.Y.; Xu Y.; He Y.D.; Baelld J.B.; Huang H. Green Chem. 2020, 22, 1594.
|
| [38] |
Zhu C.H.; Xu G.Y.; Ding D.; Qiu L.; Sun J.T. Org. Lett. 2015, 17, 4244.
|
| [39] |
(a) Yang G.; Zu Y.G.; Zhou L.J. J. Phys. Org. Chem. 2008, 21, 34.
|
|
(b) Gomes J.R.B. J. Phys. Chem. A 2009, 113, 1628.
|
|
|
(c) Brines L.M.; Coggins M.K.; Poon P.C.Y.; Toledo S.; Kaminsky W.; Kirk M.L.; Kovacs J.A. J. Am. Chem. Soc. 2015, 137, 2253.
|
|
|
(d) Cao Y.H.; Shih W.C.; Ozerov O.V. Organometallics 2019, 38, 4076.
|
|
| [40] |
Dias M.P.; Burtoloso A.C.B. Org. Lett. 2016, 18, 3034.
|
| [1] | 刘继宇, 李圣玉, 陈款, 朱茵, 张元. 三苯胺功能化有序介孔聚合物作为无金属光催化剂用于二硫化物合成[J]. 有机化学, 2024, 44(2): 605-612. |
| [2] | 欧世国, 柴瑞瑞, 李家豪, 王大伟, 桑欣欣. 金属-有机框架衍生的植酸铁催化氢转移高效制备2-芳基苯并噁唑[J]. 有机化学, 2023, 43(8): 2934-2945. |
| [3] | 廖旭, 王泽宇, 唐武飞, 林金清. 多孔有机聚合物用于化学固定二氧化碳的研究进展[J]. 有机化学, 2023, 43(8): 2699-2710. |
| [4] | 刘双, 邹亮华, 王晓明. 均相钴催化氨硼烷的脱氢及转移氢化反应的研究进展[J]. 有机化学, 2023, 43(5): 1713-1725. |
| [5] | 莫百川, 陈春霞, 彭进松. 木质素及其衍生物负载金属催化剂在有机合成中的应用研究进展[J]. 有机化学, 2023, 43(4): 1215-1240. |
| [6] | 苏沛锋, 倪金煜, 柯卓锋. 二氧化碳硅氢化及相关转化的均相催化体系研究进展[J]. 有机化学, 2023, 43(10): 3526-3543. |
| [7] | 刘瑞生, 付双敏, 楚秀民, 张灵莉, 丁柔, 赵先恩, 岳会兰, 魏伟. 可见光诱导α-重氮酯的脱氮氧合反应构建α-氧代酰亚胺酯[J]. 有机化学, 2022, 42(8): 2462-2470. |
| [8] | 白瑞, 刘旭娟, 罗文钰, 刘珊珊, 焦林郁. 多相催化体系下Chan-Lam偶联反应的研究进展[J]. 有机化学, 2022, 42(8): 2342-2354. |
| [9] | 肖剑, 武志英, 陈姿依, 赵朋飞, 刘春艳. 四乙烯五胺功能化酚醛树脂作为Knoevenagel缩合反应的高活性酸碱双功能催化剂[J]. 有机化学, 2022, 42(4): 1179-1187. |
| [10] | 黄强, 邓婷婷, 朱佳运, 李军, 黎飞飞. Ag-Cu负载的胺基石墨烯催化β-羟基-1,2,3-三唑绿色合成研究[J]. 有机化学, 2022, 42(2): 534-542. |
| [11] | 王鹏, 杨妲, 刘欢. 1,3-二烯烃的羰基化反应研究进展[J]. 有机化学, 2021, 41(9): 3379-3389. |
| [12] | 陈鑫, 陈春霞, 彭进松. 纤维素及其衍生物负载铜催化有机反应的研究进展[J]. 有机化学, 2021, 41(4): 1319-1336. |
| [13] | 赵保丽, 杨良凤, 程凯, 周丽云, 万结平. 无过渡金属条件下可见光诱导α-重氮酯的氧化合成α-酮酯[J]. 有机化学, 2021, 41(12): 4732-4737. |
| [14] | 陈育萱, 陈奇, 张占辉. 共价有机框架材料作为非均相配体在有机合成中的应用[J]. 有机化学, 2021, 41(10): 3826-3843. |
| [15] | 黄文斌, 邱丽琪, 任方煜, 何良年. 过渡金属催化CO2氢化反应研究进展[J]. 有机化学, 2021, 41(10): 3914-3934. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||