有机化学 ›› 2021, Vol. 41 ›› Issue (1): 126-143.DOI: 10.6023/cjoc202006021 上一篇 下一篇
综述与进展
仝明慧a, 张欣宇a, 王也铭b,*( ), 王自坤a,*(
), 王自坤a,*( )
)
收稿日期:2020-06-12
修回日期:2020-07-15
发布日期:2020-08-19
通讯作者:
王也铭, 王自坤
作者简介:基金资助:
Minghui Tonga, Xinyu Zhanga, Yeming Wangb,*( ), Zikun Wanga,*(
), Zikun Wanga,*( )
)
Received:2020-06-12
Revised:2020-07-15
Published:2020-08-19
Contact:
Yeming Wang, Zikun Wang
Supported by:文章分享

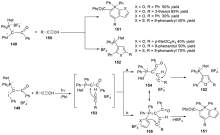
自首个有关叶立德的反应被报道以来, 它们就成为有机化学中的一个重要研究方向. 其中碘叶立德因兼具碘化合物和叶立德的独特反应性受到了人们的广泛关注. 先概括性地阐述了碘叶立德的制备方法和结构性质, 然后对其在有机合成中的应用做了详细的描述, 包括碘叶立德作为有效的卡宾前体在插入反应、环丙烷化反应中的应用及其在环加成反应、重排反应和卤化反应中的研究进展.
仝明慧, 张欣宇, 王也铭, 王自坤. 碘叶立德的化学反应研究进展[J]. 有机化学, 2021, 41(1): 126-143.
Minghui Tong, Xinyu Zhang, Yeming Wang, Zikun Wang. Advances in Reactions of Iodonium Ylides[J]. Chinese Journal of Organic Chemistry, 2021, 41(1): 126-143.

| [1] |
Wittig G.; Geissler G. Justus Liebigs Ann. Chem. 1953, 580, 44.
|
| [2] |
Gudriniece E.; Neiland O.; Vanags G. Russ. J. Gen. Chem. 1957, 27, 2737.
|
| [3] |
Yang R.-Y.; Dai L.-X. Chin. J. Org. Chem. 1994, 14, 113.
|
|
( 杨瑞阳, 戴立信, 有机化学, 1994, 14, 113.).
|
|
| [4] |
Hadjiarapoglou L.; Spyroudis S.; Varvoglis A. J. Am. Chem. Soc. 1985, 107, 7178.
|
| [5] |
Zhu S.-Z.; Chen Q.-Y. J. Chem. Soc., Chem. Commun. 1990, 1459.
|
| [6] |
Hackenberg J.; Hanack M. J. Chem. Soc., Chem. Commun. 1991, 470.
|
| [7] |
Goudreau S.R.; Marcoux D.; Charette A.B. J. Org. Chem. 2009, 74, 470.
|
| [8] |
Yu J.; Liu S.S.; Cui J.; Hou X.S.; Zhang C. Org. Lett. 2012, 14, 832.
|
| [9] |
Yoshimura A.; Nemykin V.N.; Zhdankin V.V. Chem.-Eur. J. 2011, 17, 10538.
|
| [10] |
Zhu C.J.; Yoshimura A.; Ji L.; Wei Y.Y.; Nemykin V.N.; Zhdankin V.V. Org. Lett. 2012, 14, 3170.
|
| [11] |
Geary G.C.; Hope E.G.; Singh K.; Stuart A.M. RSC Adv. 2015, 5, 16501.
|
| [12] |
Doyle M.P.; Tamblyn W.H.; Bagheri V. J. Org. Chem. 1981, 46, 5094.
|
| [13] |
Padwa A.; Hornbuckle S.F. Chem. Rev. 1991, 91, 263.
|
| [14] |
Doyle M.P.; Forbes D.C.; Vasbinder M.M.; Peterson C.S. J. Am. Chem. Soc. 1998, 120, 7653.
|
| [15] |
Ochiai M.; Kitagawa Y.; Yamamoto S. J. Am. Chem. Soc. 1997, 119, 11598.
|
| [16] |
Arduengo A.J.; Kline M.; Calabrese J.C.; Davidson F. J. Am. Chem. Soc. 1991, 113, 9704.
|
| [17] |
Yang R.-Y.; Dai L.-X.; Chen C.-G. J. Chem. Soc., Chem. Commun. 1992, 1487.
|
| [18] |
Zhu S.-Z. Heteroat. Chem. 1994, 5, 9.
|
| [19] |
Nishimura T.; Iwasaki H.; Takahashi M.; Takeda M. J. Radioanal. Nucl. Chem. 2003, 255, 499.
|
| [20] |
Ivanov A.S.; Popov I.A.; Boldyrev A.I.; Zhdankin V.V. Angew. Chem., Int. Ed. 2014, 53, 9617.
|
| [21] |
Müller P.; Fernandez D. Helv. Chim. Acta 1995, 78, 947.
|
| [22] |
Moriarty R.M.; May E.J.; Prakash O. Tetrahedron Lett. 1997, 38, 4333.
|
| [23] |
Lee Y.R.; Cho B.S. Bull. Korean Chem. Soc. 2002, 23, 779.
|
| [24] |
Batsila C.; Gogonas E.P.; Kostakis G.; Hadjiarapoglou L.P. Org. Lett. 2003, 5, 1511.
|
| [25] |
Adam W.; Gogonas E.P.; Hadjiarapoglou L.P. Tetrahedron 2003, 59, 7929.
|
| [26] |
Gomes L.F.; Veiros L.F.; Maulide N.; Afonso C.A. Chem.-Eur. J. 2015, 21, 1449.
|
| [27] |
Saito M.; Kobayashi Y.; Tsuzuki S.; Takemoto Y. Angew. Chem., Int. Ed. 2017, 56, 7653.
|
| [28] |
Guo J.; Liu X.; He C.; Tan F.; Dong S.; Feng X. Chem. Commun. 2018, 54, 12254.
|
| [29] |
Moriarty R.M.; Prakash O.; Vaid R.K.; Zhao L. J. Am. Chem. Soc. 1989, 111, 6443.
|
| [30] |
Ochiai M.; Kitagawa Y. J. Org. Chem. 1999, 64, 3181.
|
| [31] |
Tao J.; Estrada C.D.; Murphy G.K. Chem. Commun. 2017, 53, 9004.
|
| [32] |
Zhang X.; Zeng R.; Feng X.; Dai Q.-S.; Liu Y.; Liu Y.-Q.; Wang Q.-W.; Li Q.-Z.; Li J.-L. Asian J. Org. Chem. 2018, 7, 2065.
|
| [33] |
Chidley T.; Murphy G.K. Org. Biomol. Chem. 2018, 16, 8486.
|
| [34] |
Chidley T.; Jameel I.; Rizwan S.; Peixoto P.A.; Pouységu L.; Quideau S.; Hopkins W.S.; Murphy G.K. Angew. Chem., Int. Ed. 2019, 58, 16959.
|
| [35] |
Hadjiarapoglou L.P. Tetrahedron Lett. 1987, 28, 4449.
|
| [36] |
Gogonas E.P.; Hadjiarapoglou L.P. Tetrahedron Lett. 2000, 41, 9299.
|
| [37] |
Paizanos K.; Charalampou D.; Kourkoumelis N.; Kalpogiannaki D.; Hadjiarapoglou L.; Spanopoulou A.; Lazarou K.; Manos M.J.; Tasiopoulos A.J.; Kubicki M.; Hadjikakou S.K. Inorg. Chem. 2012, 51, 12248.
|
| [38] |
Zhu C.; Yoshimura A.; Solntsev P.; Ji L.; Wei Y.; Nemykin V.N.; Zhdankin V.V. Chem. Commun. 2012, 48, 10108.
|
| [39] |
Koser G.F.; Yu S.-M. J. Org. Chem. 1975, 40, 1166.
|
| [40] |
Koser G.F.; Yu S.-M. J. Org. Chem. 1976, 41, 125.
|
| [41] |
Huang X.C.; Liu Y.L.; Liang Y.; Pi S.F.; Wang F.; Li J.H. Org. Lett. 2008, 10, 1525.
|
| [42] |
Pi S.-F.; Li W.-G.; Cai B.; Xiao H.-B.; Sun H.-Z. Synlett 2016, 27, 794.
|
| [43] |
Laevens B.A.; Tao J.; Murphy G.K. J. Org. Chem. 2017, 82, 11903.
|
| [44] |
Zhao Z.; Luo Y.; Liu S.; Zhang L.; Feng L.; Wang Y. Angew. Chem., Int. Ed. 2018, 57, 3792.
|
| [45] |
Xiong Y.-J.; Shi S.-Q.; Hao W.-J.; Tu S.-J.; Jiang B. Org. Chem. Front. 2018, 5, 3483.
|
| [46] |
Matveeva E.D.; Podrugina T.A.; Pavlova A.S.; Mironov A.V.; Zefirov N.S. Russ. Chem. Bull. 2008, 57, 2237.
|
| [47] |
Matveeva E.D.; Podrugina T.A.; Pavlova A.S.; Mironov A.V.; Gleiter R.; Zefirov N.S. Eur. J. Org. Chem. 2009, 2323.
|
| [48] |
Matveeva E.D.; Podrugina T.A.; Pavlova A.S.; Mironov A.V.; Borisenko A.A.; Gleiter R.; Zefirov N.S. J. Org. Chem. 2009, 74, 9428.
|
| [49] |
Matveeva E.D.; Podrugina T.A.; Taranova M.A.; Vinogradov D.S.; Gleiter R.; Zefirov N.S. J. Org. Chem. 2013, 78, 11691.
|
| [50] |
Matveeva E.D.; Podrugina T.A.; Taranova M.A.; Ivanova A.M.; Gleiter R.; Zefirov N.S. J. Org. Chem. 2012, 77, 5770.
|
| [51] |
Nekipelova T.D.; Taranova M.A.; Matveeva E.D.; Kuz’min V.A.; Zefirov N.S. Kinet. Catal. 2015, 56, 403.
|
| [52] |
Nekipelova T.D.; Podrugina T.A.; Vinogradov D.S.; Dem’yanov P.I.; Kuzmin V.A. Kinet. Catal. 2019, 60, 44.
|
| [53] |
Nekipelova T.D.; Kasparov V.V.; Kovarskii A.L.; Vorobiev A.K.; Podrugina T.A.; Vinogradov D.S.; Kuzmin V.A.; Zefirov N.S. Dokl. Phys. Chem. 2017, 474, 109.
|
| [54] |
Nekipelova T.D.; Podrugina T.A. Kinet. Catal. 2020, 61, 159.
|
| [55] |
Levina I.I.; Klimovich O.N.; Vinogradov D.S.; Podrugina T.A.; Bormotov D.S.; Kononikhin A.S.; Dement'eva O.V.; Senchikhin I.N.; Nikolaev E.N.; Kuzmin V.A.; Nekipelova T.D. J. Phys. Org. Chem. 2018, 31, e3844.
|
| [56] |
Kirmse W.; Kapps M. Chem. Ber. 1968, 101, 994.
|
| [57] |
Xu B.; Tambar U.K. J. Am. Chem. Soc. 2016, 138, 12073.
|
| [58] |
Xu B.; Gartman J.; Tambar U.K. Tetrahedron 2017, 73, 415.
|
| [59] |
Xu B.; Tambar U.K. Angew. Chem., Int. Ed. 2017, 56, 9868.
|
| [60] |
Gondo K.; Kitamura T. Molecules 2012, 17, 6625.
|
| [61] |
Murphy G.; Tao J.; Tuck T. Synthesis 2015, 48, 772.
|
| [62] |
Rotstein B.H.; Stephenson N.A.; Vasdev N.; Liang S.H. Nat. Commun. 2014, 5, 4365.
|
| [63] |
Calderwood S.; Collier T.L.; Gouverneur V.; Liang S.H.; Vasdev N. J. Fluorine Chem. 2015, 178, 249.
|
| [64] |
Stephenson N.A.; Holland J.P.; Kassenbrock A.; Yokell D.L.; Livni E.; Liang S.H.; Vasdev N. J. Nucl. Med. 2015, 56, 489.
|
| [65] |
Jung Y.W.; Gu G.; Raffel D.M. J. Labelled Compd. Radiopharm. 2019, 62, 835.
|
| [66] |
Petersen I.N.; Villadsen J.; Hansen H.D.; Madsen J.; Jensen A.A.; Gillings N.; Lehel S.; Herth M.M.; Knudsen G.M.; Kristensen J.L. Org. Biomol. Chem. 2017, 15, 4351.
|
| [67] |
Jakobsson J.E.; Riss P.J. RSC Adv. 2018, 8, 21288.
|
| [68] |
Yang Y.D.; Azuma A.; Tokunaga E.; Yamasaki M.; Shiro M.; Shibata N. J. Am. Chem. Soc. 2013, 135, 8782.
|
| [69] |
Huang Z.; Yang Y.D.; Tokunaga E.; Shibata N. Org. Lett. 2015, 17, 1094.
|
| [70] |
Huang Z.; Yang Y.-D.; Tokunaga E.; Shibata N. Asian J. Org. Chem. 2015, 4, 525.
|
| [71] |
Arimori S.; Takada M.; Shibata N. Org. Lett. 2015, 17, 1063.
|
| [72] |
Arimori S.; Takada M.; Shibata N. Dalton. Trans. 2015, 44, 19456.
|
| [73] |
Arimori S.; Matsubara O.; Takada M.; Shiro M.; Shibata N. R. Soc. Open Sci. 2016, 3, 160102.
|
| [74] |
Gondo S.; Matsubara O.; Chachignon H.; Sumii Y.; Cahard D.; Shibata N. Molecules 2019, 24, 221.
|
| [75] |
Wang J.; Jia S.; Okuyama K.; Huang Z.; Tokunaga E.; Sumii Y.; Shibata N. J. Org. Chem. 2017, 82, 11939.
|
| [76] |
Ochiai M.; Okada T.; Tada N.; Yoshimura A. Org. Lett. 2008, 10, 1425.
|
| [77] |
Zhang L.; Kong X.; Liu S.; Zhao Z.; Yu Q.; Wang W.; Wang Y. Org. Lett. 2019, 21, 2923.
|
| [78] |
Zhang L.; Zhao Z.; Wang W.; Liu S.; Wang Y. Org. Lett. 2019, 21, 9171.
|
| [79] |
Gazis T.A.; Mohajeri Thaker B.A.J.; Willcox D.; Ould D.M.C.; Wenz J.; Rawson J.M.; Hill M.S.; Wirth T.; Melen R.L. Chem. Commun. 2020, 56, 3345.
|
| [1] | 陈祖良, 魏颖静, 张俊良. 供体-受体氮杂环丙烷碳-碳键断裂的环加成反应研究进展[J]. 有机化学, 2023, 43(9): 3078-3088. |
| [2] | 孔德亮, 戴闻, 赵怡玲, 陈艺林, 朱红平. 脒基胺硼基硅宾与单酮和二酮的氧化环加成反应研究[J]. 有机化学, 2023, 43(5): 1843-1851. |
| [3] | 戴春波, 夏思奇, 陈晓玉, 杨丽敏. 氮杂环卡宾(NHC)催化[4+3]环加成反应构建4-氨基苯并环庚烯内酯[J]. 有机化学, 2023, 43(3): 1084-1090. |
| [4] | 梁俊秀, 刘亚洲, 王阿木, 吴彦超, 马小锋, 李惠静. 基于原位形成的氮杂邻亚甲基苯醌和卤代萘酚的分子间[4+1]螺环化/去芳香化反应[J]. 有机化学, 2023, 43(11): 3888-3899. |
| [5] | 张维露, 陈绍维, 沈晓. 镍催化苯并硅杂环丁烷与酰基硅烷的[4+2]环化反应[J]. 有机化学, 2023, 43(10): 3635-3643. |
| [6] | 覃小婷, 邹宁, 农彩梅, 莫冬亮. 九元氮杂环化合物合成最新研究进展[J]. 有机化学, 2023, 43(1): 130-155. |
| [7] | 高秋珊, 李蒙, 伍婉卿. 过渡金属催化的异腈插入反应研究进展[J]. 有机化学, 2022, 42(9): 2659-2681. |
| [8] | 王君姣, 吕瑜瑜, 尚永伟, 崔振丽, 王克虎, 黄丹凤, 胡雨来. α-羟基酮类化合物参与的反应研究进展[J]. 有机化学, 2022, 42(8): 2300-2321. |
| [9] | 郭泽, 吴迪, 王丽丽, 段征. BF3•Et2O促进的双烯酮-酚重排合成具有聚集诱导发光(AIE)效应的磷杂七元环化合物[J]. 有机化学, 2022, 42(8): 2481-2487. |
| [10] | 杨治芳, 程乙夫, 张蓓蓓, 董韵怡, 韩驰, 杜云飞. 高价碘试剂介导下的氧化重排反应[J]. 有机化学, 2022, 42(11): 3456-3505. |
| [11] | 安逸, 张放, 蔡志华, 杜广芬. 碱催化α-氰基-β-甲基烯基(杂)芳基酮苯增环反应合成多取代苯[J]. 有机化学, 2021, 41(9): 3625-3632. |
| [12] | 孙佳兵, 苗涛, 李品华, 王磊. t-BuOK促进的还原脱砜/脱氢反应: 选择性合成2-取代的1,3-共轭二烯及其应用[J]. 有机化学, 2021, 41(8): 3144-3156. |
| [13] | 孙忠文, 张聪聪, 陈丽君, 谢惠定, 柳波, 刘丹丹. 三氟乙基酮亚胺参与的催化不对称反应研究进展[J]. 有机化学, 2021, 41(5): 1789-1803. |
| [14] | 兰新婵, 王丽丽, 段征, François Mathey. 磷杂Fries重排反应用于合成2-芘基膦化合物[J]. 有机化学, 2021, 41(3): 1153-1160. |
| [15] | 闫强, 范荣, 刘斌斌, 苏帅松, 王勃, 姚团利, 谭嘉靖. 苯炔参与的去芳构化反应研究进展[J]. 有机化学, 2021, 41(2): 455-470. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||