有机化学 ›› 2023, Vol. 43 ›› Issue (9): 3078-3088.DOI: 10.6023/cjoc202303026 上一篇 下一篇
综述与进展
收稿日期:2023-03-17
修回日期:2023-04-27
发布日期:2023-05-15
基金资助:
Zuliang Chena( ), Yingjing Weia, Junliang Zhangb(
), Yingjing Weia, Junliang Zhangb( )
)
Received:2023-03-17
Revised:2023-04-27
Published:2023-05-15
Contact:
E-mail: Supported by:文章分享

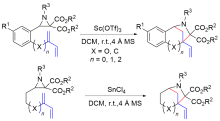
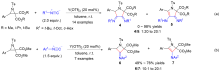
氮杂环丙烷有两种不同的开环方式: 一种是碳-氮键断裂开环, 另一种是碳-碳键断裂开环. 其中, 氮杂环丙烷以碳-氮键断裂的反应已经有很多综述报道. 主要概述了近二十年来供体-受体(Donor-Acceptor, D-A)氮杂环丙烷以碳-碳键断裂的环加成反应研究进展. 在合适催化剂作用下, D-A氮杂环丙烷经碳-碳键断裂开环形成亚胺叶立德, 该叶立德可以和醛、亚胺、烯烃、炔烃和吲哚等发生[3+n]环加成反应.
陈祖良, 魏颖静, 张俊良. 供体-受体氮杂环丙烷碳-碳键断裂的环加成反应研究进展[J]. 有机化学, 2023, 43(9): 3078-3088.
Zuliang Chen, Yingjing Wei, Junliang Zhang. Recent Advances in Cycloaddition Reactions of Donor-Acceptor Aziridines via Carbon-Carbon Bond Cleavage[J]. Chinese Journal of Organic Chemistry, 2023, 43(9): 3078-3088.






| [1] |
(a) Wakaki S.; Marumo H.; Tomoika K.; Shimizu E.; Kato G.; Kamada H.; Kudo S.; Fujimoto Y. Antibiot. Chemother. 1958, 8, 228.
|
|
(b) Hata T.; Sano Y.; Sugawara R.; Matsumae A.; Kanamori K.; Shima T.; Hoshi T. J. Antibiot. 1956, 9, 141.
|
|
| [2] |
(a) Ohno H. Chem. Rev. 2014, 114, 7784.
doi: 10.1021/cr400543u |
|
(b) Wang Q.; Chang H.; Wei W.; Liu Q.; Gao W.; Li Y.; Li X. Chin. J. Org. Chem. 2016, 36, 939. (in Chinese)
|
|
|
(王清宇, 常宏宏, 魏文珑, 刘强, 高文超, 李彦威, 李兴, 有机化学, 2016, 36, 939.)
doi: 10.6023/cjoc201511039 |
|
|
(c) Ilardi E. A.; Njardarson J. T. J. Org. Chem. 2013, 78, 9533.
doi: 10.1021/jo401776s |
|
|
(d) Mack D. J.; Njardarson J. T. ACS Catal. 2013, 3, 272.
doi: 10.1021/cs300771d |
|
|
(e) Kuznetsov M. A.; Kuznetsova L. M.; Pankova A. S. Tetrahedron Lett. 2016, 57, 3575.
doi: 10.1016/j.tetlet.2016.06.116 |
|
| [3] |
Vaultier M.; Carrie R. Tetrahedron Lett. 1978, 19, 1195.
|
| [4] |
Pohlhaus P. D.; Bowman R. K.; Johnson J. S. J. Am. Chem. Soc. 2004, 126, 2294.
pmid: 14982419 |
| [5] |
Li L.; Wu X.; Zhang J. Chem. Commun. 2011, 47, 5049.
doi: 10.1039/c1cc10926j |
| [6] |
Zhan Y.; Liu T.; Ren J.; Wang Z. Chem. Eur. J. 2017, 23, 17862.
doi: 10.1002/chem.v23.71 |
| [7] |
Zhang J.-H.; Pan C.-L.; Zhang H.-H.; Xu P.-F.; Luo Y.-C. Org. Chem. Front. 2021, 8, 2203.
doi: 10.1039/D1QO00228G |
| [8] |
Li L.; Zhang J. Org. Lett. 2011, 13, 5940.
doi: 10.1021/ol202603e |
| [9] |
Wang B.; Liang M.; Tang J.; Deng Y.; Zhao J.; Sun H.; Tung C.-H.; Jia J.; Xu Z. Org. Lett. 2016, 18, 4614.
doi: 10.1021/acs.orglett.6b02253 pmid: 27574831 |
| [10] |
Wu X.; Li L.; Zhang J. Chem. Commun. 2011, 47, 7824.
doi: 10.1039/c1cc12189h |
| [11] |
Jiang Z.; Wang J.; Lu P.; Wang Y. Tetrahedron 2011, 67, 9609.
doi: 10.1016/j.tet.2011.09.085 |
| [12] |
Wu X.; Zhang J. Synthesis 2012, 44, 2147.
doi: 10.1055/s-00000084 |
| [13] |
(a) Feng L.-W.; Ren H.; Xiong H.; Wang P.; Wang L.; Tang Y. Angew. Chem. Int. Ed. 2017, 56, 3055.
doi: 10.1002/anie.v56.11 |
|
(b) Shenje R.; Martin M. C.; France S. Angew. Chem. Int. Ed. 2014, 53, 13907.
doi: 10.1002/anie.201408429 |
|
|
(c) Zhang J.; Chen Z.; Wu H.-H.; Zhang J. Chem. Commun. 2012, 48, 1817.
doi: 10.1039/c2cc16918e |
|
| [14] |
Liu H.; Zheng C.; You S.-L. Chin. J. Chem. 2014, 32, 709.
doi: 10.1002/cjoc.v32.8 |
| [15] |
Cui B.; Ren J.; Wang Z. J. Org. Chem. 2014, 79, 790.
doi: 10.1021/jo402383a pmid: 24328077 |
| [16] |
Tong D.; Wu J.; Bazinski N.; Koo D.; Vemula N.; Pagenkopf B. L. Chem. Eur. J. 2019, 25, 15244.
doi: 10.1002/chem.v25.67 |
| [17] |
Zhou H.; Zeng X.; Ding L.; Xie Y.; Zhong G. Org. Lett. 2015, 17, 2385.
doi: 10.1021/acs.orglett.5b00911 pmid: 25938163 |
| [18] |
Zuo Q.; Shi Z.; Zhan F.; Wang Z.; Lin J.-S.; Jiang Y. Tetrahedron Lett. 2020, 61, 151576.
doi: 10.1016/j.tetlet.2019.151576 |
| [19] |
Garve L. K. B.; Kreft A.; Jones P. G.; Werz D. B. J. Org. Chem. 2017, 82, 9235.
doi: 10.1021/acs.joc.7b01631 |
| [20] |
Shi Z.; Fan T.; Zhang X.; Zhan F.; Wang Z.; Zhao L.; Lin J.-S.; Jiang Y. Adv. Synth. Catal. 2021, 363, 2619.
doi: 10.1002/adsc.v363.10 |
| [21] |
Alajarin M.; Bañon D.; Egea A.; Marín-Luna M.; Orenes R.-A.; Vidal A. Org. Chem. Front. 2018, 5, 2020.
doi: 10.1039/C8QO00255J |
| [22] |
Varshnaya R. K.; Banerjee P. Org. Biomol. Chem. 2017, 15, 5182.
doi: 10.1039/c7ob00941k pmid: 28589982 |
| [23] |
(a) Lee S. G.; Sin S.; Kim S.; Kim S.-G. Tetrahedron Lett. 2018, 59, 1480.
doi: 10.1016/j.tetlet.2018.03.004 |
|
(b) Lee S. G.; Kim S.-G. Tetrahedron 2018, 74, 3671.
doi: 10.1016/j.tet.2018.05.031 |
|
| [24] |
Zou X.; Liu Y.; Shang S.; Yang W.; Deng W. Chin. Chem. Lett. 2020, 31, 1293.
doi: 10.1016/j.cclet.2019.09.002 |
| [25] |
(a) Gulevich A. V.; Zhdanko A. G.; Orru R. V. A.; Nenajdenko V. G. Chem. Rev. 2010, 110, 5235.
doi: 10.1021/cr900411f pmid: 20608735 |
|
(b) Qiu G.; Ding Q.; Wu J. Chem. Soc. Rev. 2013, 42, 5257.
doi: 10.1039/c3cs35507a pmid: 20608735 |
|
| [26] |
Soeta T.; Miyamoto Y.; Fujinami S.; Ukaji Y. Tetrahedron 2014, 70, 6623.
doi: 10.1016/j.tet.2014.06.118 |
| [27] |
Ghosh A.; Pandey A. K.; Banerjee P. J. Org. Chem. 2015, 80, 7235.
doi: 10.1021/acs.joc.5b00705 pmid: 26090694 |
| [28] |
Liao Y.; Liu X.; Zhang Y.; Xu Y.; Xia Y.; Lin L.; Feng X. Chem. Sci. 2016, 7, 3775.
doi: 10.1039/C5SC04151A |
| [29] |
Wu X.; Zhou W.; Wu H.-H.; Zhang J. Chem. Commun. 2017, 53, 5661.
doi: 10.1039/C7CC02906C |
| [30] |
Liao Y.; Zhou B.; Xia Y.; Liu X.; Lin L.; Feng X. ACS Catal. 2017, 7, 3934.
doi: 10.1021/acscatal.7b00787 |
| [31] |
Dong P.; Chen L.; Yang Z.; Dong S.; Feng X. Org. Chem. Front. 2021, 8, 6874.
doi: 10.1039/D1QO01194D |
| [32] |
Xu Y.; Chang F.; Cao W.; Liu X.; Feng X. ACS Catal. 2018, 8, 10261.
doi: 10.1021/acscatal.8b02880 |
| [33] |
(a) Kim S.; Kim S.-G. Asian J. Org. Chem. 2019, 8, 1621.
doi: 10.1002/ajoc.v8.9 |
|
(b) Kim S.-G. B. Korean Chem. Soc. 2019, 40, 747.
doi: 10.1002/bkcs.2019.40.issue-7 |
|
| [34] |
Zhang F.; Sang X.; Zhou Y.; Cao W.; Feng X. Org. Lett. 2022, 24, 1513.
doi: 10.1021/acs.orglett.2c00190 |
| [1] | 孔德亮, 戴闻, 赵怡玲, 陈艺林, 朱红平. 脒基胺硼基硅宾与单酮和二酮的氧化环加成反应研究[J]. 有机化学, 2023, 43(5): 1843-1851. |
| [2] | 戴春波, 夏思奇, 陈晓玉, 杨丽敏. 氮杂环卡宾(NHC)催化[4+3]环加成反应构建4-氨基苯并环庚烯内酯[J]. 有机化学, 2023, 43(3): 1084-1090. |
| [3] | 梁俊秀, 刘亚洲, 王阿木, 吴彦超, 马小锋, 李惠静. 基于原位形成的氮杂邻亚甲基苯醌和卤代萘酚的分子间[4+1]螺环化/去芳香化反应[J]. 有机化学, 2023, 43(11): 3888-3899. |
| [4] | 张维露, 陈绍维, 沈晓. 镍催化苯并硅杂环丁烷与酰基硅烷的[4+2]环化反应[J]. 有机化学, 2023, 43(10): 3635-3643. |
| [5] | 覃小婷, 邹宁, 农彩梅, 莫冬亮. 九元氮杂环化合物合成最新研究进展[J]. 有机化学, 2023, 43(1): 130-155. |
| [6] | 王君姣, 吕瑜瑜, 尚永伟, 崔振丽, 王克虎, 黄丹凤, 胡雨来. α-羟基酮类化合物参与的反应研究进展[J]. 有机化学, 2022, 42(8): 2300-2321. |
| [7] | 安逸, 张放, 蔡志华, 杜广芬. 碱催化α-氰基-β-甲基烯基(杂)芳基酮苯增环反应合成多取代苯[J]. 有机化学, 2021, 41(9): 3625-3632. |
| [8] | 孙佳兵, 苗涛, 李品华, 王磊. t-BuOK促进的还原脱砜/脱氢反应: 选择性合成2-取代的1,3-共轭二烯及其应用[J]. 有机化学, 2021, 41(8): 3144-3156. |
| [9] | 孙忠文, 张聪聪, 陈丽君, 谢惠定, 柳波, 刘丹丹. 三氟乙基酮亚胺参与的催化不对称反应研究进展[J]. 有机化学, 2021, 41(5): 1789-1803. |
| [10] | 闫强, 范荣, 刘斌斌, 苏帅松, 王勃, 姚团利, 谭嘉靖. 苯炔参与的去芳构化反应研究进展[J]. 有机化学, 2021, 41(2): 455-470. |
| [11] | 邹宁, 覃小婷, 王治新, 石维敏, 莫冬亮. α,β-不饱和硝酮的合成及其应用的研究进展[J]. 有机化学, 2021, 41(12): 4535-4553. |
| [12] | 张建涛, 周鹏, 肖朵朵, 刘卫兵. 1,3,5-三嗪烷合成含氮杂环的反应研究进展[J]. 有机化学, 2021, 41(11): 4154-4166. |
| [13] | 张金凤, 叶如意, 李子阳, 孟令国. 1,4-二氮杂二环[2.2.2]辛烷促进三酮单水合物和活泼炔通过连续碳-碳/碳-氧键断裂的加成反应[J]. 有机化学, 2021, 41(11): 4384-4390. |
| [14] | 仝明慧, 张欣宇, 王也铭, 王自坤. 碘叶立德的化学反应研究进展[J]. 有机化学, 2021, 41(1): 126-143. |
| [15] | 丁邦东, 姜业朝, 张瑜, 叶蓉, 孙晶, 颜朝国. 喹啉季铵盐和1,3-茚满二酮及2-芳亚甲基1,3-茚满二酮的环加成反应合成茚满酮类含氮杂环化合物[J]. 有机化学, 2020, 40(4): 1003-1016. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||