有机化学 ›› 2023, Vol. 43 ›› Issue (1): 130-155.DOI: 10.6023/cjoc202206035 上一篇 下一篇
综述与进展
收稿日期:2022-06-21
修回日期:2022-08-10
发布日期:2022-09-01
通讯作者:
莫冬亮
基金资助:
Xiaoting Qin, Ning Zou, Caimei Nong, Dongliang Mo( )
)
Received:2022-06-21
Revised:2022-08-10
Published:2022-09-01
Contact:
Dongliang Mo
Supported by:文章分享
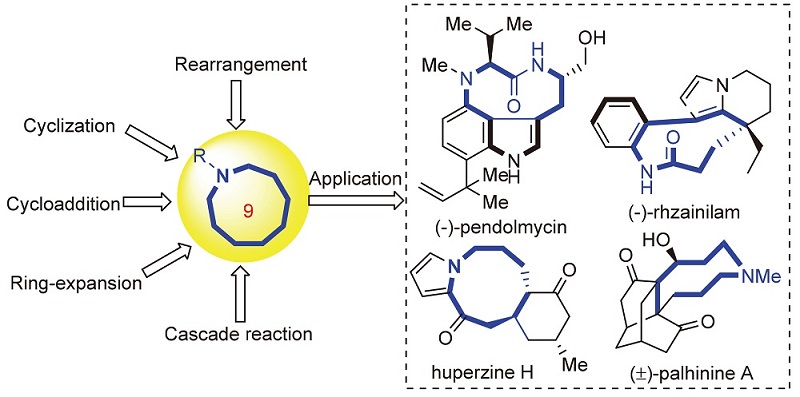
九元氮杂环骨架广泛存在于天然产物和生物活性分子中, 其环系的刚性结构对这类分子的生物活性及药理活性的调控具有重要的作用, 是被广泛关注的中环化合物之一. 由于九元环的熵和环张力的增加, 其合成往往是有机合成中的难点, 特别是环上取代基立体化学的有效控制更是极大挑战之一. 综述了近年来九元氮杂环化合物合成的新策略和新方法, 以及这些策略和方法在合成含九元氮杂环骨架天然产物和药物分子中的应用.
覃小婷, 邹宁, 农彩梅, 莫冬亮. 九元氮杂环化合物合成最新研究进展[J]. 有机化学, 2023, 43(1): 130-155.
Xiaoting Qin, Ning Zou, Caimei Nong, Dongliang Mo. Recent Advances on the Synthesis of Nine-Membered N-Heterocycles[J]. Chinese Journal of Organic Chemistry, 2023, 43(1): 130-155.
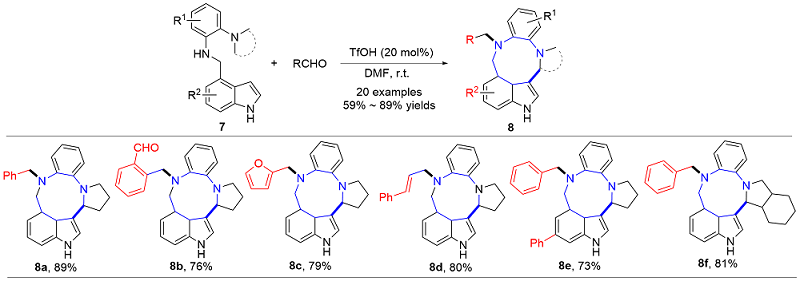
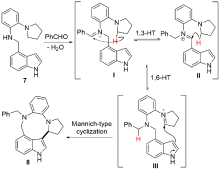
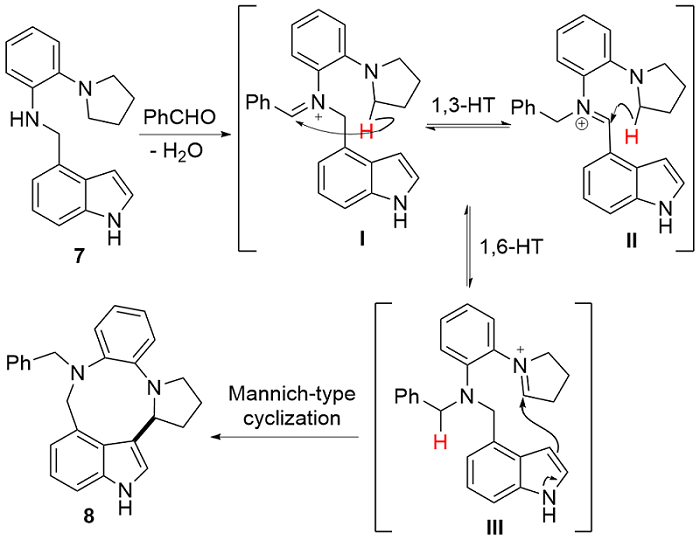
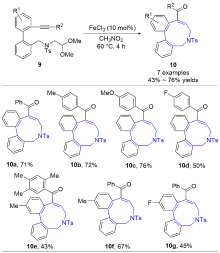
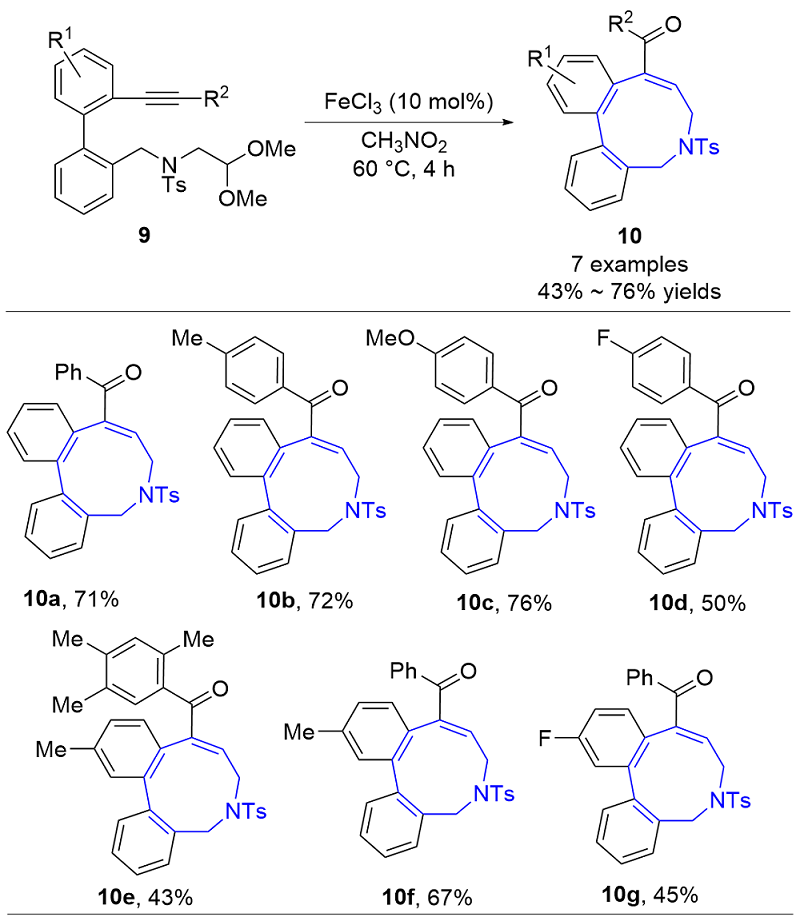
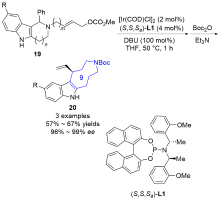
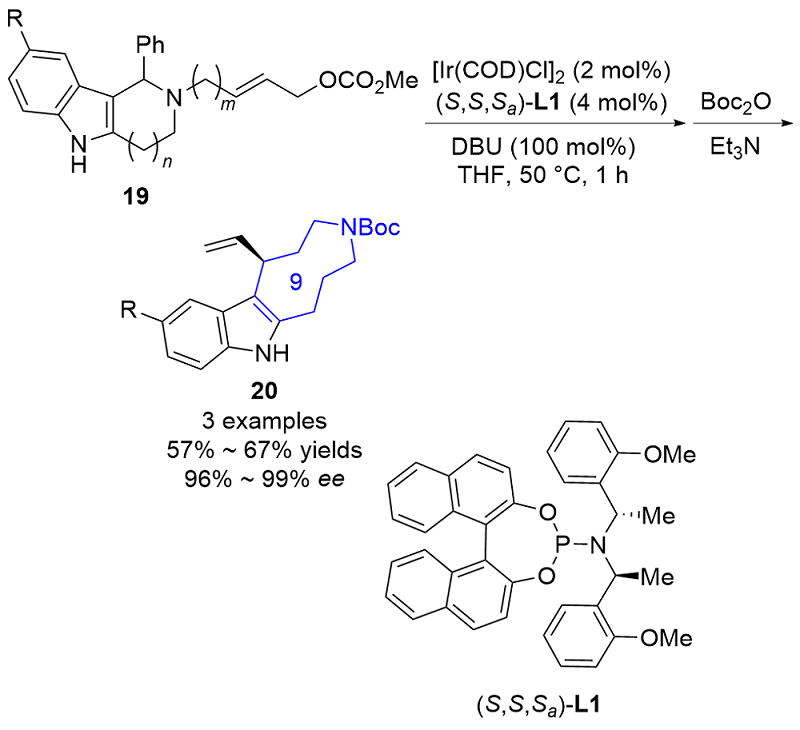
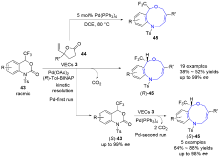
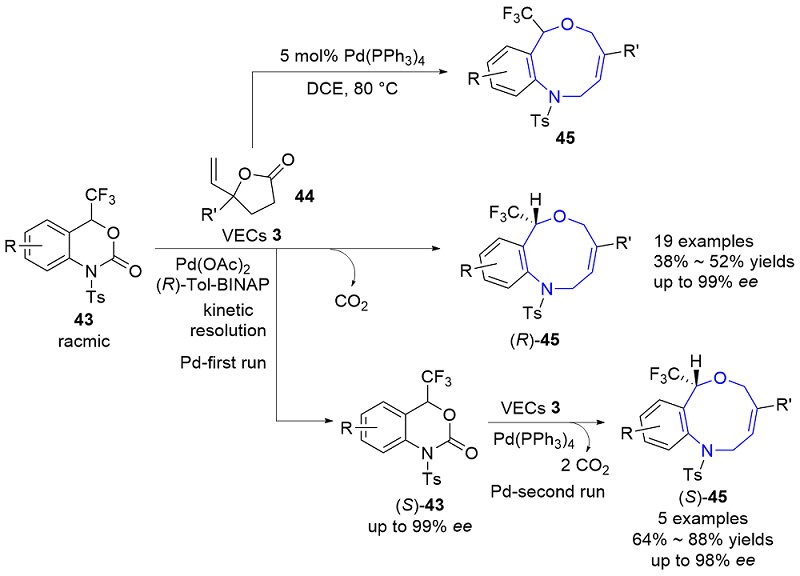
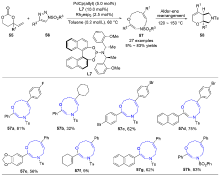


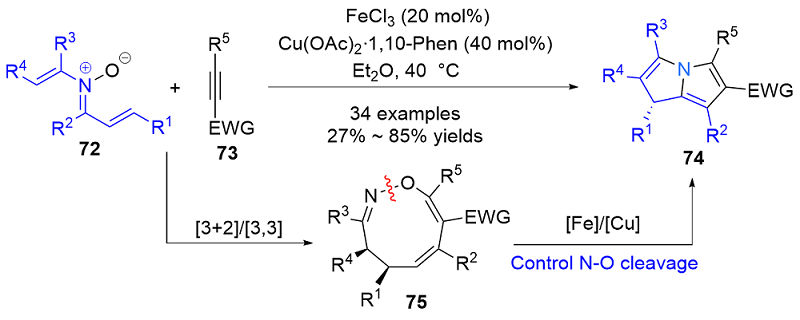
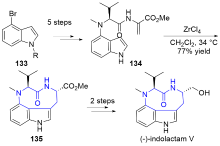
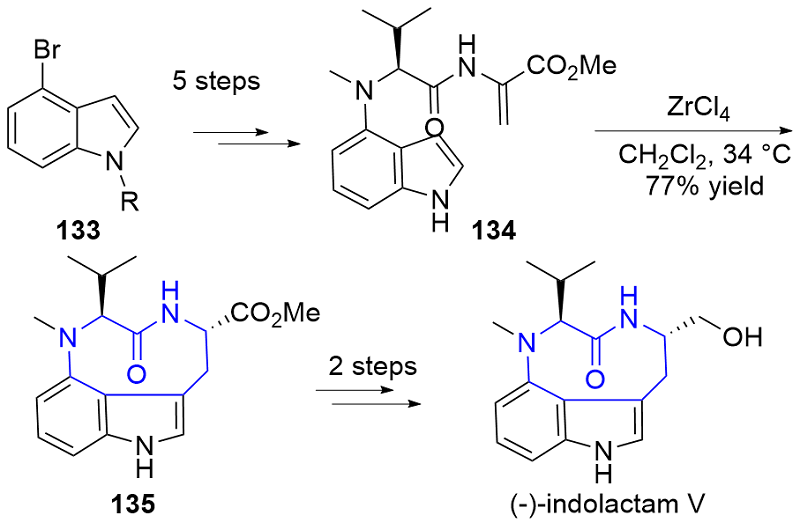
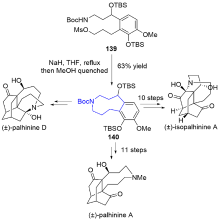
| [1] |
Vitaku, E.; Smith, D. T.; Njardarson, J. T. J. Med. Chem. 2014, 57, 10257.
doi: 10.1021/jm501100b pmid: 25255204 |
| [2] |
(a) Molander, G. A. Acc. Chem. Res. 1998, 31, 603.
doi: 10.1021/ar960101v pmid: 11749312 |
|
(b) Maier, M. E. Angew. Chem., Int. Ed. 2000, 39, 2073.
doi: 10.1002/1521-3773(20000616)39:12【-逻*辑*与-】lt;2073::AID-ANIE2073【-逻*辑*与-】gt;3.0.CO;2-0 pmid: 11749312 |
|
|
(c) Yet, L. Chem. Rev. 2000, 100, 2963.
pmid: 11749312 |
|
|
(d) Hoveyda, A. H.; Zhugralin, A. R. Nature 2007, 450, 243.
doi: 10.1038/nature06351 pmid: 11749312 |
|
|
(e) Hussain, A.; Yousuf, S. K.; Mukherjee, D. RSC Adv. 2014, 4, 43241.
doi: 10.1039/C4RA07434C pmid: 11749312 |
|
|
(f) Li, L.; Li, Z.-L.; Wang, F.-L.; Guo, Z.; Cheng, Y.-F.; Wang, N.; Dong, X.-W.; Fang, C.; Liu, J.; Hou, C.; Tan, B.; Liu, X.-Y Nat. Commun. 2016, 7, 13852.
doi: 10.1038/ncomms13852 pmid: 11749312 |
|
|
(g) Li, L.; Li, Z.-L.; Gu, Q.-S.; Wang, N.; Liu, X.-Y. Sci. Adv. 2017, 3, e1701487.
pmid: 11749312 |
|
| [3] |
(a) Feng, T.; Cai, X.-H.; Li, Y.; Wang, Y.-Y.; Liu, Y.-P.; Xie, M.-J.; Luo, X.-D. Org. Lett. 2009, 11, 4834.
doi: 10.1021/ol9018826 pmid: 22866915 |
|
(b) Beniddir, M. A.; Martin, M.-T.; Dau, M.-E. T. H.; Grellier, P.; Rasoanaivo, P.; Guéritte, F.; Litaudon, M. Org. Lett. 2012, 14, 4162.
doi: 10.1021/ol301832t pmid: 22866915 |
|
|
(c) Nge, C.-E.; Gan, C.-Y.; Low, Y.-Y.; Thomas, N. F.; Kam, T.-S. Org. Lett. 2013, 15, 4774.
doi: 10.1021/ol4021404 pmid: 22866915 |
|
|
(d) Pan, G.; Williams, R. M. J. Org. Chem. 2012, 77, 4801.
doi: 10.1021/jo3006045 pmid: 22866915 |
|
|
(e) Awakawa, T.; Abe, I. Org. Biomol. Chem. 2018, 16, 4746.
doi: 10.1039/C8OB00803E pmid: 22866915 |
|
| [4] |
Ryu, M.-J.; Baek, E.-K.; Kim, S.; Seong, C. N.; Yang, I.; Lim, K.-M.; Nam, S.-J. Biomol. Ther. (Seoul) 2021, 29, 98.
doi: 10.4062/biomolther.2020.064 |
| [5] |
Bennasar, M.-L.; Solé, D.; Zulaica, E.; Alonso, S. Org. Lett. 2011, 13, 2042.
doi: 10.1021/ol200437k pmid: 21391716 |
| [6] |
Lancefield, C. S.; Zhou, L.; Lébl, T.; Slawin, A. M. Z.; Westwood, N. J. Org. Lett. 2012, 14, 6166.
doi: 10.1021/ol302859j |
| [7] |
Pan, G.; Williams, R. M. J. Org. Chem. 2012, 77, 4801.
doi: 10.1021/jo3006045 |
| [8] |
Magné, V.; Lorton, C.; Marinetti, A.; Guinchard, X.; Voituriez, A. Org. Lett. 2017, 19, 4794.
doi: 10.1021/acs.orglett.7b02210 |
| [9] |
(a) Zhao, F.-W.; Sun, Q.-Y.; Yang, F.-M.; Hu, G.-W.; Luo, J.-F.; Tang, G.-H.; Wang, Y.-H.; Long, C.-L. Org. Lett. 2010, 12, 3922.
doi: 10.1021/ol101602n |
|
(b) Liang, Y.-Y.; Lu, S.-C.; Gong, Y.-L.; Xu, S. Molecules 2020, 25, 4211.
doi: 10.3390/molecules25184211 |
|
| [10] |
Tamiya, H.; Goto, K.; Matsuda, F. Org. Lett. 2004, 6, 545.
doi: 10.1021/ol036329h |
|
(b) Majumdar, K. C.; Chattopadhyay, B. Synlett 2008, 979.
|
|
| [11] |
(a) Deiters, A.; Martin, S. F. Chem. Rev. 2004, 104, 2199.
doi: 10.1021/cr0200872 |
|
(b) Bauer, R. A.; Wenderski, T. A.; Tan, D. S. Nat. Chem. Biol. 2013, 9, 21.
doi: 10.1038/NCHEMBIO.1130 |
|
| [12] |
(a) Vo, C.-V. T.; Luescher, M. U.; Bode, J. W. Nat. Chem. 2014, 6, 310.
doi: 10.1038/nchem.1878 pmid: 33479149 |
|
(b) Jiang, Y.; Ding, L.; Zheng, C.; You, S.-L. Science 2021, 371, 380.
doi: 10.1126/science.abd6095 pmid: 33479149 |
|
|
(c) Zhang, Q.-L.; Xiong, Q.; Li, M.-M.; Xiong, W.; Shi, B.; Lan, Y.; Lu, L.-Q.; Xiao, W.-J. Angew. Chem., Int. Ed. 2020, 59, 14096.
doi: 10.1002/anie.202005313 pmid: 33479149 |
|
| [13] |
Li, R.; Xu, X.; Ye, M. Chin. J. Org. Chem. 2020, 40, 3196. (in Chinese)
doi: 10.6023/cjoc202005056 |
|
(李然, 徐学涛, 叶萌春, 有机化学, 2020, 40, 3196.)
doi: 10.6023/cjoc202005056 |
|
| [14] |
Zhang, X.; Lin, L.; Li, J.; Duan, S.; Long, Y.; Li, J. Chin. J. Org. Chem. 2021, 41, 1878. (in Chinese)
|
|
(张馨元, 林礼, 李静, 段世妤, 隆宇航, 李加洪, 有机化学, 2021, 41, 1878.)
doi: 10.6023/cjoc202010026 |
|
| [15] |
Prasad, B.; Sreenivas, B. Y.; Sushma, A.; Yellanki, S.; Medistti, R.; Kulkarni, P.; Pal, M. Org. Biomol. Chem. 2014, 12, 2864.
doi: 10.1039/c4ob00140k |
| [16] |
Li, Z.; Kumar, A.; Vachhani, D. D.; Sharma, S. K.; Parmar, V. S.; Eycken, E. V. V. Eur. J. Org. Chem. 2014, 2084.
|
| [17] |
Kurouchi, H.; Ohwada, T. J. Org. Chem. 2020, 85, 876.
doi: 10.1021/acs.joc.9b02843 pmid: 31800245 |
| [18] |
Yang, S.; An, X.-D.; Qiu, B.; Liu, R.-B.; Xiao, J. Org. Lett. 2021, 23, 9100.
doi: 10.1021/acs.orglett.1c03389 |
| [19] |
Chakraborty, B.; Jana, U. Org. Biomol. Chem. 2021, 19, 10549.
doi: 10.1039/d1ob01258d pmid: 34842881 |
| [20] |
Pacheco, J. C. O.; Opatz, T. J. Org. Chem. 2014, 79, 5182.
doi: 10.1021/jo500749x |
| [21] |
Shen, M.-H.; Xu, K.; Sun, C.-H.; Xu, H.-D. Org. Lett. 2015, 17, 5598.
doi: 10.1021/acs.orglett.5b02798 |
| [22] |
Zhou, B.; Li, L.; Zhu, X.-Q.; Yan, J.-Z.; Guo, Y.-L.; Ye, L.-W. Angew. Chem., Int. Ed. 2017, 56, 4015.
doi: 10.1002/anie.201700596 pmid: 28267264 |
| [23] |
Hall, J. E.; Matlock, J. V.; Ward, J. W.; Gray, K. V.; Clayden, J. Angew. Chem., Int. Ed. 2016, 55, 11153.
doi: 10.1002/anie.201605714 |
| [24] |
Huang, L.; Dai, L.-X.; You, S.-L. J. Am. Chem. Soc. 2016, 138, 5793.
doi: 10.1021/jacs.6b02678 pmid: 27093370 |
| [25] |
Guney, T.; Wenderski, T. A.; Boudreau, M. W.; Tan, D. S. Chem. Eur. J. 2018, 24, 13150.
doi: 10.1002/chem.201802880 |
| [26] |
Xu, Z.; Huang, Z.; Li, Y.; Kuniyil, R.; Zhang, C.; Ackermann, L.; Ruan, Z. Green. Chem. 2020, 22, 1099.
doi: 10.1039/C9GC03901E |
| [27] |
Jia, S.; Tian, Y.; Li, X.; Wang, P.; Lan, Y.; Yan, H. Angew. Chem., Int. Ed. 2022, 61, e202206501.
|
| [28] |
Teng, H.-L.; Yao, L.; Wang, C.-J. J. Am. Chem. Soc. 2014, 136, 4075.
doi: 10.1021/ja500878c |
| [29] |
Liu, H.; Wu, Y.; Zhao, Y.; Li, Z.; Zhang, L.; Yang, W.; Jiang, H.; Jing, C.; Yu, H.; Wang, B.; Xiao, Y.; Guo, H. J. Am. Chem. Soc. 2014, 136, 2625.
doi: 10.1021/ja4122268 |
| [30] |
Li, Q.-H.; Wei, L.; Wang, C.-J. J. Am. Chem. Soc. 2014, 136, 8685.
doi: 10.1021/ja503309u |
| [31] |
He, Z.-L.; Sheong, F. K.; Li, Q.H.; Lin, Z.; Wang, C.-J. Org. Lett. 2015, 17, 1365.
doi: 10.1021/acs.orglett.5b00011 |
| [32] |
Wu, Y.; Liu, H.; Zhang, L.; Sun, Z.; Xiao, Y.; Huang, J.; Wang, M.; Guo, H. RSC Adv. 2016, 6, 73547.
doi: 10.1039/C6RA14018A |
| [33] |
Yang, L.-C.; Rong, Z.-Q.; Wang, Y.-N.; Tan, Z. Y.; Wang, M.; Zhao, Y. Angew. Chem., Int. Ed. 2017, 56, 2927.
doi: 10.1002/anie.201611474 |
| [34] |
Rong, Z.-Q.; Yang, L.-C.; Liu, S.; Yu, Z.; Wang, Y.-N.; Tan, Z. Y.; Huang, R.-Z.; Lan, Y.; Zhao, Y. J. Am. Chem. Soc. 2017, 139, 15304.
doi: 10.1021/jacs.7b09161 |
| [35] |
Wang, Y.-N.; Yang, L.-C.; Rong, Z.-Q.; Liu, T.-L.; Liu, R.; Zhao, Y. Angew. Chem., Int. Ed. 2018, 57, 1596.
doi: 10.1002/anie.201711648 pmid: 29265722 |
| [36] |
Das, P.; Gondo, S.; Nagender, P. Uno, H.; Tokunaga, E.; Shibata, N. Chem. Sci. 2018, 9, 3276.
doi: 10.1039/C7SC05447E |
| [37] |
Uno, H.; Punna, N.; Tokunaga, E.; Shiro, M.; Shibata, N. Angew. Chem., Int. Ed. 2020, 59, 8187.
doi: 10.1002/anie.201915021 |
| [38] |
Uno, H.; Kawai, K.; Shiro, M.; Shibata, N. ACS Catal. 2020, 10, 14117.
doi: 10.1021/acscatal.0c03927 |
| [39] |
Yang, G.; Ke, Y.-M.; Zhao, Y. Angew. Chem., Int. Ed. 2021, 60, 12775.
doi: 10.1002/anie.202102061 |
| [40] |
Liu, Y.; He, Y.; Liu, Y.; Wei, K.; Guo, W. Org. Chem. Front. 2021, 8, 7004.
doi: 10.1039/D1QO01405F |
| [41] |
Lee, K. R.; Ahn, S.; Lee, S.-G. Org. Lett. 2021, 23, 3735.
doi: 10.1021/acs.orglett.1c01135 |
| [42] |
Li, K.; Yang, S.; Zheng, B.; Wang, W.; Wu, Y.; Li, J.; Guo, H. Chem. Commun. 2022, 58, 6646.
doi: 10.1039/D2CC01134D |
| [43] |
Xie, X.; Yuan, D.; Ma, B.; Jin, J.; Wang, E.; Zhou, W.; Hu, Y.; Hu, L.; Wang, J. Adv. Synth. Catal. 2022, 364, 1168.
doi: 10.1002/adsc.202101423 |
| [44] |
Zou, N.; Jiao, J.-W.; Feng, Y.; Chen, C.-H.; Liang, C.; Su, G.-F.; Mo, D.-L. Adv. Synth. Catal. 2017, 359, 3545.
doi: 10.1002/adsc.201700685 |
| [45] |
Ma, X.-P.; Li, L.-G.; Zhao, H.-P.; Du, M.; Liang, C.; Mo, D.-L. Org. Lett. 2018, 20, 4571.
doi: 10.1021/acs.orglett.8b01761 |
| [46] |
Zou, N.; Jiao, J.-W.; Feng, Y.; Pan, C.-X.; Liang, C.; Su, G.-F.; Mo, D.-L. Org. Lett. 2019, 21, 481.
doi: 10.1021/acs.orglett.8b03767 |
| [47] |
Ma, X.-P.; Nong, C.-M.; Zhao, J.; Lu, X.; Liang, C.; Mo, D.-L. Adv. Synth. Catal. 2020, 362, 478.
doi: 10.1002/adsc.201901206 |
| [48] |
Ma, X.-P.; Nong, C.-M.; Liang, Y.-F.; Xu, P.-P.; Guo, X.-Y.; Liang, C.; Pan, C.-X.; Su, G.-F.; Mo, D.-L. Green. Chem. 2020, 22, 3827.
doi: 10.1039/D0GC00929F |
| [49] |
Qin, X.-T.; Zou, N.; Cheng, X.-L.; Liang, C.; Mo, D.-L. Adv. Synth. Catal. 2022, 364, 500.
doi: 10.1002/adsc.202101199 |
| [50] |
Gharpure, S. J.; Nanda, S. K.; Fartade, D. J. Org. Biomol. Chem. 2019, 17, 8806.
doi: 10.1039/c9ob02030f pmid: 31556431 |
| [51] |
Chinthapally, K.; Massaro, N. P.; Ton, S.; Gardner, E. D.; Sharma, I. Tetrahedron Lett. 2019, 60, 151253.
doi: 10.1016/j.tetlet.2019.151253 |
| [52] |
Pospech, J.; Ferraccioli, R.; Neumann, H.; Beller, M. Chem. Asian J. 2015, 10, 2624.
doi: 10.1002/asia.201500493 |
| [53] |
Okuma, K.; Kinoshita, H.; Nagahora, N.; Shioji, K. Eur. J. Org. Chem. 2016, 2264.
|
| [54] |
Torre, A. F.; Rivera, D. G.; Concepción, O.; Echemendia, R.; Correa, A. G.; Paixão, M. W. J. Org. Chem. 2016, 81, 803.
doi: 10.1021/acs.joc.5b02158 |
| [55] |
Yang, W.; Dong, J.; Wang, J.; Xu, X. Org. Lett. 2017, 19, 616.
doi: 10.1021/acs.orglett.6b03777 pmid: 28102687 |
| [56] |
Cao, J.; Yang, F.; Sun, J.; Huang, Y.; Yan, C.-G. J. Org. Chem. 2019, 84, 622.
doi: 10.1021/acs.joc.8b02457 |
| [57] |
Srinivasulu, V.; Schilf, P.; Ibrahim, S.; Shehadi, I. A.; Malik, O. G.; Sieburth, S.; Khanfar, M. A.; Hamad, M.; Abu-Yousef, I. A.; Majdalawieh, A. F.; Al-Tel, T.-H. J. Org. Chem. 2020, 85, 10695.
doi: 10.1021/acs.joc.0c01244 pmid: 32806094 |
| [58] |
(a) Baud, L. G.; Manning, M. A.; Arkless, H. L.; Stephens, T. C.; Unsworth, W. P. Chem.-Eur. J. 2017, 23, 2225.
doi: 10.1002/chem.201605615 |
|
(b) Kitsiou, C.; Hindes, J. J.; Anson, P. I.; Jackson, P.; Wilson, T. C.; Daly, E. K.; Felstead, H. R.; Heanshaw, P.; Unsworth, W. P. Angew. Chem., Int. Ed. 2015, 54, 15794.
doi: 10.1002/anie.201509153 |
|
| [59] |
Wang, N.; Gu, Q.-S.; Li, Z.-L.; Li, Z.; Guo, Y.-L.; Guo, Z.; Liu, X.-Y. Angew. Chem., Int. Ed. 2018, 57, 14225.
doi: 10.1002/anie.201808890 pmid: 30178906 |
| [60] |
Li, W.; Wang, Y.; Qi, H.; Shi, R.; Li, J.; Chen, S.; Xu, X.-M.; Wang, W.-L. Org. Biomol. Chem. 2021, 19, 8086.
doi: 10.1039/D1OB01206A |
| [61] |
Nathel, N. F. F.; Shah, T. K.; Bronner, S. M.; Garg, N. K. Chem. Sci. 2014, 5, 2184.
pmid: 24839542 |
| [62] |
Leger, P. R.; Murphy, R. A.; Pushkarskaya, E.; Sarpong, R. Chem. Eur. J. 2015, 21, 4377.
doi: 10.1002/chem.201406242 |
| [63] |
Haynes-Smith, J.; Diaz, I.; Billingsley, K. L. Org. Lett. 2016, 18, 2008.
doi: 10.1021/acs.orglett.6b00614 pmid: 27074538 |
| [64] |
Magné, V.; Lorton, C.; Marinetti, A.; Guinchard, X.; Voituriez, A. Org. Lett. 2017, 19, 4794.
doi: 10.1021/acs.orglett.7b02210 |
| [65] |
Chen, C.-M.; Shiao, H.-Y.; Uang, B.-J.; Hsieh, H.-P. Angew. Chem., Int. Ed. 2018, 57, 15572.
doi: 10.1002/anie.201809130 |
| [66] |
Shiomi, S.; Wilailak, K.; Soutome, W.; Takayama, H.; Kitajima, M.; Ishikawa, H. J. Org. Chem. 2022, 87, 3730.
doi: 10.1021/acs.joc.1c02672 |
| [1] | 陈祖良, 魏颖静, 张俊良. 供体-受体氮杂环丙烷碳-碳键断裂的环加成反应研究进展[J]. 有机化学, 2023, 43(9): 3078-3088. |
| [2] | 张素珍, 张文文, 杨慧, 顾庆, 游书力. 铑催化2-烯基苯酚与炔烃的对映体选择性螺环化反应[J]. 有机化学, 2023, 43(8): 2926-2933. |
| [3] | 陈玉琢, 孙红梅, 王亮, 胡方芝, 李帅帅. 基于α-氢迁移策略构建杂环骨架的研究进展[J]. 有机化学, 2023, 43(7): 2323-2337. |
| [4] | 孙李星, 孙婷婷, 王海清, 吴淑芳, 王小烨, 刘天雅, 张宇辰. Lewis酸催化下3-烷基-2-吲哚烯与α,β-不饱和N-磺酰基亚胺的[2+4]环化反应[J]. 有机化学, 2023, 43(6): 2178-2188. |
| [5] | 任志军, 罗维纬, 周俊. 银介导的N-芳基丙烯酰胺串联环化反应研究进展[J]. 有机化学, 2023, 43(6): 2026-2039. |
| [6] | 孔德亮, 戴闻, 赵怡玲, 陈艺林, 朱红平. 脒基胺硼基硅宾与单酮和二酮的氧化环加成反应研究[J]. 有机化学, 2023, 43(5): 1843-1851. |
| [7] | 李靖鹏, 黄顺桃, 杨棋, 李伟强, 刘腾, 黄超. 利用连续流动技术合成(Z)-N-乙烯基取代N,O-缩醛[J]. 有机化学, 2023, 43(4): 1550-1558. |
| [8] | 南江, 黄冠杰, 胡岩, 王波. 钌催化喹唑啉酮与碳酸亚乙烯酯的C—H [4+2]环化反应[J]. 有机化学, 2023, 43(4): 1537-1549. |
| [9] | 王海清, 杨爽, 张宇辰, 石枫. 邻羟基苄醇参与的催化不对称反应研究进展[J]. 有机化学, 2023, 43(3): 974-999. |
| [10] | 戴春波, 夏思奇, 陈晓玉, 杨丽敏. 氮杂环卡宾(NHC)催化[4+3]环加成反应构建4-氨基苯并环庚烯内酯[J]. 有机化学, 2023, 43(3): 1084-1090. |
| [11] | 郝二军, 丁笑波, 王珂新, 周红昊, 杨启亮, 石磊. 氮杂环丙烷与不饱和化合物发生[3+2]扩环反应的研究进展[J]. 有机化学, 2023, 43(12): 4057-4074. |
| [12] | 梁俊秀, 刘亚洲, 王阿木, 吴彦超, 马小锋, 李惠静. 基于原位形成的氮杂邻亚甲基苯醌和卤代萘酚的分子间[4+1]螺环化/去芳香化反应[J]. 有机化学, 2023, 43(11): 3888-3899. |
| [13] | 张维露, 陈绍维, 沈晓. 镍催化苯并硅杂环丁烷与酰基硅烷的[4+2]环化反应[J]. 有机化学, 2023, 43(10): 3635-3643. |
| [14] | 南宁, 吴双, 秦景灏, 李金恒. 基于硅烷化启动的环化反应研究进展[J]. 有机化学, 2023, 43(10): 3414-3453. |
| [15] | 桑田, 贾帆, 何静, 李春天, 刘岩, 刘平. I2催化β-酮腈与1H-吡唑-5-胺的环化反应[J]. 有机化学, 2023, 43(1): 195-201. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||