有机化学 ›› 2024, Vol. 44 ›› Issue (5): 1480-1493.DOI: 10.6023/cjoc202310008 上一篇 下一篇
综述与进展
徐光利a,b,c,*( ), 韩鸿萍a,b, 曹露微a, 洪思敏a, 海林悦a, 崔香a
), 韩鸿萍a,b, 曹露微a, 洪思敏a, 海林悦a, 崔香a
收稿日期:2023-10-07
修回日期:2023-12-12
发布日期:2023-12-21
基金资助:
Guangli Xua,b,c( ), Hongping Hana,b, Luwei Caoa, Simin Honga, linyue Haia, Xiang Cuia
), Hongping Hana,b, Luwei Caoa, Simin Honga, linyue Haia, Xiang Cuia
Received:2023-10-07
Revised:2023-12-12
Published:2023-12-21
Contact:
*E-mail: Supported by:文章分享

1,3-二烯基硼化合物在生物活性分子修饰和有机合成中具有重要应用, 可以作为有机硼试剂通过Suzuki反应构建新的有机框架, 也可以发生Diels-Alder环加成反应来制备硼代环烯烃中间体. 目前共轭烯基硼化合物的合成一般是通过过渡金属催化有机金属试剂对炔烃或烯烃的交叉偶联反应、硼酸酯对烯烃的Heck反应、烯炔硼氢化反应或烯炔碳硼化反应实现. 以过渡金属催化的不同反应类型为主线, 分类对1,3-共轭二烯基硼化合物的合成进行了综述, 并对其发展前景予以展望.
徐光利, 韩鸿萍, 曹露微, 洪思敏, 海林悦, 崔香. 过渡金属催化1,3-共轭二烯基硼化合物合成研究进展[J]. 有机化学, 2024, 44(5): 1480-1493.
Guangli Xu, Hongping Han, Luwei Cao, Simin Hong, linyue Hai, Xiang Cui. Research Progress of Transition Metal-Catalyzed Synthesis of 1,3-Conjugated Dienyl Boron Compounds[J]. Chinese Journal of Organic Chemistry, 2024, 44(5): 1480-1493.
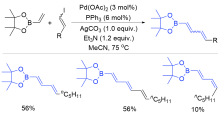
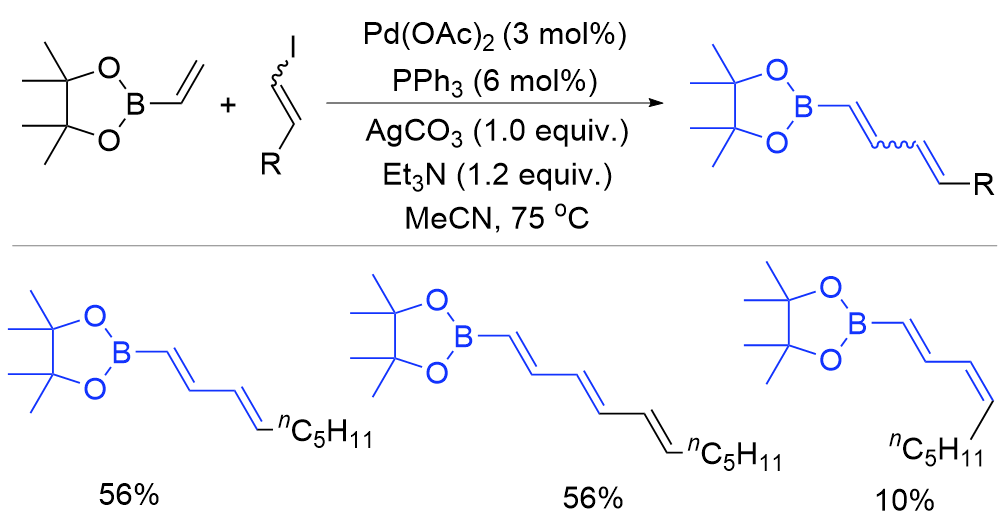
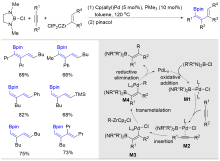
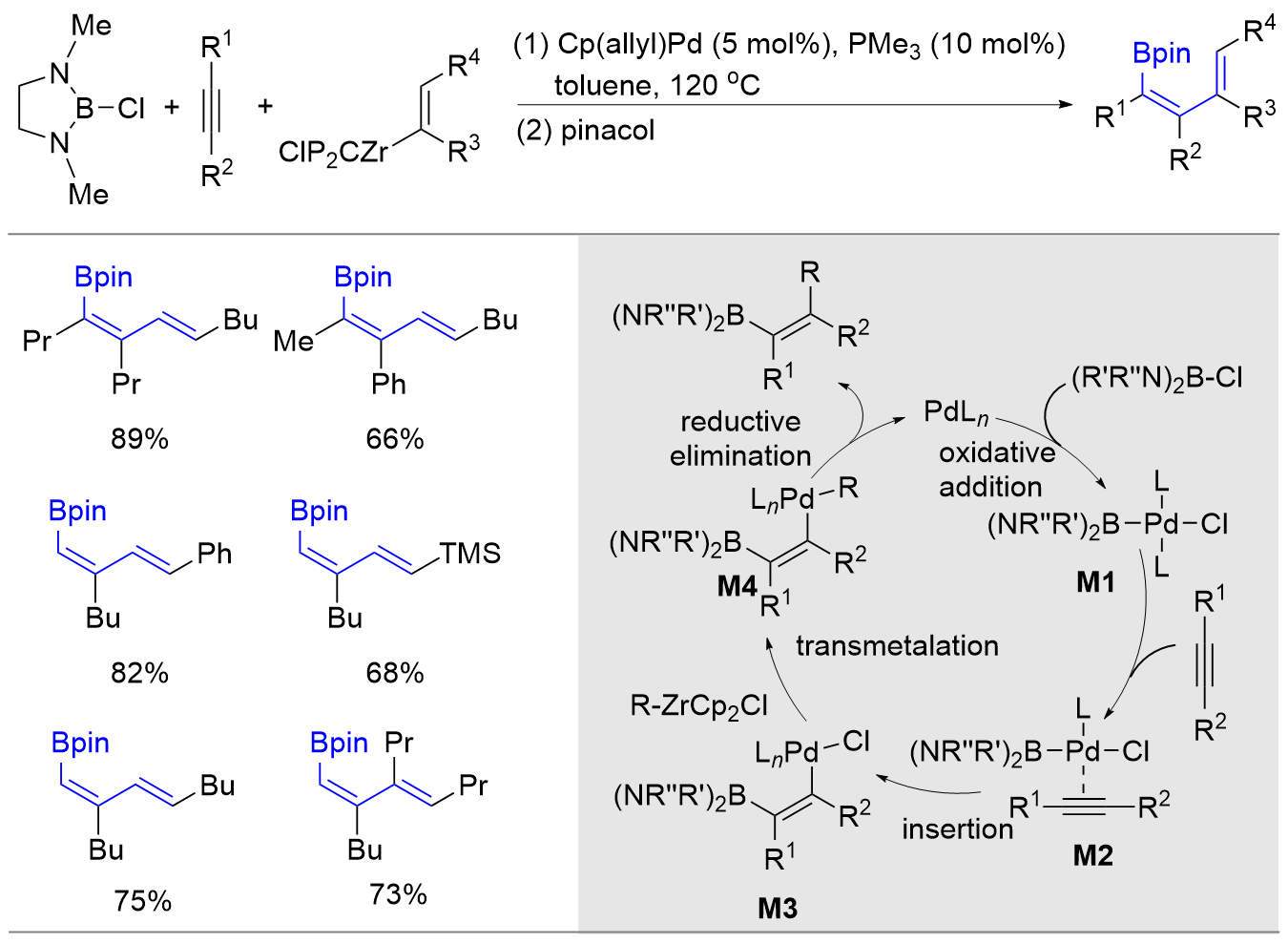
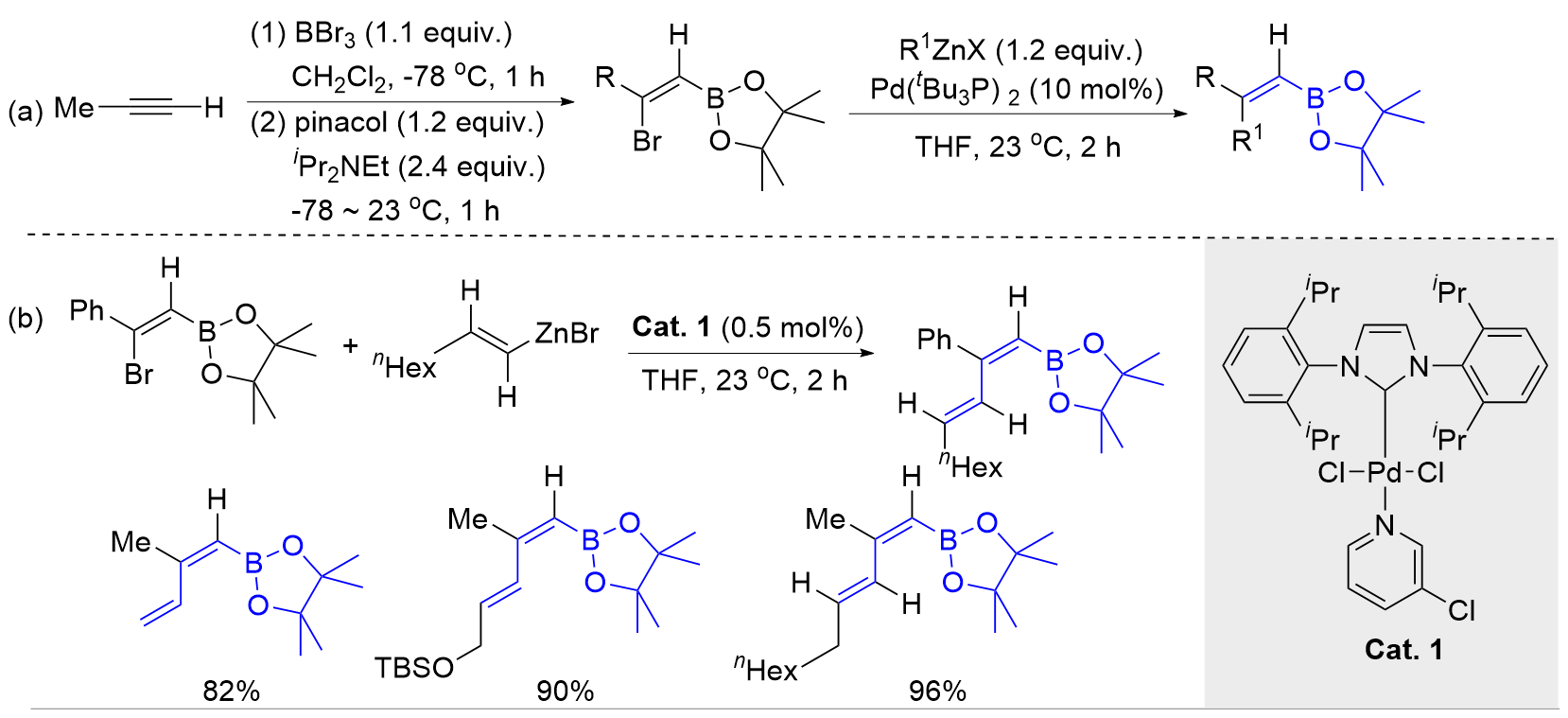
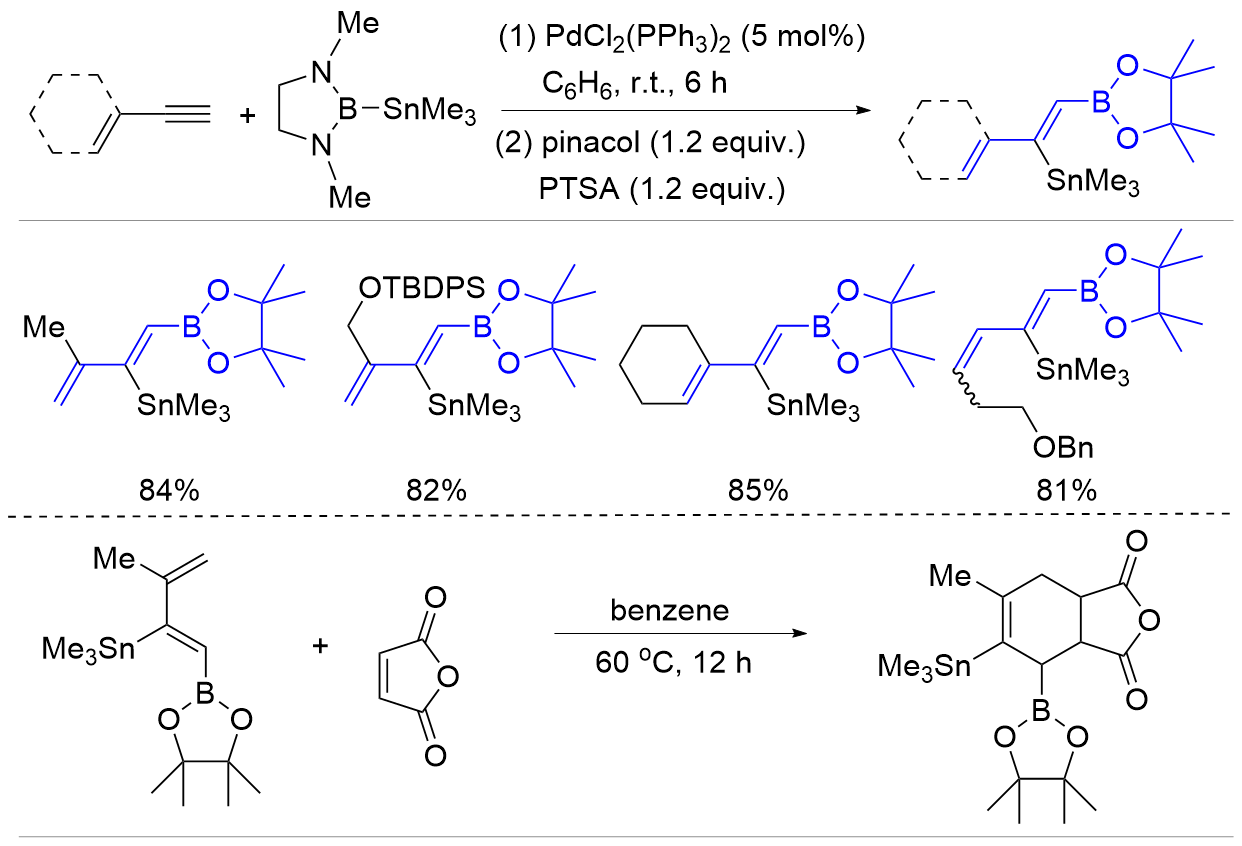
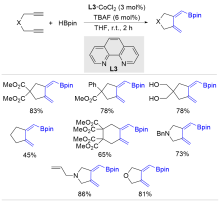
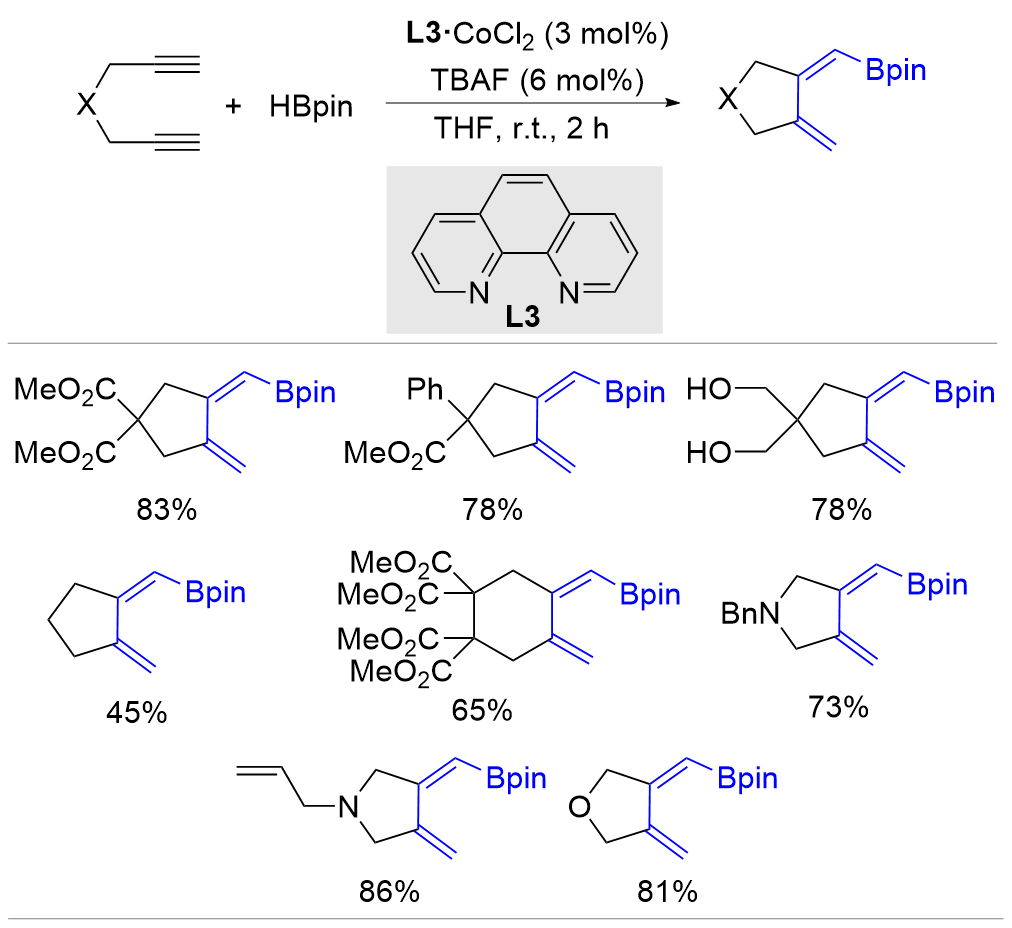
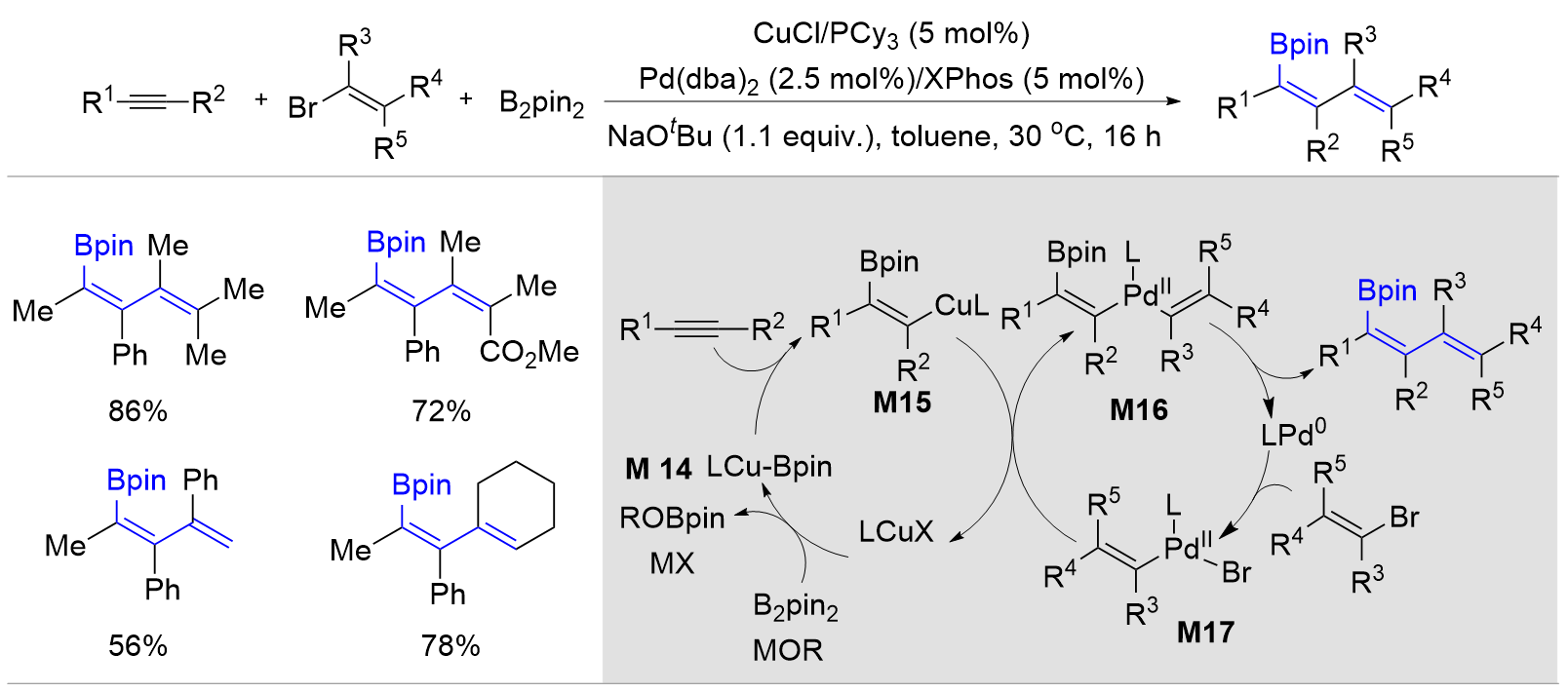
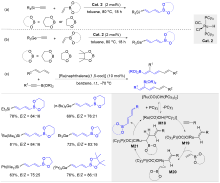
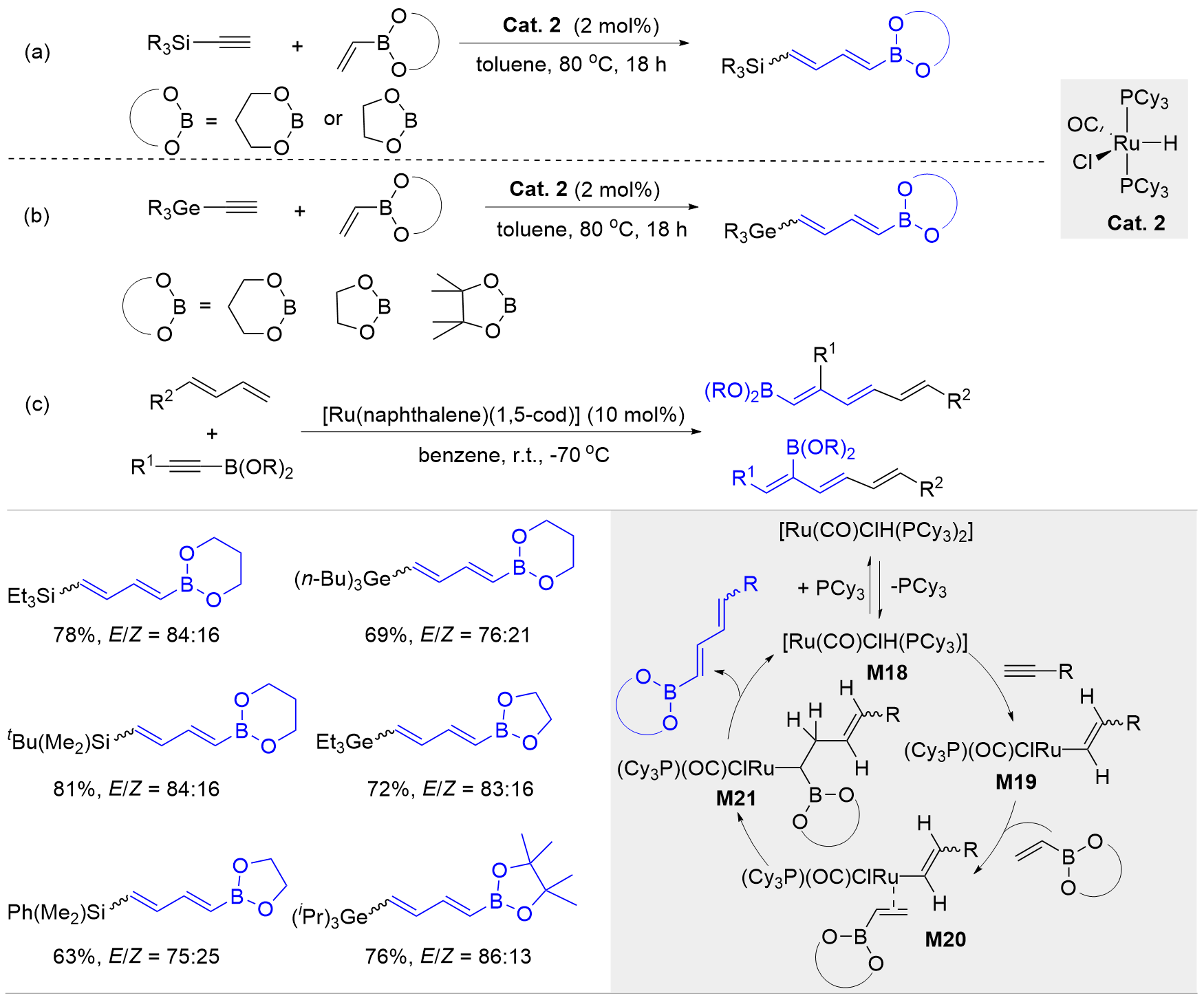
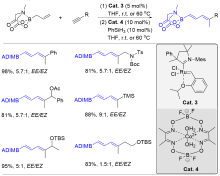
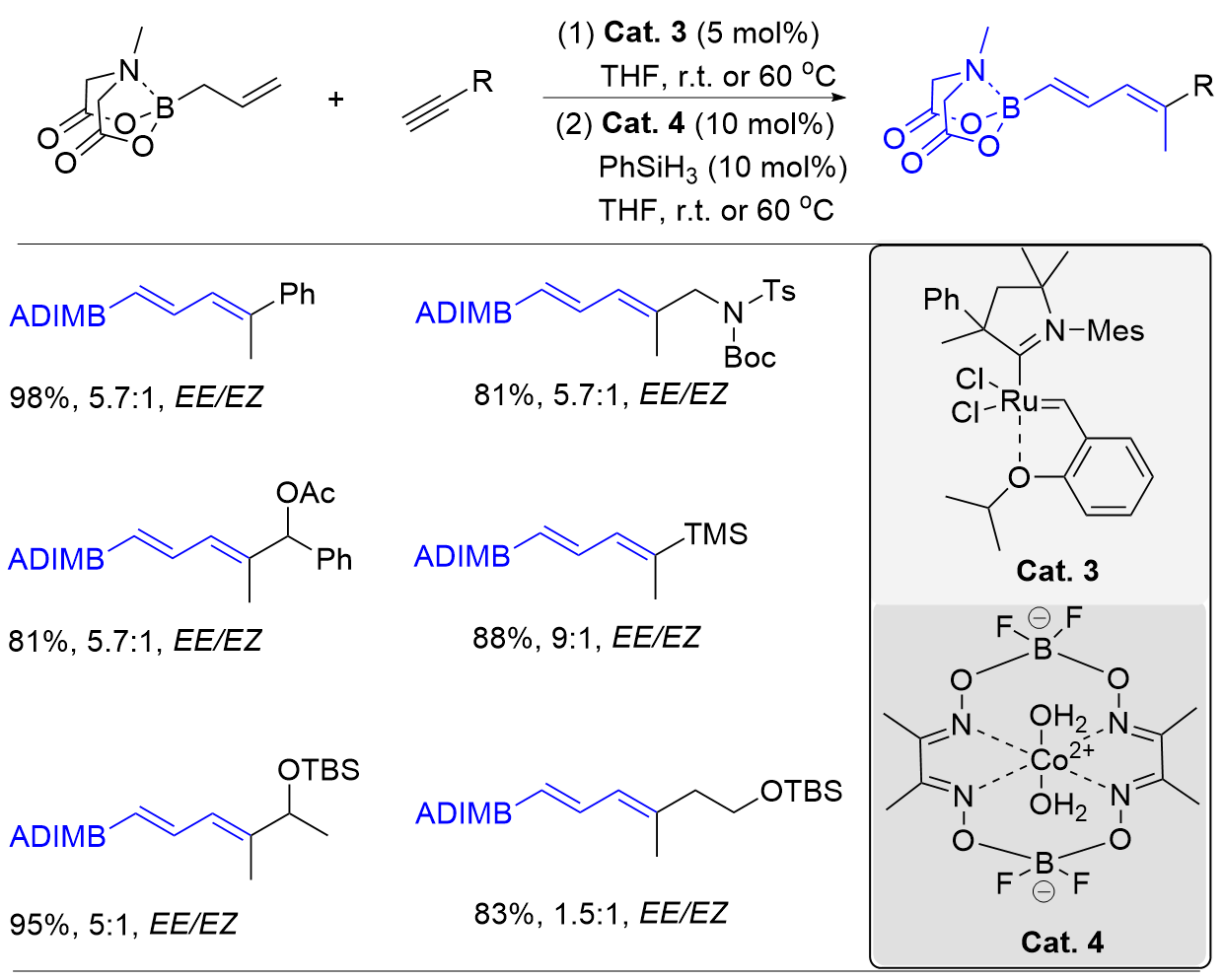
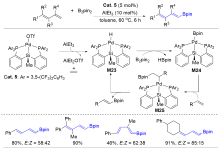
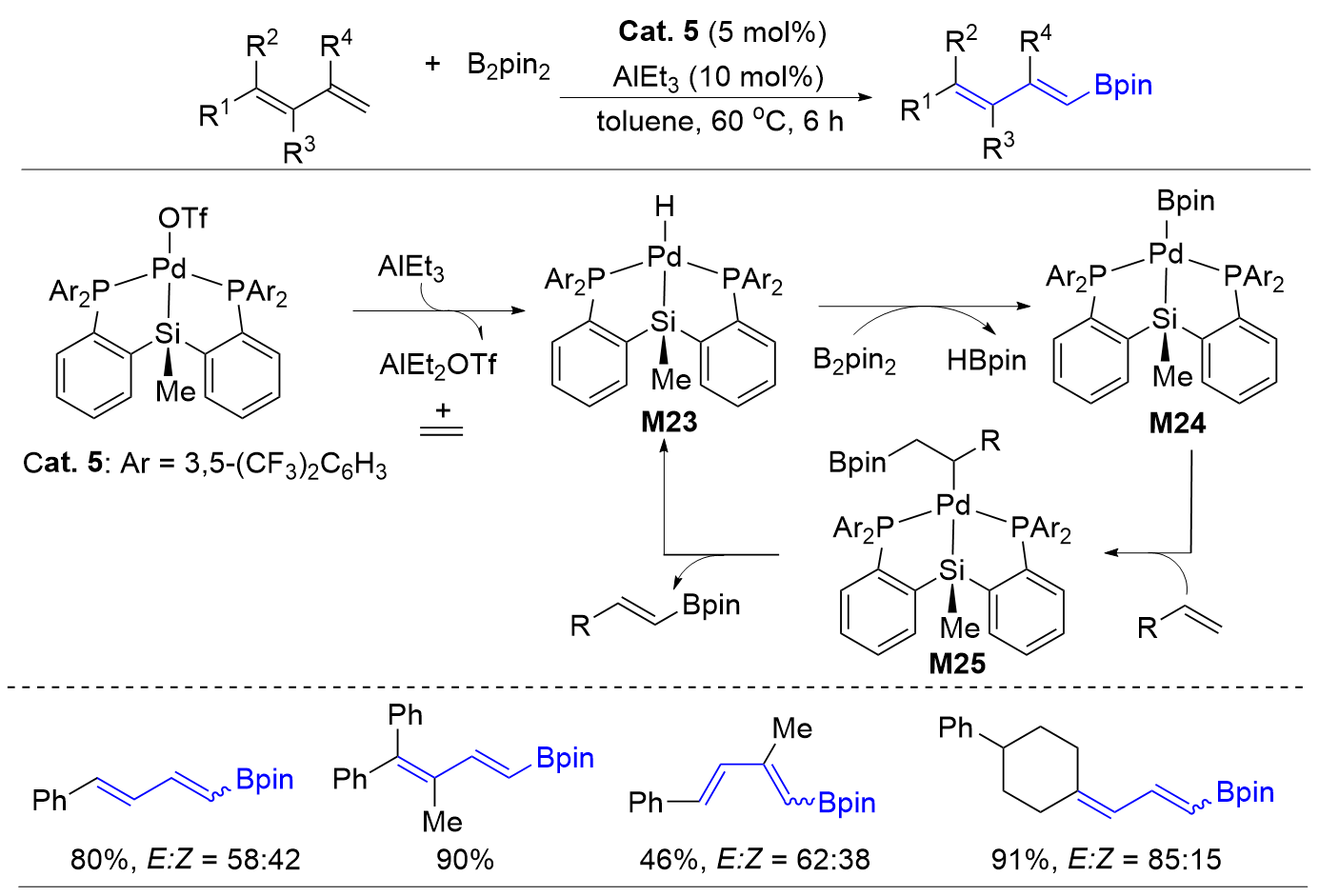


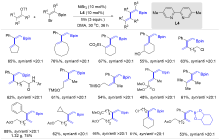
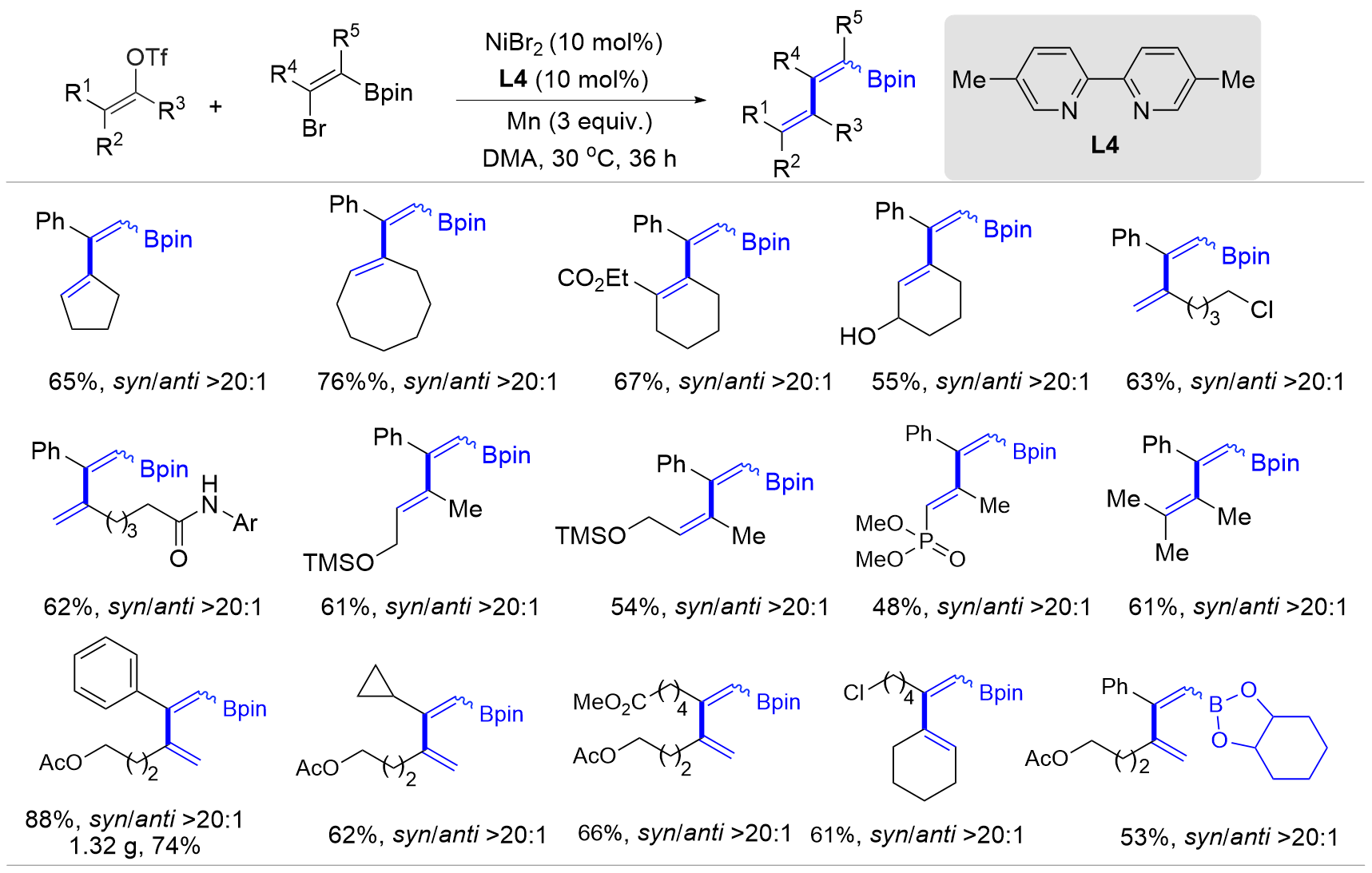
| [1] |
(a) Grigalunas, M.; Ankner, T.; Norrby, P.-O.; Wiest, O.; Helquist, P. Org. Lett. 2014, 16, 3970.
doi: 10.1021/ol5017965 pmid: 25032503 |
|
(b) Huang, E.; Bunel, E.; Faul, M. F. Org. Lett. 2007, 9, 4343.
pmid: 25032503 |
|
| [2] |
(a) Nicholas, C. P. Appl. Catal., A 2017, 543, 82.
|
|
(b) Kotha, S.; Meshram, M. Chem.-Asian J. 2018, 13, 1758.
|
|
| [3] |
(a) Sun, H.; Liang, Y.; Thompson, M. P.; Gianneschi, N. C. Prog. Polym. Sci. 2021, 120, 101427.
|
|
(b) Chen, M.; Yang, B.; Chen, C. Synlett 2016, 27, 1297.
|
|
|
(c) Ishii, S.; Ota, Y.; Matsuoka, S.; Suzuki, M. ACS Appl. Polym. Mater. 2023, 5, 7614.
|
|
| [4] |
Chen, J.-M.; Yu, B.; Wei, Y.-M. Appl. Energy 2018, 224, 160.
|
| [5] |
(a) Müller, K.; Faeh, C.; Diederich, F. Science 2007, 317, 1881.
doi: 10.1126/science.1131943 pmid: 26756377 |
|
(b) Purser, S.; Moore, P. R.; Swallow, S.; Gouverneur, V. Chem. Soc. Rev. 2008, 37, 320.
pmid: 26756377 |
|
|
(c) Gillis, E. P.; Eastman, K. J.; Hill, M. D.; Donnelly, D. J.; Meanwell, N. A. J. Med. Chem. 2015, 58, 8315.
doi: 10.1021/acs.jmedchem.5b00258 pmid: 26756377 |
|
|
(d) Wang, J.; Sánchez-Roselló, M.; Aceña, J. L.; Pozo, C.; rochinsky, A. E.; Fustero, S.; Soloshonok, V. A.; Liu, H. Chem. Rev. 2014, 114, 2432.
pmid: 26756377 |
|
|
(e) Zhou, Y.; Wang, J.; Gu, Z.; Wang, S.; Zhu, W.; Aceña, J. L.; loshonok, V. A.; Izawa, K.; Liu, H. Chem. Rev. 2016, 116, 422.
doi: 10.1021/acs.chemrev.5b00392 pmid: 26756377 |
|
|
(f) Hu, J.; Yang, Y.; Lou, Z.; Ni, C.; Hu, J. Chin. J. Chem. 2018, 36, 1202.
pmid: 26756377 |
|
| [6] |
(a) Hedhli, A.; Baklouti, A. Tetrahedron Lett. 1995, 36, 4433.
pmid: 8399151 |
|
(b) Sporn, M. B.; Dunlop, N. M.; Newton, D. L.; Henderson, W. R. Nature 1976, 263, 110.
pmid: 8399151 |
|
|
(c) Zhu, Y.; Liu, R. S. H. Biochemistry 1993, 32, 10233.
pmid: 8399151 |
|
|
(d) Chopra, D. P.; Wilkoff, W. J. Eur. J. Cancer 1979, 15, 1417.
pmid: 8399151 |
|
|
(e) Srisethnil, S. J. Med. Chem. 1979, 22, 1059.
pmid: 8399151 |
|
| [7] |
(a) Ohmura, T.; Masuda, K.; Takase, I.; Suginome, M. J. Am. Chem. Soc. 2009, 131, 16624.
|
|
(b) Abbas, S. Y.; Zhao, P.; Overman, L. E. Org. Lett. 2018, 20, 868.
|
|
| [8] |
(a) Pyziak, J.; Walkowiak, J.; Marciniec, B. Chem.-Eur. J. 2017, 23, 3502.
|
|
(b) Sardini, S. R.; Lambright, A. L.; Trammel, G. L.; Omer, H. M.; Liu, P.; Brown, M. K. J. Am. Chem. Soc. 2019, 141, 9391.
|
|
|
(c) Yang, C.; Gao, Y.; Bai, S.; Jiang, C.; Qi, X. J. Am. Chem. Soc. 2020, 142, 11506.
|
|
| [9] |
(a) Stikute, A.; Turks, M. Tetrahedron Lett. 2017, 58, 2727.
pmid: 32427489 |
|
(b) Mario Altendorfera M; Menche, D. Chem. Commun. 2012, 48, 8267.
pmid: 32427489 |
|
|
(c) Gan, Y.; Hu, H.; Liu, Y.-H. Org. Lett. 2020, 22, 4418.
doi: 10.1021/acs.orglett.0c01424 pmid: 32427489 |
|
| [10] |
(a) Reid, W. B.; Spillane, J. J.; Krause, S. B.; Watson, D. A. J. Am. Chem. Soc. 2016, 138, 17, 5539.
pmid: 28161943 |
|
(b) Lovinger, G. J.; Aparece, M. D.; Morken, J. P. J. Am. Chem. Soc. 2017, 139, 3153.
doi: 10.1021/jacs.6b12663 pmid: 28161943 |
|
| [11] |
Altendorfera, M.; Menche, D. Chem. Commun. 2012, 48, 8267.
|
| [12] |
(a) Jiang, B.; Liang, Q. J.; Han, Y. Org. Lett. 2018, 20, 3215.
doi: 10.1021/acs.orglett.8b01067 pmid: 26382149 |
|
(b) Kischkewitz, M.; Gerleve, C.; Studer, A. Org. Lett. 2018, 20, 3666.
doi: 10.1021/acs.orglett.8b01459 pmid: 26382149 |
|
|
(c) Tripathi, C. B.; Mukherjee, S. Org. Lett. 2015, 17, 4424.
doi: 10.1021/acs.orglett.5b02026 pmid: 26382149 |
|
|
(d) Dada, R.; Wei, Z.; Gui, R. Angew. Chem., Int. Ed. 2018, 57, 3981.
pmid: 26382149 |
|
| [13] |
(a) Yang, X. H.; Dong, V. M. J. Am. Chem. Soc. 2017, 139, 1774.
|
|
(b) Marcum, J. S.; Roberts, C. C.; Manan, R. S. J. Am. Chem. Soc. 2017, 139, 15580.
|
|
|
(c) Roberts, C. C.; Matías, D. M.; Goldfogel, M. J. J. Am. Chem. Soc. 2015, 137, 6488.
|
|
| [14] |
(a) Guillam, A.; Toupet, L.; Maddaluno, J. J. Org. Chem. 1998, 63, 5110.
pmid: 20863073 |
|
(b) Gulías, M.; Durán, J.; López, F. J. Am. Chem. Soc. 2007, 129, 11026.
pmid: 20863073 |
|
|
(c) Fujiwara, K.; Kurahashi, T.; Matsubara, S. Org. Lett. 2010, 12, 4548.
doi: 10.1021/ol101842y pmid: 20863073 |
|
|
(d) Liu, L.; Kim, H.; Xie, Y. J. Am. Chem. Soc. 2017, 139, 13656.
pmid: 20863073 |
|
| [15] |
(a) Barluenga, J.; Tomás, G. M.; Aznar, F. Adv. Synth. Catal. 2010, 352, 3235.
pmid: 29110364 |
|
(b) Zhang, X. M.; Yang, J.; Zhuang, Q. B. ACS Catal. 2018, 8, 6094.
pmid: 29110364 |
|
|
(c) Kreyenschmidt, F.; Koszinowsk, K. Chem.-Eur. J. 2018, 24, 1168.
doi: 10.1002/chem.201704547 pmid: 29110364 |
|
| [16] |
(a) Lopez, S. J. A.; Lamberti, M.; Pappalardo, D. Macromol 2003, 36, 9260.
pmid: 23202137 |
|
(b) Milione, S.; Cuomo, C.; Capacchione, C. Macromol 2007, 40, 5638.
pmid: 23202137 |
|
|
(c) Luo, K.; Kim, S. J.; Cartwright, A. N. Macromol 2011, 44, 4665.
pmid: 23202137 |
|
|
(d) Bonnet, F.; Jones, C. E.; Semlali, C. Dalton Trans. 2013, 42, 790.
doi: 10.1039/c2dt31624b pmid: 23202137 |
|
|
(e) Kostjuk, S. V. RSC Adv. 2015, 5, 13125.
pmid: 23202137 |
|
| [17] |
Eberlin, L.; Tripoteau, F.; Carreaux, F.; Whiting, A.; Carboni, B. J. Org. Chem. 2014, 10, 237.
|
| [18] |
Wang, C.; Tobrman, T.; Xu, Z.; Negishi, E. Org. Lett. 2009, 18, 4092.
|
| [19] |
Vargo, T. R.; Hale, J. S.; Nelson, S. G. Angew. Chem., Int. Ed. 2010, 49, 8678.
|
| [20] |
(a) Wang, Y.; Wu, Y.; Li, Y.; Tang, Y. Chem. Sci. 2017, 8, 3852.
|
|
(b) Sakakibara, R.; Itoh, K.; Fujii, H. J. Org. Chem. 2019, 84, 18, 11474.
|
|
| [21] |
(a) Manolikakes, G.; Knochel, P. Angew. Chem., Int. Ed., 2008, 48, 205.
|
|
(b) Arthurs, R. A.; Hughes, D. L.; Richards, C. J. Eur. J. Inorg. Chem. 2022, 2022, e202101077.
|
|
| [22] |
(a) Liu, Z.; Luan, N.; Shen, L.; Li, J.; Zou, D.; Wu, Y.; Wu, Y. J. Org. Chem. 2019, 84, 12358.
|
|
(b) Goebel, J. F.; Zeng, Z.; Handelmann, J.; Hermann, A.; Rodstein, I.; Gensch, T.; Gessner, V. H.; Löffler, L. Angew. Chem., Int. Ed. 2023, 62, e202216160
|
|
| [23] |
(a) Chishiro, A.; Konishi, M.; Inaba, R.; Yumura, T.; Imoto, H.; Naka, K. Dalton Trans. 2022, 51, 95.
|
|
(b) Chang, Y.-T.; Liu, L.-J.; Peng, W.-S.; Lin, L.-T.; Chan, Y.-T.; Tsai, F.-Y. J. Chin. Chem. Soc. 2021, 68, 469.
|
|
| [24] |
(a) Wang, X.; Sun, H.; Liu, J.; Zhong, W.; Zhang, M.; Zhou, H.; Dai, D.; Lu, X. Org. Lett. 2019, 21, 719.
|
|
(b) Markham, T. E.; Duggan, P. J.; Johnston, M. R. Tetrahedron 2023, 130, 133160
|
|
| [25] |
Stewart, S. K.; Whiting, A. Tetrahedron Lett. 1995, 36, 3925.
|
| [26] |
Coleman, R. S.; Walczak, M. C. Org. Lett. 2005, 7, 2289.
pmid: 15901191 |
| [27] |
(a) Maikhuri, V. K.; Maity, J.; Srivastavac, S.; Prasad, A. K. Org. Biomol. Chem. 2022, 20, 9522.
doi: 10.1039/d2ob01646j pmid: 36412483 |
|
(b) Dang, H. T.; Nguyen, V. D.; Pham, H. H.; Arman, H. D.; Larionov, O. V. Tetrahedron 2019, 75, 3258
pmid: 36412483 |
|
| [28] |
Daini, M.; Suginome, M. Chem. Commun. 2008, 5224.
|
| [29] |
Wang, C.; Tobrman, T.; Xu, Z.; Negishi, E. Org. Lett. 2009, 11, 4092.
|
| [30] |
Negishi, E.; Tobrman, T.; Rao, H.; Xu, S.; Lee, C.-T. Isr. J. Chem. 2010, 50, 696.
|
| [31] |
Wang, C.; Xu, Z.; Tobrman, T.; Negishi, E. Adv. Synth. Catal. 2010, 352, 627.
|
| [32] |
Singidi, R. R.; RajanBabu, T. V. Org. Lett. 2010, 12, 2622.
|
| [33] |
Xu, S.; Zhang, Y.; Li, B.; Liu, S.-Y. J. Am. Chem. Soc. 2016, 138, 14566.
|
| [34] |
Wang, Z.; Wu, J.; Lamine, W.; Li, B., Sotiropoulos, J.-M.; Chrostowska, A.; Miqueu, K.; Liu, S.-Y. Angew. Chem., Int. Ed. 2021, 60, 21231.
|
| [35] |
Wang, Z.; Lamine, W. M.; Liu, S.-Y. Chem. Sci. 2023, 14, 2082.
|
| [36] |
Sasaki, Y.; Horita, Y.; Zhong, C.; Sawamura, M.; Ito, H. Angew. Chem., Int. Ed. 2011, 50, 2778.
|
| [37] |
Xu, H.-D.; Wu, H.; Jiang, C.; Chen, P.; Shen, M.-H. Tetrahedron Lett. 2016, 57, 2915.
|
| [38] |
Tai, C.-C.; Yu, M.-S.; Chen, Y.-L.; Chuang, W.-H.; Lin, T.-H. Yap, G. P. A.; Ong, T.-G. Chem. Commun. 2014, 50, 4344.
|
| [39] |
Mohan, B.; Park, K. H. Appl. Catal.,A 2016, 519, 78.
|
| [40] |
Moncomble, A.; Floch, P. L.; Lledos, A.; Gosmini, C. J. Org. Chem. 2012, 77, 5056.
doi: 10.1021/jo3005149 pmid: 22591028 |
| [41] |
Bassler, D. P.; Alwali, A.; Spence, L.; Beale, O.; Beng, T. K. J. Organomet. Chem. 2015, 780, 6.
|
| [42] |
Huang, Q.; Hu, M.-Y.; Zhu, S.-F. Org. Lett. 2019, 21, 7883.
|
| [43] |
Alfaro, R.; Parra, A.; Aleman, J.; Ruano, J. L. G.; Tortosa, M. J. Am. Chem. Soc. 2012, 134, 15165.
|
| [44] |
Rivera-Chao, E.; Mastral, M. Angew. Chem., Int. Ed. 2018, 57, 9945.
doi: 10.1002/anie.201806334 pmid: 29905396 |
| [45] |
Galiñanes, V.-N.; Mastral, M. F. ChemCatChem 2018, 10, 4817.
|
| [46] |
Xu, W.-Y.; Li, Y.-J.; Gong, T.-J.; Fu, Y. Org. Lett. 2022, 24, 5884.
|
| [47] |
Walkowiak, J.; Jankowska-Wajda, M.; Marciniec, B. Chem.- Eur. J. 2008, 14, 6679.
|
| [48] |
Pyziak, J.; Walkowiak, J.; Hoffmann, M.; Marciniec, B. J. Organomet. Chem. 2015, 794, 96e103
|
| [49] |
Hirano, M.; Kuramochi, A.; Shimada, K.; Komine, N.; Kiyota, S.; Westcott, S. A. Chem. Commun. 2019, 55, 10527.
|
| [50] |
Rohde, L. N.; Diver, S. T. J. Org. Chem. 2022, 87, 14078.
|
| [51] |
Kirai, N.; Iguchi, S.; Ito, T.; Takaya, J.; Iwasawa, N. Bull. Chem. Soc. Jpn. 2013, 86, 784.
|
| [52] |
Funk, T. W.; Efskind, J.; Grubbs, R. H. Org. Lett. 2005, 7, 187.
|
| [53] |
Zhang, L.; Yan, J.; Ahmadli, D.; Wang, Z.; Ritter, T. J. Am. Chem. Soc. 2023, 145, 20182.
doi: 10.1021/jacs.3c07119 pmid: 37695320 |
| [54] |
Jia, J.; Yuan, F.; Zhang, Z.; Song, X.; Hu, F.; Xia, Y. Org. Lett. 2022, 24, 1985.
|
| [55] |
Gerdin, M.; Moberg, C. Org. Lett. 2006, 8, 2929.
|
| [56] |
Pang, X.; Shu, X.-Z. Chin. J. Chem. 2023, 41, 1637
|
| [57] |
Xu, G.-L.; Liu, C.-Y.; Pang, X.; Liu, X.-Y.; Shu, X.-Z. CCS Chem. 2022, 4, 864.
|
| [1] | 晏宇轩, 陆晚晴, 钱慧俊, 吕雷阳, 李志平. 钯催化偕二氟环丙烷开环与1,3-二羰基化合物的单/双氟烯丙基化反应[J]. 有机化学, 2024, 44(5): 1630-1640. |
| [2] | 罗东红, 李平, 陈志才, 杨佳怡, 孙梦凡, 陆居有. 钯催化邻-碳硼烷基吡啶卤化物交叉偶联合成邻-碳硼烷基联芳、氨基吡啶和炔基吡啶衍生物[J]. 有机化学, 2024, 44(5): 1568-1575. |
| [3] | 刘晨光. 含氮芳香性杂环化合物的不对称氢化反应研究进展[J]. 有机化学, 2024, 44(5): 1403-1422. |
| [4] | 崔永伟, 梁春苗, 祝海涛, 申成平, 任飞扬, 孙梦涵, 赵媛, 王文静, 王冬梅, 周妮妮. 银催化环状Morita-Baylis-Hillman醇及其类似物与芳基乙烯的顺式[5+2]环加成反应研究[J]. 有机化学, 2024, 44(5): 1535-1548. |
| [5] | 曹香雪, 贾雅会, 殷世纪, 徐亮, 韦玉, 宋欢欢. 可见光诱导二氢喹唑啉酮碳碳键断裂与三氟甲基取代烯烃的脱氟烷基化反应研究[J]. 有机化学, 2024, 44(5): 1549-1557. |
| [6] | 密思怡, 马隆龙, 刘建国. 连续流选择性加氢技术研究进展[J]. 有机化学, 2024, 44(5): 1445-1457. |
| [7] | 姜晓琳, 王超洋, 武利园, 李跃辉. 含咔唑结构的小分子及聚合物催化二氧化碳转化研究进展[J]. 有机化学, 2024, 44(5): 1423-1444. |
| [8] | 沈都益, 李玲慧, 靳鸽, 梁雨佳, 张欣慧, 公培伟, 张范军, 晁绵冉. 基于单电子转移的黄素仿生光催化氧化研究进展[J]. 有机化学, 2024, 44(4): 1069-1093. |
| [9] | 鞠国栋, 周冠宇, 赵应声. 三异丙基硅烷(TIPS)保护苯酚的无过渡金属催化区域选择性硫氰化反应[J]. 有机化学, 2024, 44(4): 1327-1336. |
| [10] | 彭天凤, 赵玉祥, 浦绍健, 罗娟, 刘腾, 缪应纯, 沈先福. 过渡金属催化的关键反应在异戊烯基吲哚生物碱全合成中的研究进展[J]. 有机化学, 2024, 44(4): 1160-1180. |
| [11] | 刘君君, 卢涛涛, 马平, 赵庆阳, 邝福儿. 钯催化的碳(sp3)-硅键转化实现碳(sp3)-碳(sp2)偶联制备三氟丙基(杂)芳烃[J]. 有机化学, 2024, 44(4): 1319-1326. |
| [12] | 万云辉, 杨福美, 陈明瀚, 孙德立, 叶丹锋. 无过渡金属催化的N-苄基-N-叔丁氧羰基酰胺与不饱和醇的酯化反应[J]. 有机化学, 2024, 44(4): 1293-1300. |
| [13] | 麦尔哈巴•居来提, 布鲁努尔•玉散, 阿不都热合曼•乌斯曼. 无催化剂和无添加剂条件下直接合成N-磺酰基胍类化合物[J]. 有机化学, 2024, 44(4): 1276-1283. |
| [14] | 叶浩, 张海滨, 吴亚男, 吴新星. 氮杂吲哚啉及其衍生物的合成研究进展[J]. 有机化学, 2024, 44(4): 1106-1123. |
| [15] | 李晨龙, 余志祥. 一氧化碳参与的过渡金属催化的插羰环加成反应研究进展[J]. 有机化学, 2024, 44(4): 1045-1068. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||