有机化学 ›› 2021, Vol. 41 ›› Issue (1): 65-70.DOI: 10.6023/cjoc202006013 上一篇 下一篇
综述与进展
收稿日期:2020-06-09
修回日期:2020-07-09
发布日期:2020-08-11
通讯作者:
张怀远, Thomas Wirth
作者简介:基金资助:
Huaiyuan Zhanga,b,*( ), Thomas Wirthb,*(
), Thomas Wirthb,*( )
)
Received:2020-06-09
Revised:2020-07-09
Published:2020-08-11
Contact:
Huaiyuan Zhang, Thomas Wirth
Supported by:文章分享
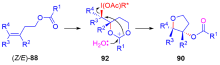
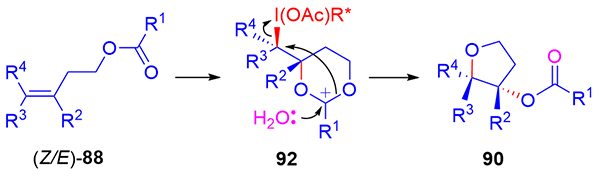
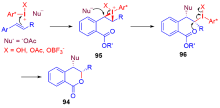
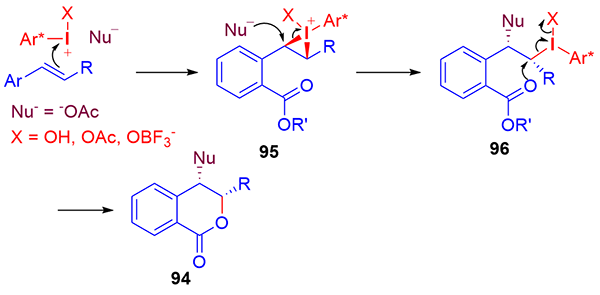
手性高价碘试剂诱导的烯烃官能团化是获得对映体富集的手性分子和具有生物活性天然产物的基本方法, 是不对称合成中一个崭新且富有成效的领域之一. 纵观20年来该领域的发展, 在手性高价碘诱导下, 一方面通过分子间的官能团化实现了双键的双磺酰氧基化、双乙酰氧基化、双卤化、双胺化、羟基化-磺酰氧基化、卤化-烷基化及羰基化等, 对映选择性地合成了各种官能团化的产物; 另一方面通过分子内的氧化内酯化、醚化、酰胺化、芳基化等反应, 对映选择性地合成了 γ-丁内酯、色满环、异色满环、噁唑烷酮、哌啶、吡咯烷、氮杂环丙烷等各种环状化合物, 为手性杂环化合物的合成提供了有效途径. 此外, 由于手性高价碘高效诱导烯烃发生各种官能团化, 提供了优秀的产率和对映选择性, 因此, 该方法学已被用于天然产物的全合成中. 就近二十年来手性高价碘试剂诱导的烯烃官能团化及其在天然产物全合成中的应用进行综述.
张怀远, Thomas Wirth. 手性高价碘试剂诱导的烯烃不对称官能团化反应研究进展[J]. 有机化学, 2021, 41(1): 65-70.
Huaiyuan Zhang, Thomas Wirth. Recent Advances in Asymmetric Functionalization of Olefins Induced by Chiral Hypervalent Iodine Reagents[J]. Chinese Journal of Organic Chemistry, 2021, 41(1): 65-70.






| [1] |
Noyori R. Asymmetric Catalysis in Organic Synthesis, John Wiley & Sons, Chichester, 1994.
|
|
Ojima I. Catalytic Asymmetric Synthesis, Wiley-VCH, Weinheim, 2000.
|
|
|
Beller M.; Bolm C. Transition Metals for Organic Synthesis, Vol. 1, Wiley-VCH, Weinheim, 2004.
|
|
|
(d) Lin G.-Q.; Sun X.-W.; Chen Y.-Q.; Li Y.-M.; Chan A.S.C. Chiral Synthesis :A Symmetric Reaction and its Application, Science Press, Beijing, 2013.
|
|
|
( 林国强, 孙兴文, 陈耀全, 李月明, 陈新滋, 手性合成: 不对称反应及其应用, 科学出版社, 北京, 2013. ).
|
|
|
(e) Carney J.R.; Dillon B.R.; Thomas S.P. Eur. J. Org. Chem. 2016, 3912.
|
|
|
(f) Romero N.A.; Nicewicz D.A. Chem. Rev. 2016, 116, 10075.
|
|
|
(g) Vekariya R.L. J. Mol. Liq. 2017, 227, 44.
|
|
|
(h) Srivastava V.; Singh P.P. RSC Adv. 2017, 7, 31377.
|
|
|
(i) Patel N.; Sood R.; Bharatam P.V. Chem. Rev. 2018, 118, 8770.
|
|
|
(j) Trowbridge A.; Walton S.M.; Gaun M.J. Chem. Rev. 2020, 120, 2613.
|
|
|
(k) Sheldon R.A.; Brady D.; Bode M.L. Chem. Sci. 2020, 11, 2587.
|
|
| [2] |
Jacobsen E.N.; Pfaltz A.; Yamamoto H. Comprehensive Asymmetric Catalysis, Springer, Berlin, 2000.
|
|
(b) Blaser H.-U.; Federsel H.-J. Asymmetric Catalysis on Industrial Scale: Challenges, Approaches and Solutions, Wiley-VCH, Weinheim, 2004.
|
|
|
(c) Krautwald S.; Carreira E.M. J. Am. Chem. Soc. 2017, 139, 5627.
|
|
|
(d) Bhattacharjee S.; Khan M.I.; Li X.; Zhu Q.-L.; Wu X.-T. Catalysts 2018, 8, 120.
|
|
|
(e) Lin Q.; Li L.; Luo S. Chem. -Eur. J. 2019, 25, 10033.
|
|
|
(f) Shaw S.; White J.D. Chem. Rev. 2019, 119, 9381.
|
|
|
(g) Wrzeszcz Z.; Siedlecka R. Molecules 2020, 25, 330.
|
|
| [3] |
Berkessel A.; Göger H. Asymmetric Organocatalysis :from Biomimetic Concepts to Applications in Asymmetric Synthesis, Wiley-VCH, Weinheim, 2005.
|
|
(b) Dalko P.I. Enantioselective Organocatalysis :Reactions and Experimental Procedures, Wiley-VCH, Weinheim, 2007.
|
|
|
(c) Erkkilä A.; Majander I.; Pihko P.M. Chem. Rev. 2007, 107, 5416.
|
|
|
(d) MacMillan D.W.C. Nature 2008, 455, 304.
|
|
|
(e) Barbas C.F. Angew. Chem., Int. Ed. 2008, 47, 42.
|
|
|
(f) Melchiorre P.; Marigo M.; Carlone A.; Bartoli G. Angew. Chem., Int. Ed. 2008, 47, 6138.
|
|
|
(g) Sun Y.-L.; Wei Y.; Shi M. ChemCatChem 2017, 9, 718.
|
|
|
(h) Nguyen T.N.; Chen P.-A.; Setthakarn K.; May J.A. Molecules 2018, 23, 2317.
|
|
| [4] |
(a) Adolfsson H. Angew. Chem., Int. Ed. 2005, 44, 3340.
|
|
(b) Ouellet S.G.; Walji A.M.; MacMillan D.W.C. Acc. Chem. Res. 2007, 40, 1327.
|
|
|
(c) Connon S.J. Org. Biomol. Chem. 2007, 5, 3407.
|
|
|
(d) Wang Z.; Jiang Z. Asian J. Chem. 2010, 22, 4141.
|
|
|
(e) de Vries, J.G.; Mršić, N. Catal. Sci. Technol. 2011, 1, 727.
|
|
|
(f) Rueping M.; Dufour J.; Schoepke F.R. Green Chem. 2011, 13, 1084.
|
|
|
(g) Phillips A.M.F.; Pombeiro A.J.L. Org. Biomol. Chem. 2017, 15, 2307.
|
|
| [5] |
(a) Wirth T. Hypervalent Iodine Chemistry in Topics in Current Chemistry, Vol.373, Springer, Switzerland, 2016.
|
|
(b) Zhdankin V.V.; Stang P.J. Chem. Rev. 2002, 102, 2523.
|
|
|
(c) Wirth T. Angew. Chem., Int. Ed. 2005, 44, 3656.
|
|
|
(d) Uyanik M.; Ishihara K. Chem. Commun. 2009, 2086.
|
|
|
(e) Merritt E.A.; Olofsson B. Angew. Chem., Int. Ed. 2009, 48, 9052.
|
|
|
(f) Zhdankin V.V. J. Org. Chem. 20 11, 76, 1185.
|
|
|
(g) González D.F.; Benfatti F.; Waser J. ChemCatChem 2012, 4, 955.
|
|
|
Singh F.V.; Wirth T. Synthesis 2013, 45, 2499.
|
|
|
(i) Zheng Z.S.; Zhang-Negrerie D.; Du Y.F.; Zhao K. Sci. China :Chem. 2014, 57, 189.
|
|
|
(j) Yoshimura A.; Zhdankin V.V. Chem. Rev. 2016, 116, 3328.
|
|
|
(k) Yoshimura A.; Yusubov M.S.; Zhdankin V.V. Org. Biomol. Chem. 2016, 14, 4771.
|
|
|
(l) Zhang H.; Tang R.; Wu J.; Hu Y. Chemistry 2018, 681.
|
|
|
( 张怀远, 唐蓉萍, 伍家卫, 胡雨来, 化学通报, 2018, 681.).
|
|
|
(m) Reddy Kandimalla, S.; Prathima Parvathaneni, S.; Sabitha, G.; Subba Reddy, B.V. Eur. J. Org. Chem. 2019, 1687.
|
|
|
(n) Parra A. Chem. Rev. 2019, 119, 12033.
|
|
|
(o) Zhang H.; Tang R.; Shi X.; Xie L.; Wu J. Chin. J. Org. Chem. 2019, 39, 1837.
|
|
|
( 张怀远, 唐蓉萍, 石星丽, 颉林, 伍家卫, 有机化学, 2019, 39, 1837.).
|
|
|
(p) Cai Q.; Ma H. Acta Chim. Sinica 2019, 77, 213.
|
|
|
( 蔡倩, 马浩文, 化学学报, 2019, 77, 213.).
|
|
|
(q) Liu D.; He J.; Zhang C. Univ. Chem. 2019, 34, 1.
|
|
|
( 刘丹, 贺家豪, 张弛, 大学化学, 2019, 34, 1.).
|
|
| [6] |
(a) Imamoto T.; Koto H. Chem. Lett. 1986, 15, 967.
|
|
(b) Ray III, D.G.; Koser, G.F. J. Am. Chem. Soc. 1990, 112, 5672.
|
|
|
(c) Xia M.; Chen Z.-C. Synth. Commun. 1997, 27, 1315.
|
|
|
(d) Tohma H.; Takizawa S.; Watanabe H.; Fukuoka Y.; Maegawa T.; Kita Y. J. Org. Chem. 1999, 64, 3519.
|
|
|
(e) Ladziata U.; Carlson J.; Zhdankin V.V. Tetrahedron Lett. 2006, 47, 6301.
|
|
| [7] |
(a) Ochiai M.; Kitagawa Y.; Takayama N.; Takaoka Y.; Shiro M. J. Am. Chem. Soc. 1999, 121, 9233.
|
|
(b) Companys S.; Peixoto P.A.; Bosset C.; Chassaing S.; Miqueu K.; Sotiropoulos J.-M.; Pouységu L.; Quideau S. Chem. -Eur. J. 2017, 23, 13309.
|
|
| [8] |
(a) Yu J.; Cui J.; Hou X.-S.; Liu S.-S.; Gao W.-C.; Jiang S.; Tian J.; Zhang C. Tetrahedron :Asymmetry 2011, 22, 2039.
|
|
(b) Mizar P.; Wirth T. Angew. Chem., Int. Ed. 2 014, 53, 5993.
|
|
|
(c) Suzuki S.; Kamo T.; Fukushi K.; Hiramatsu T.; Tokunaga E.; Dohi T.; Kita Y.; Shibata N. Chem. Sci. 2014, 5, 2754.
|
|
|
Brenet S.; Minozzi C.; Clarens B.; Amiri L.; Berthiol F. Synthesis 2015, 47, 3859.
|
|
|
(e) Basdevant B.; Legault C.Y. Org. Lett. 2015, 17, 4918.
|
|
|
(f) Cao Y.; Zhang X.; Lin G.; Zhang-Negrerie D.; Du Y. Org. Lett. 2016, 18, 5580.
|
|
|
(g) Pluta R.; Krach P.E.; Cavallo L.; Falivene L.; Rueping M. ACS Catal. 2018, 8, 2582.
|
|
|
(h) Wang Y.; Yuan H.; Lu H.; Zheng W.-H. Org. Lett. 2018, 20, 2555.
|
|
| [9] |
(a) Dohi T.; Maruyama A.; Takenaga N.; Senami K.; Minamitsuji Y.; Fujioka H.; Caemmerer S.B.; Kita Y. Angew. Chem., Int. Ed. 2008, 47, 3787.
|
|
(b) Dohi T.; Takenaga N.; Nakae T.; Toyoda Y.; Yamasaki Y.; Shiro M.; Fujioka H.; Maruyama A.; Kita Y. J. Am. Chem. Soc. 2013, 135, 4558.
|
|
|
(c) Uyanik M.; Yasui T.; Ishihara K. Angew. Chem., Int. Ed. 2013, 52, 9215.
|
|
|
(d) Bosset C.; Coffinier R.; Peixoto P.A.; El Assal M.; Miqueu K.; Sotiropoulos J.M.; Pouységu L.; Quideau S. Angew. Chem., Int. Ed. 2014, 53, 9860.
|
|
|
(e) Uyanik M.; Sasakura N.; Mizuno M.; Ishihara K. ACS Catal. 2017, 7, 872.
|
|
|
(f) Dohi T.; Sasa H.; Miyazaki K.; Fujitake M.; Takenaga N.; Kita Y. J. Org. Chem. 2017, 82, 11954.
|
|
|
(g) Hashimoto T.; Shimazaki Y.; Omatsu Y.; Maruoka K. Angew. Chem., Int. Ed. 2018, 57, 7200.
|
|
|
(h) Antien K.; Pouységu L.; Deffieux D.; Massip S.; Peixoto P.A.; Quideau S. Chem. -Eur. J. 2019, 25, 2852.
|
|
| [10] |
Malmedy F.; Wirth T. Chem. -Eur. J. 2016, 22, 16072.
|
| [11] |
(a) Castellanos, A; Fletcher, S.P.Chem. -Eur. J. 2011, 17, 5766.
|
|
(b) Verendel J.J.; Pàmies O.; Diéguez M.; Andersson P.G. Chem. Rev. 2014, 114, 2130.
|
|
|
(c) Coombs J.R.; Morken J.P. Angew. Chem., Int. Ed. 2016, 55, 2636.
|
|
|
(d) Margarita C.; Andersson P.G. J. Am. Chem. Soc. 2017, 139, 1346.
|
|
|
(e) Kraft S.; Ryan K.; Kargbo R.B. J. Am. Chem. Soc. 2017, 139, 11630.
|
|
|
(f) Fu X.; Zhao W. Chin. J. Org. Chem. 2019, 39, 625.
|
|
|
( 付晓飞, 赵文献, 有机化学, 2019, 39, 625.).
|
|
| [12] |
Wirth T.; Hirt U.H. Tetrahedron : Asymmetry 1997, 8, 23.
|
| [13] |
Hirt U.H.; Spingler B.; Wirth T. J. Org. Chem. 1998, 63, 7674.
|
| [14] |
Hirt U.H.; Schuster M.F.H.; French A.N.; Wiest O.G.; Wirth T. Eur. J. Org. Chem. 20 01, 1569.
|
| [15] |
Koposov A.Y.; Boyarskikh V.V.; Zhdankin V.V. Org. Lett. 2004, 6, 3613.
|
| [16] |
(a) Ngatimin M.; Gartshore C.J.; Kindler J.P.; Naidu S.; Lupton D.W. Tetrahedron Lett. 2009, 50, 6008.
|
|
(b) Boppisetti J.K.; Birman V.B. Org. Lett. 2009, 11, 1221.
|
|
| [17] |
Fujita M.; Wakita M.; Sugimura T. Chem. Commun. 2 011, 47, 3983.
|
| [18] |
Shimogaki M.; Fujita M.; Sugimura T. Molecules 2015, 20, 17041.
|
| [19] |
Fujita M.; Miura K.; Sugimura T. Beilstein J. Org. Chem. 2018, 14, 659.
|
| [20] |
Röben C.; Souto J.A.; González Y.; Lishchynskyi A.; Muñiz K. Angew. Chem., Int. Ed. 2011, 50, 9478.
|
| [21] |
Röben C.; Souto J.A.; Escudero-Adán E.C.; Muñiz K. Org. Lett. 2013, 15, 1008.
|
| [22] |
Farid U.; Malmedy F.; Claveau R.; Albers L.; Wirth T. Angew. Chem., Int. Ed. 2013, 52, 7018.
|
| [23] |
Brown M.; Kumar R.; Rehbein J.; Wirth T. Chem. -Eur. J. 2016, 22, 4030.
|
| [24] |
Qurban J.; Elsherbini M.; Wirth T. J. Org. Chem. 2017, 82, 11872.
|
| [25] |
Hokamp T.; Wirth T. J. Org. Chem. 2019, 84, 8674.
|
| [26] |
Zhang D.-Y.; Zhang Y.; Wu H.; Gong L.-Z. Angew. Chem., Int. Ed. 2019, 58, 7450.
|
| [27] |
Ahmad A.; Silva Jr, L.F. J. Org. Chem. 2016, 81, 2174.
|
| [28] |
Jobin-Des Lauriers, A.; Legault, C.Y. Org. Lett. 2016, 18, 108.
|
| [29] |
Haubenreisser S.; Wöste T.H.; Martínez C.; Ishihara K.; Muñiz K. Angew. Chem., Int. Ed. 2016, 55, 413.
|
| [30] |
Wöste T.H.; Muñiz K. Synthesis 2016, 48, 816.
|
| [31] |
Molnár I.G.; Gilmour R. J. Am. Chem. Soc. 2016, 138, 5004.
|
| [32] |
Banik S.M.; Medley J.W.; Jacobsen E.N. J. Am. Chem. Soc. 2016, 138, 5000.
|
| [33] |
Haj M.K.; Banik S.M.; Jacobsen E.N. Org. Lett. 2019, 21, 4919.
|
| [34] |
Banik S.M.; Medley J.W.; Jacobsen E.N. Science 2016, 353, 51.
|
| [35] |
Muñiz K.; Barreiro L.; Romero R.M.; Martínez C. J. Am. Chem. Soc. 2017, 139, 4354.
|
| [36] |
Sreenithya A.; Hadad C.M.; Sunoj R.B. Chem. Sci. 2019, 10, 7082.
|
| [37] |
Boye A.C.; Meyer D.; Ingison C.K.; French A.N.; Wirth T. Org. Lett. 2003, 5, 2157.
|
| [38] |
Fujita M.; Okuno S.; Lee H.J.; Sugimura T.; Okuyama T. Tetrahedron Lett. 2007, 48, 8691.
|
| [39] |
Fujita M.; Lee H.J.; Sugimura T.; Okuyama T. Chem. Commun. 2007, 1139.
|
| [40] |
Fujita M.; Yoshida Y.; Miyata K.; Wakisaka A.; Sugimura T. Angew. Chem., Int. Ed. 2010, 49, 7068.
|
| [41] |
(a) Fujita M.; Mori K.; Shimogaki M.; Sugimura T. Org. Lett. 2012, 14, 1294.
|
|
(b) Shimogaki M.; Fujita M.; Sugimura T. Eur. J. Org. Chem. 2013, 7128.
|
|
| [42] |
Deng Q.-H.; Wang J.-C.; Xu Z.-J.; Zhou C.-Y.; Che C.-M. Synthesis 2011, 2959.
|
| [43] |
Farid U.; Wirth T. Angew. Chem., Int. Ed. 2012, 51, 3462.
|
| [44] |
Kong W.; Feige P.; de Haro T.; Nevado C. Angew. Chem., Int. Ed. 2013, 52, 2469.
|
| [45] |
Mizar P.; Laverny A.; El-Sherbini M.; Farid U.; Brown M.; Malmedy F.; Wirth T. Chem. -Eur. J. 2014, 20, 9910.
|
| [46] |
Alhalib A.; Kamouka S.; Moran W.J. Org. Lett. 2015, 17, 1453.
|
| [47] |
Mizar P.; Niebuhr R.; Hutchings M.; Farooq U.; Wirth T. Chem. -Eur. J. 2016, 22, 1614.
|
| [48] |
Shimogaki M.; Fujita M.; Sugimura T. Angew. Chem., Int. Ed. 2016, 55, 15797.
|
| [49] |
Shimogaki M.; Fujita M.; Sugimura T. J. Org. Chem. 2017, 82, 11836.
|
| [50] |
Woerly E.M.; Banik S.M.; Jacobsen E.N. J. Am. Chem. Soc. 2016, 138, 13858.
|
| [51] |
Geary G.C.; Hope E.G.; Stuart A.M. Angew. Chem., Int. Ed. 2015, 54, 14911.
|
| [52] |
Mennie K.M.; Banik S.M.; Reichert E.C.; Jacobsen E.N. J. Am. Chem. Soc. 2018, 140, 4797.
|
| [53] |
Gelis C.; Dumoulin A.; Bekkaye M.; Neuville L.; Masson G. Org. Lett. 2017, 19, 278.
|
| [54] |
(a) Guimarães K.G.; Dias de Souza Filho, J.; Rennó dos Mares-Guia, T.; Castro Braga, F. Phytochemistry 2008, 69, 439.
|
|
(b) Endringer D.C.; Guimarães K.G.; Kondratyuk T.P.; Pezzuto J.M.; Braga F.C. J. Nat. Prod. 2008, 71, 1082.
|
|
| [55] |
Fujita M.; Mori K.; Shimogaki M.; Sugimura T. RSC Adv. 2013, 3, 17717.
|
| [56] |
Takesue T.; Fujita M.; Sugimura T.; Akutsu H. Org. Lett. 2014, 16, 4634.
|
| [57] |
(a) Garson M.J.; Staunton J.; Jones P.G. J. Chem. Soc., Perkin Trans. 1 1984, 1021.
|
|
(b) Krohn K.; Kock I.; Elsässer B.; Flörke U.; Schulz B.; Draeger S.; Pescitelli G.; Antus S.; Kurtán T. Eur. J. Org. Chem. 2007, 1123.
|
| [1] | 李思达, 崔鑫, 舒兴中, 吴立朋. 钛催化的烯烃制备1,1-二硼化合物[J]. 有机化学, 2024, 44(2): 631-637. |
| [2] | 张剑, 梁万洁, 杨艺, 闫法超, 刘会. 联烯胺化合物的区域选择性双官能团化[J]. 有机化学, 2024, 44(2): 335-348. |
| [3] | 朱彦硕, 王红言, 舒朋华, 张克娜, 王琪琳. 烷氧自由基引发1,5-氢原子转移实现C(sp3)—H键官能团化的研究进展[J]. 有机化学, 2024, 44(1): 1-17. |
| [4] | 王化坤, 任晓龙, 宣宜宁. 卤盐催化的α,β-环氧羧酸酯与异氰酸酯[3+2]环加成反应研究[J]. 有机化学, 2024, 44(1): 251-258. |
| [5] | 于士航, 刘嘉威, 安碧玉, 边庆花, 王敏, 钟江春. 黑腹尼虎天牛接触性信息素的不对称合成[J]. 有机化学, 2024, 44(1): 301-308. |
| [6] | 董江湖, 宣良明, 王池, 赵晨熙, 王海峰, 严琼姣, 汪伟, 陈芬儿. 无过渡金属或无光催化剂条件下可见光促进喹喔啉酮C(3)—H官能团化研究进展[J]. 有机化学, 2024, 44(1): 111-136. |
| [7] | 张建涛, 张聪, 莫诺琳, 罗佳婷, 陈莲芬, 刘卫兵. 氯仿参与的烯烃自由基加成反应的研究进展[J]. 有机化学, 2023, 43(9): 3098-3106. |
| [8] | 王玉超, 刘晋彪, 何智涛. 钯催化共轭二烯的不对称氢官能团化[J]. 有机化学, 2023, 43(8): 2614-2627. |
| [9] | 刘颖杰, 石岗庆, 仇格, 张鑫, 宋冬雪, 陈宁, 于淼, 许颖. 光/电催化醚α-位官能团化研究进展[J]. 有机化学, 2023, 43(8): 2664-2681. |
| [10] | 许晓萍, 张翼飞, 莫小渝, 江俊. 铑催化3-重氮吲哚-2-亚胺与吡唑啉酮的C—H官能团化反应制备3-吡唑基吲哚[J]. 有机化学, 2023, 43(7): 2519-2527. |
| [11] | 宋亭谕, 李冉, 黄利华, 贾世琨, 梅光建. N—N单键阻转异构体的催化不对称合成[J]. 有机化学, 2023, 43(6): 1977-1990. |
| [12] | 罗诚, 尹艳丽, 江智勇. P-手性膦氧化物的不对称合成研究进展[J]. 有机化学, 2023, 43(6): 1963-1976. |
| [13] | 陆晓雨, 孙晓梅, 钮亚琴, 王俊超, 殷文婧, 高梦婷, 刘孜, 韦正桓, 陶庭骅. 铜催化氟代丙烯酸与氧杂吖丙啶的脱羧交叉偶联反应[J]. 有机化学, 2023, 43(6): 2110-2119. |
| [14] | 卢凯, 屈浩琦, 陈樨, 秋慧, 郑晶, 马猛涛. 无催化剂、无溶剂条件下炔烃和烯烃与儿茶酚硼烷的硼氢化反应[J]. 有机化学, 2023, 43(6): 2197-2205. |
| [15] | 李思达, 舒兴中, 吴立朋. 锆、钛介导的烯烃、炔烃硼氢化[J]. 有机化学, 2023, 43(5): 1751-1760. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||