有机化学 ›› 2021, Vol. 41 ›› Issue (1): 80-93.DOI: 10.6023/cjoc202007013 上一篇 下一篇
综述与进展
收稿日期:2020-07-04
修回日期:2020-08-14
发布日期:2020-09-09
通讯作者:
席婵娟
作者简介:基金资助:
Yaping Yia, Wei Hanga, Chanjuan Xia,b,*( )
)
Received:2020-07-04
Revised:2020-08-14
Published:2020-09-09
Contact:
Chanjuan Xi
Supported by:文章分享

二氧化碳(CO 2)作为一碳合成子具有储量丰富、无毒无污染、绿色清洁等优点, 因此在有机化学领域使用CO 2作为一碳合成子反应一直以来受到广泛的关注. 过渡金属催化不饱和烃与CO 2反应合成羧酸是CO 2作为一碳合成子的重要应用之一, 这类反应可以通过串联羧化的策略实现, 过渡金属催化不饱和烃先与有机金属试剂反应在原位生成新的有机金属试剂, 之后再与CO 2完成羧化. 常用的有机金属试剂如格氏试剂、有机锌试剂和有机铝试剂均能够完成这类反应. 根据不饱和烃的类别, 并根据羧化反应的类型介绍过渡金属催化不饱和烃与有机金属试剂及CO 2的串联羧化反应.
易雅平, 杭炜, 席婵娟. 过渡金属催化不饱和烃与有机金属试剂及CO 2的串联羧化反应研究进展[J]. 有机化学, 2021, 41(1): 80-93.
Yaping Yi, Wei Hang, Chanjuan Xi. Recent Advance of Transition-Metal-Catalyzed Tandem Carboxylation Reaction of Unsaturated Hydrocarbons with Organometallic Reagents and CO2[J]. Chinese Journal of Organic Chemistry, 2021, 41(1): 80-93.
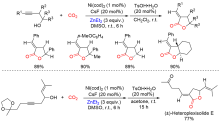
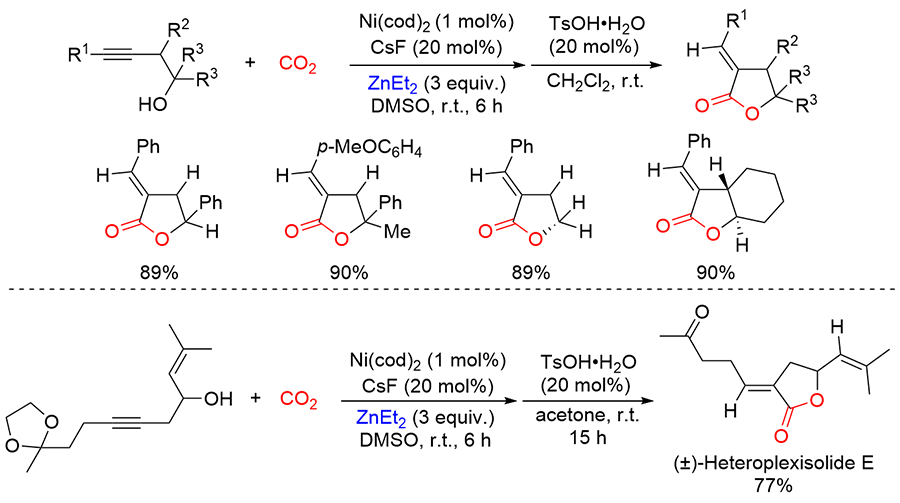


| [1] |
Wuebbles D.J.; Easterling D.R.; Hayhoe K.; Knutson T.; Kopp R.E.; Kossin J.P.; Kunkel K.E.; LeGrande A.N.; Mears C.; Sweet W.V.; Taylor P.C.; Vose R.S.; Wehner M.F. InClimate Science Special Report :Fourth National Climate Assessment, Vol. I , 2017, pp. 35~72.
|
| [2] |
(a) Tortajada A.; Juliá-Hernández F.; Börjesson M.; Moragas T.; Martin R. Angew. Chem, Int. Ed. 2018, 57, 15948.
|
|
(b) Wang S.; Xi C. Chem. Soc. Rev. 2019, 48, 382.
|
|
|
(c) Wang Q.; Sun J. Chem. Bull. 2018, 81, 312.
|
|
|
( 王强, 孙京, 化学通报, 2018, 81, 312.).
|
|
|
(d) Zhang Y.; Cen J.; Xiong W.; Qi Z.; Jiang H. Prog. Chem. 2018, 30, 547.
|
|
|
( 张宇, 岑竞鹤, 熊文芳, 戚朝荣, 江焕峰, 化学进展, 2018, 30, 547.).
|
|
|
(e) Zhang Z.; Gong L.; Zhou X.-Y.; Yan S.-S.; Li J.; Yu D.-G. Acta Chim. Sinica 2019, 77, 783.
|
|
|
( 张振, 龚莉, 周晓渝, 颜思顺, 李静, 余达刚, 化学学报, 2019, 77, 783.).
|
|
|
(f) Chen K.-H.; Li H.-R.; He L.-N. Chin. J. Org. Chem. 2020, 40, 2195.
|
|
|
( 陈凯宏, 李红茹, 何良年, 有机化学, 2020, 40, 2195 . ).
|
|
|
(g) Zhou C.; Li M.; Yu J.-T.; Sun S.; Cheng J. Chin. J. Org. Chem. 2020, 40, 2221.
|
|
|
( 周聪, 李渺, 于金涛, 孙松, 成江, 有机化学, 2020, 40, 2221.).
|
|
| [3] |
(a) Yan S.-S.; Fu Q.; Liao L.-L.; Sun G.-Q.; Ye J.-H.; Gong L.; Bo-Xue Y.-Z.; Yu D.-G. Coord. Chem. Rev. 2018, 374, 439.
|
|
(b) Zhang L.; Hou Z. Curr. Opin. Green Sust. Chem. 2017, 3, 17.
|
|
| [4] |
Lapidus A.L.; Pirozhkov S.D.; Koryakin A.A. Russ. Chem. Bull. 1978, 27, 2513.
|
| [5] |
Cohen S.A.; Bercaw J.E. Organometallics 1985, 4, 1006.
|
| [6] |
Alt H.G.; Denner C.E. J. Organomet. Chem. 1990, 390, 53.
|
| [7] |
Hoberg H.; Schaefer D. J. Organomet. Chem. 1982, 236, C28.
|
| [8] |
Hoberg H.; Schaefer D. J. Organomet. Chem. 1 983, 251, C51.
|
| [9] |
Williams C.M.; Johnson J.B.; Rovis T. J. Am. Chem. Soc. 2008, 130, 14936.
|
| [10] |
Shirakawa E.; Ikeda D.; Masui S.; Yoshida M.; Hayashi T. J. Am. Chem. Soc. 2012, 134, 272.
|
| [11] |
Greenhalgh M.D.; Thomas S.P. J. Am. Chem. Soc. 2012, 134, 11900.
|
| [12] |
Shao P.; Wang S.; Chen C.; Xi C. Org. Lett. 2 016, 18, 2050.
|
| [13] |
Finkbeiner H.L.; Cooper G.D. J. Org. Chem. 1962, 27, 3395.
|
| [14] |
Sato F. J. Organomet. Chem. 1985, 285, 53.
|
| [15] |
Shao P.; Wang S.; Chen C.; Xi C. Chem. Commun. 2015, 51, 6640.
|
| [16] |
Hoveyda A.H.; Xu Z. J. Am. Chem. Soc. 1991, 113, 5079.
|
| [17] |
Takahashi T.; Seki T.; Nitto Y.; Saburi M.; Rousset C.J.; Negishi E. J. Am. Chem. Soc. 1991, 113, 6266.
|
| [18] |
(a) Takaya J.; Iwasawa N. J. Am. Chem. Soc. 2008, 130, 15254.
|
|
(b) Tayaka J.; Sasano K.; Iwasawa N. Org. Lett. 2011, 13, 1698.
|
|
| [19] |
Li S.; Miao B.; Yuan W.; Ma S. Org. Lett. 2013, 15, 977.
|
| [20] |
Gholap S.S.; Takimoto M.; Hou Z. Chem.-Eur. J. 2016, 22, 8547.
|
| [21] |
Nii S.; Terao J.; Kambe N. J. Org. Chem. 2000, 65, 5291.
|
| [22] |
Nii S.; Terao J.; Kambe N. J. Org. Chem. 2004, 69, 573.
|
| [23] |
Hang W.; Zou S.; Xi C. ChemCatChem 2019, 11, 3814.
|
| [24] |
Li S.; Yuan W.; Ma S. Angew. Chem., Int. Ed. 2011, 50, 2578.
|
| [25] |
Li S.; Ma S. Chem. Asian J. 2012, 7, 2411.
|
| [26] |
Miao B.; Zheng Y.; Wu P.; Li S.; Ma S. Adv. Synth. Catal. 2017, 359, 1691.
|
| [27] |
Cao T.; Ma S. Org. Lett. 2016, 18, 1510.
|
| [28] |
Santhoshkumar R.; Hong Y.-C.; Luo C.-Z.; Wu Y.-C.; Hung C.-H.; Hwang K.-Y.; Tu A.-P.; Cheng, C-H. ChemCatChem 2016, 8, 2210.
|
| [29] |
Shao P.; Wang S.; Du G.; Xi C. RSC Adv. 2017, 7, 3534.
|
| [30] |
Li S.; Ma S. Org. Lett. 2011, 13, 6046.
|
| [31] |
Takimoto M.; Hou Z. Chem.-Eur. J. 2013, 19, 11439.
|
| [32] |
Wang S.; Xi C. Org. Lett. 2018, 20, 4131.
|
| [33] |
Xue F.; Zhao J.; Hor T.S. Chem. Commun. 2013, 49, 10121.
|
| [34] |
Xue F.; Zhao J.; Hor T.S.; Hayashi T. J. Am. Chem. Soc. 2015, 137, 3189.
|
| [35] |
Wu B.; Chopra R.; Yoshikai N. Org. Lett. 2 015, 17, 5666.
|
| [36] |
Cao T.; Yang Z.; Ma S. ACS Catal. 2017, 7, 4504.
|
| [37] |
Diccianni J.B.; Heitmann T.; Diao T. J. Org. Chem. 2017, 82, 6895.
|
| [1] | 赵红琼, 于淼, 宋冬雪, 贾琦, 刘颖杰, 季宇彬, 许颖. 羧酸脱羧羟基化反应研究进展[J]. 有机化学, 2024, 44(1): 70-84. |
| [2] | 高晓阳, 翟锐锐, 陈训, 王烁今. 碳酸亚乙烯酯参与C—H键活化反应的研究进展[J]. 有机化学, 2023, 43(9): 3119-3134. |
| [3] | 廖旭, 王泽宇, 唐武飞, 林金清. 多孔有机聚合物用于化学固定二氧化碳的研究进展[J]. 有机化学, 2023, 43(8): 2699-2710. |
| [4] | 刘露, 张曙光, 胡仁威, 赵晓晓, 崔京南, 贡卫涛. 基于多羟基柱[5]芳烃的酚醛多孔聚合物合成及CO2催化转化[J]. 有机化学, 2023, 43(8): 2808-2814. |
| [5] | 陈新强, 张敬. 伯醇的脱羟甲基反应的研究进展[J]. 有机化学, 2023, 43(8): 2711-2719. |
| [6] | 户晓兢, 郭斐翔, 朱润青, 周柄棋, 张涛, 房立真. 对烷氧基酚的合成及其去芳构化后的合成应用[J]. 有机化学, 2023, 43(6): 2239-2244. |
| [7] | 宋姿洁, 刘俊, 白赢, 厉嘉云, 彭家建. 利用硅氢加成反应催化转化二氧化碳研究进展[J]. 有机化学, 2023, 43(6): 2068-2080. |
| [8] | 徐光利, 许静, 徐海东, 崔香, 舒兴中. 过渡金属催化烯烃和炔烃合成1,3-共轭二烯化合物研究进展[J]. 有机化学, 2023, 43(6): 1899-1933. |
| [9] | 庞明杨, 常宏宏, 冯璋, 张娟. 过渡金属催化吲哚的串联去芳构化反应研究进展[J]. 有机化学, 2023, 43(4): 1271-1291. |
| [10] | 潘永周, 蒙秀金, 王迎春, 何慕雪. 电化学固定CO2构建羧酸衍生物的研究进展[J]. 有机化学, 2023, 43(4): 1416-1434. |
| [11] | 吴孔川, 卢铠洪, 林建斌, 张慧君. 莱啉酰亚胺类化合物的邻位C—H键功能化研究进展[J]. 有机化学, 2023, 43(3): 1000-1011. |
| [12] | 蒙玲, 汪君. 硫代黄烷酮类衍生物的合成研究进展[J]. 有机化学, 2023, 43(3): 873-891. |
| [13] | 段康慧, 唐俊龙, 伍婉卿. 稠杂环化合物的合成及其抗肿瘤活性研究进展[J]. 有机化学, 2023, 43(3): 826-854. |
| [14] | 贾海瑞, 邱早早. 过渡金属催化硼-氢键活化合成含硼-杂原子键邻碳硼烷衍生物的研究进展[J]. 有机化学, 2023, 43(3): 1045-1068. |
| [15] | 刘桂杰, 付正强, 陈飞, 徐彩霞, 李敏, 刘宁. N-杂环卡宾-吡啶锰配合物/四丁基碘化铵催化CO2和环氧化物合成环状碳酸酯[J]. 有机化学, 2023, 43(2): 629-635. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||