有机化学 ›› 2022, Vol. 42 ›› Issue (7): 2155-2163.DOI: 10.6023/cjoc202201036 上一篇 下一篇
研究论文
陈学荣a, 祁亮a, 黄晋培a, 朱伟伟b,*( ), 周益峰a,*(
), 周益峰a,*( )
)
收稿日期:2022-01-22
修回日期:2022-02-17
发布日期:2022-08-09
通讯作者:
朱伟伟, 周益峰
作者简介:基金资助:
Xuerong Chena, Liang Qia, Jinpei Huanga, Weiwei Zhub( ), Yifeng Zhoua(
), Yifeng Zhoua( )
)
Received:2022-01-22
Revised:2022-02-17
Published:2022-08-09
Contact:
Weiwei Zhu, Yifeng Zhou
About author:Supported by:文章分享
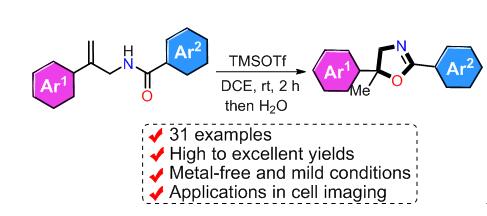
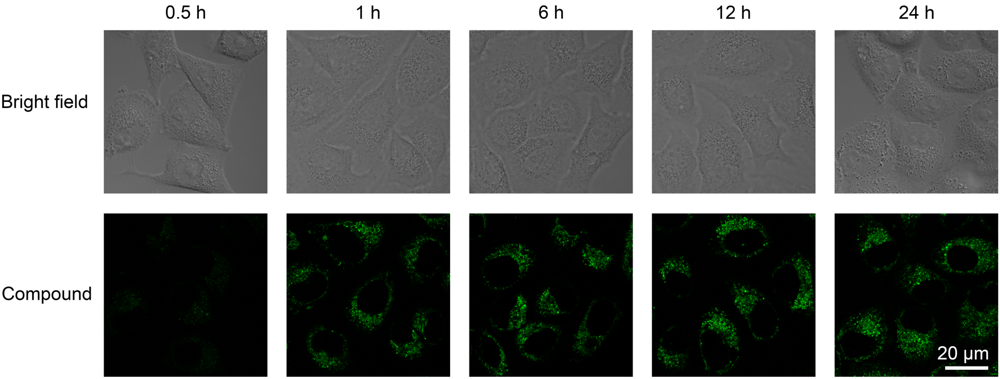
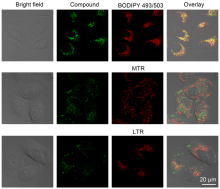
2-噁唑啉及其衍生物是有机合成、材料化学和生物医药中重要的有机结构单元. 报道了一种高效、反应条件温和且无金属参与的路易斯酸促进的分子内亲核杂环化反应合成2-噁唑啉衍生物的方法(80%~94%分离产率), 并将合成得到的噁唑啉衍生物用于细胞成像研究, 结果表明, 合成的噁唑啉衍生物在细胞成像实验中表现出了良好的细胞相容性和成像性.
陈学荣, 祁亮, 黄晋培, 朱伟伟, 周益峰. 路易斯酸促进的不饱和酰胺的分子内亲核加成杂环化反应合成2-噁唑啉衍生物及其在细胞成像中的应用[J]. 有机化学, 2022, 42(7): 2155-2163.
Xuerong Chen, Liang Qi, Jinpei Huang, Weiwei Zhu, Yifeng Zhou. Lewis Acid Promoted Intramolecular Nucleophilic Heterocyclization of Unsaturated Amides for the Synthesis of 2-Oxazolines and Their Applications in Imaging of Living Cells[J]. Chinese Journal of Organic Chemistry, 2022, 42(7): 2155-2163.
| Entry | LAb | Solvent | Temperature/℃ | Yieldc/% |
|---|---|---|---|---|
| 1 | BF3•Et2O | DCM | 0 | 12 |
| 2 | BF3•Et2O | DCM | 25 | 65 |
| 3 | TFA | DCM | 25 | 0 |
| 4 | AcOH | DCM | 25 | 0 |
| 5 | MsOH | DCM | 25 | 0 |
| 6 | FeCl3 | DCM | 25 | 0 |
| 7 | ZnCl2 | DCM | 25 | 0 |
| 8 | MeOTf | DCM | 25 | 0 |
| 9 | TMSOTf | DCM | 25 | 85 |
| 10 | TMSOTf | MeCN | 25 | 82 |
| 11 | TMSOTf | C6H5Cl | 25 | 79 |
| 12 | TMSOTf | CHCl3 | 25 | 77 |
| 13 | TMSOTf | DCE | 25 | 94 |
| 14 | TMSOTf | DMF | 25 | Trace |
| 15d | TMSOTf | DCE | 25 | Trace |
| Entry | LAb | Solvent | Temperature/℃ | Yieldc/% |
|---|---|---|---|---|
| 1 | BF3•Et2O | DCM | 0 | 12 |
| 2 | BF3•Et2O | DCM | 25 | 65 |
| 3 | TFA | DCM | 25 | 0 |
| 4 | AcOH | DCM | 25 | 0 |
| 5 | MsOH | DCM | 25 | 0 |
| 6 | FeCl3 | DCM | 25 | 0 |
| 7 | ZnCl2 | DCM | 25 | 0 |
| 8 | MeOTf | DCM | 25 | 0 |
| 9 | TMSOTf | DCM | 25 | 85 |
| 10 | TMSOTf | MeCN | 25 | 82 |
| 11 | TMSOTf | C6H5Cl | 25 | 79 |
| 12 | TMSOTf | CHCl3 | 25 | 77 |
| 13 | TMSOTf | DCE | 25 | 94 |
| 14 | TMSOTf | DMF | 25 | Trace |
| 15d | TMSOTf | DCE | 25 | Trace |

| [1] |
(a) Taylor, A. P.; Robinson, R. P.; Fobian, Y. M.; Blakemore, D. C.; Jones, L. H.; Fadeyi, O. Org. Biomol. Chem. 2016, 14, 6611.
doi: 10.1039/C6OB00936K pmid: 5723975 |
|
(b) Pawlowski, R.; Stanek, F.; Stodulski, M. Molecules 2019, 24, 1533.
doi: 10.3390/molecules24081533 pmid: 5723975 |
|
|
(c) Luo, Y.; Li, B.; Wang, W.; Wu, K.; Tan, B. Adv. Mater. 2012, 24, 5703.
doi: 10.1002/adma.201202447 pmid: 5723975 |
|
|
(d) Ryu, D.; Mouchiroud, L.; Andreux, P. A.; Katsyuba, E.; Moullan, N.; Felix, A. A. N.; Williams, E. G.; Jha, P.; Lo Sasso, G.; Huzard, D.; Aebischer, P.; Sandi, C.; Rinsch, C.; Auwerx, J. Nat. Med. 2016, 22, 879.
doi: 10.1038/nm.4132 pmid: 5723975 |
|
|
(e) Gandini, A.; Lacerda, T. M.; Carvalho, A. J. F.; Trovatti, E. Chem. Rev. 2016, 116, 1637.
doi: 10.1021/acs.chemrev.5b00264 pmid: 5723975 |
|
|
(f) Rodrigues, T.; Reker, D.; Schneider, P.; Schneider, G. Nat. Chem. 2016, 8, 531.
doi: 10.1038/nchem.2479 pmid: 5723975 |
|
|
(g) Boiani, M.; González, M. Mini Rev. Med. Chem. 2005, 5, 409.
doi: 10.2174/1389557053544047 pmid: 5723975 |
|
|
(h) Bignan, G. C.; Battista, K.; Connolly, P. J.; Orsini, M. J.; Liu, J.; Middleton, S. A.; Reitz, A. B. Bioorg. Med. Chem. Lett. 2005, 15, 5022.
doi: 10.1016/j.bmcl.2005.08.009 pmid: 5723975 |
|
|
(i) Yurchenko, R. I.; Ponomarenko, A. D.; Svarovskaya, N. N. Chem. Heterocycl. Compd. 2005, 41, 656.
doi: 10.1007/s10593-005-0198-0 pmid: 5723975 |
|
|
(j) Hecker, E. Cancer Res. 1968, 28, 2338.
pmid: 5723975 |
|
|
(k) Patil, S. A.; Patil, S. A.; Patil, R.; Keri, R. S.; Budagumpi, S.; Balakrishna, G. R.; Tacke, M. Future Med. Chem. 2015, 7, 1305.
doi: 10.4155/fmc.15.61 pmid: 5723975 |
|
|
(l) Yang, B.; Zhao, M.; Fang, X.; Yang, X. Y.; Wu, H. F. Chin. J. Org. Chem. 2013, 33, 1088. (in Chinese)
doi: 10.6023/cjoc201210034 pmid: 5723975 |
|
|
( 杨波, 赵敏, 方向, 杨雪艳, 吴范宏, 有机化学, 2013, 33, 1088.)
doi: 10.6023/cjoc201210034 pmid: 5723975 |
|
| [2] |
(a) Kawai, H.; Shibata, N. Chem. Rec. 2014, 14, 1024.
doi: 10.1002/tcr.201402023 pmid: 19378971 |
|
(b) Hargaden, G. C.; Guiry, P. J. Chem. Rev. 2009, 109, 2505.
doi: 10.1021/cr800400z pmid: 19378971 |
|
|
(c) Li, Q.; Woods, K. W.; Claiborne, A.; Gwaltney, N. S.; Barr, K. J.; Liu, G.; Gehrke, L.; Credo, R. B.; Hui, Y. H.; Lee, J. Bioorg. Med. Chem. Lett. 2010, 33, 465.
pmid: 19378971 |
|
|
(d) Dahiya, S.; Dahiya, R. Eur. J. Med. Chem. 2021, 218, 113406.
doi: 10.1016/j.ejmech.2021.113406 pmid: 19378971 |
|
|
(e) Moraski, G. C.; Chang, M.; Estrada, A. V.; Franzblau, S. G.; Möllmann, U.; Miller, M. J. Eur. J. Med. Chem. 2010, 45, 1703.
doi: 10.1016/j.ejmech.2009.12.074 pmid: 19378971 |
|
| [3] |
(a) Verbraeken, B.; Hullaert, J.; Guyse, J. V.; Hecke, K. V.; Winne, J.; Hoogenboom, R. J. Am. Chem. Soc. 2018, 140, 17404.
doi: 10.1021/jacs.8b10918 pmid: 30501590 |
|
(b) Chiacchio, M. A.; Lanza, G.; Chiacchio, U.; Giofrè, S. V.; Romeo, R.; Iannazzo, D.; Legnani, L. Curr. Med. Chem. 2019, 26, 7337.
doi: 10.2174/0929867326666181203130402 pmid: 30501590 |
|
|
(c) Zhang, H. Z.; Zhao, Z. L.; Zhou, C. H. Eur. J. Med. Chem. 2017, 12, 044.
pmid: 30501590 |
|
| [4] |
(a) Connon, R.; Roche, B.; Rokade, B. V.; Guiry, P. J. Chem. Rev. 2021, 121, 6373.
doi: 10.1021/acs.chemrev.0c00844 pmid: 12007099 |
|
(b) Rao, B. V.; Bhaskar, G.; Kumar, V. S. Tetrahedron: Asymmetry 2004, 15, 1279.
pmid: 12007099 |
|
|
(c) Thorhauge, J.; Roberson, M.; Hazell, R. G.; Jørgensen, K. A. Chem.-Eur. J. 2002, 8, 1888.
pmid: 12007099 |
|
| [5] |
(a) Hayes, G.; Drain, B.; Becer, R. Macromolecules 2022, 55, 146.
doi: 10.1021/acs.macromol.1c02245 |
|
(b) Trachsel, L.; Wong, M. Z.; Benetti, E. M. Biomater. Sci. 2021, 9, 2874.
doi: 10.1039/D0BM02217A |
|
|
(c) Sedlacek, O.; Monnery, B. D.; Filippov, S. K.; Hoogenboom, R.; Hruby, M. Macromol. Rapid Commun. 2012, 33, 1648.
doi: 10.1002/marc.201200453 |
|
|
(d) Simon, L.; Marcotte, N.; Devoisselle, J. M.; Begu, S.; Lapinte, V. Int. J. Pharm. 2020, 585, 119536.
doi: 10.1016/j.ijpharm.2020.119536 |
|
|
(e) Luxenhofer, R.; Han, Y. C.; Schulz, A.; Tong, J.; He, Z.J.; Kabanov, A. V.; Jordan, R. Macromol. Rapid Commun. 2012, 33, 1613.
doi: 10.1002/marc.201200354 |
|
| [6] |
(a) Helmut, W.; Wolfgang, S. Angew. Chem., Int. Ed. 1972, 11, 287.
pmid: 25742052 |
|
(b) Alhalib, A.; Kamouka, S.; Moran, W. J. Org. Lett. 2015, 17, 1453.
doi: 10.1021/acs.orglett.5b00333 pmid: 25742052 |
|
|
(c) Li, B.; Wang, S. Q.; Liu, B.; Shi, B. F. Org. Lett. 2015, 17, 1200.
doi: 10.1021/acs.orglett.5b00151 pmid: 25742052 |
|
|
(d) Liu, G. Q.; Yang, C. H.; Li, Y. M. J. Org. Chem. 2015, 80, 11339.
doi: 10.1021/acs.joc.5b01832 pmid: 25742052 |
|
| [7] |
(a) Mulahmetovic, E.; Hargaden, G. C. Mini Rev. Org. Chem. 2019, 16, 507.
doi: 10.2174/1570193X15666180802105505 |
|
(b) Ilkgul, B.; Gunes, D.; Sirkecioglu, O.; Bicak, N. Tetrahedron Lett. 2010, 51, 5313.
doi: 10.1016/j.tetlet.2010.07.167 |
|
|
(c) Goud, D. R.; Pathak, U. Synthesis 2012, 44, 3678.
doi: 10.1055/s-0032-1317341 |
|
|
(d) Brandstätter, M.; Roth, F.; Luedtke, N. W. J. Org. Chem. 2015, 80, 40.
doi: 10.1021/jo5016695 |
|
|
(e) Chen, Z. G.; Hou, D.; Liu, D. E.; Hui, W. P. Chin. J. Org. Chem. 2016, 36, 2191. (in Chinese)
doi: 10.6023/cjoc201603032 |
|
|
( 陈战国, 侯丹, 刘德娥, 惠文萍, 有机化学, 2016, 36, 2191.)
doi: 10.6023/cjoc201603032 |
|
|
(f) Wu, F.; Kaur, N.; Alom, N. E.; Li, W. JACS Au 2021, 1, 734.
doi: 10.1021/jacsau.1c00103 |
|
| [8] |
(a) Zhou, M. N.; Delaveris, C. S.; Kramer, J. R.; Kenkel, J. A.; Engleman, E. G.; Bertozzi, C. R. Angew. Chem., Int. Ed. 2018, 57, 3137.
doi: 10.1002/anie.201713075 |
|
(b) Mizukami, S.; Hori, Y.; Kikuchi, K. Acc. Chem. Res. 2014, 47, 247.
doi: 10.1021/ar400135f |
|
|
(c) Li, B.; Zhou, X. H.; Yang, P. Y.; Zhu, L. P.; Zhong, Y.; Cai, Z. J.; Jiang, B.; Cai, X. Q.; Jiang, X. X. Adv. Sci. 2019, 6, 1802039.
doi: 10.1002/advs.201802039 |
|
| [9] |
(a) Janzen, W. P. Chem. Biol. 2014, 21, 1162.
doi: 10.1016/j.chembiol.2014.07.015 |
|
(b) Liu, L. Y.; Liu, W. T.; Wang, K. N.; Zhu, B. C.; Xia, X. Y.; Ji, L. N.; Mao, Z. W. Angew. Chem., Int. Ed. 2020, 59, 9719.
doi: 10.1002/anie.202002422 |
|
| [10] |
(a) Maity, A.; Teets, T. S. Chem. Rev. 2016, 116, 8873.
doi: 10.1021/acs.chemrev.6b00034 pmid: 27164024 |
|
(b) North, M.; Usanov, D. L.; Young, C. Chem. Rev. 2008, 108, 5146.
pmid: 27164024 |
|
|
(c) Hong, M.; Chen, J.; Chen, E. Y. X. Chem. Rev. 2018, 118, 10551.
doi: 10.1021/acs.chemrev.8b00352 pmid: 27164024 |
|
| [11] |
(a) Zhang, X.; Wan, X. T.; Cong, Y.; Zhen, X. H.; Li, Q.; Negrerie, D. Z.; Du, Y. F.; Zhao, K. J. Org. Chem. 2019, 84, 10402.
doi: 10.1021/acs.joc.9b01601 |
|
(b) Nakao, Y.; Idei, H.; Kanyiva, K. S.; Hiyama, T. J. Am. Chem. Soc. 2009, 131, 5070.
doi: 10.1021/ja901153s |
|
|
(c) An, J. K.; Liu, J. K.; Shi, Y.; Zhu, W. W.; Guo, G. Y.; Jiang, X. X.; Xue, J. J.; Zhang, H. R. Curr. Org. Chem. 2020, 24, 1263.
doi: 10.2174/1385272824999200701120327 |
|
|
(d) Gao, W. C.; Liu, T.; Zhang, B.; Li, X.; Wei, W. L.; Liu, Q.; Tian, J.; Chang, H. H. J. Org. Chem. 2016, 81, 11297.
doi: 10.1021/acs.joc.6b02271 |
|
| [12] |
Santos, F. S.; Zanotto, G. M.; Argomedo, L. M. Z.; Darben, M. P.; Goncalves, P. F. B.; Stefani, H. A.; Rodembusch, F. S. Dyes Pigm. 2019, 165, 372.
doi: 10.1016/j.dyepig.2019.02.047 |
| [1] | 刘杰, 韩峰, 李双艳, 陈天煜, 陈建辉, 徐清. 无过渡金属参与甲基杂环化合物与醇的选择性有氧烯基化反应[J]. 有机化学, 2024, 44(2): 573-583. |
| [2] | 杨维清, 葛宴兵, 陈元元, 刘萍, 付海燕, 马梦林. 1,8-萘酰亚胺衍生物的设计、合成及其对半胱氨酸的识别研究[J]. 有机化学, 2024, 44(1): 180-194. |
| [3] | 陈祖佳, 宇世伟, 周永军, 李焕清, 邱琪雯, 李妙欣, 汪朝阳. BF3•OEt2作为催化剂与合成子在有机合成中的应用进展[J]. 有机化学, 2023, 43(9): 3107-3118. |
| [4] | 陈玉琢, 孙红梅, 王亮, 胡方芝, 李帅帅. 基于α-氢迁移策略构建杂环骨架的研究进展[J]. 有机化学, 2023, 43(7): 2323-2337. |
| [5] | 李宜芳, 王耀, 牛华伟, 陈秀金, 李兆周, 王永国. 线粒体靶向的二氧化硫荧光探针研究进展[J]. 有机化学, 2023, 43(6): 1952-1962. |
| [6] | 赵洋, 陈盼盼, 李高楠, 钮智刚, 王恩举. 基于四芳基咪唑的聚集诱导发光染料及其细胞成像应用[J]. 有机化学, 2023, 43(6): 2156-2162. |
| [7] | 孔德亮, 戴闻, 赵怡玲, 陈艺林, 朱红平. 脒基胺硼基硅宾与单酮和二酮的氧化环加成反应研究[J]. 有机化学, 2023, 43(5): 1843-1851. |
| [8] | 蒙玲, 汪君. 硫代黄烷酮类衍生物的合成研究进展[J]. 有机化学, 2023, 43(3): 873-891. |
| [9] | 段康慧, 唐俊龙, 伍婉卿. 稠杂环化合物的合成及其抗肿瘤活性研究进展[J]. 有机化学, 2023, 43(3): 826-854. |
| [10] | 曹伟地, 刘小华. 不对称催化质子化构建α-叔碳羰基化合物研究进展[J]. 有机化学, 2023, 43(3): 961-973. |
| [11] | 肖丽娟, 张艳平, 洪缪. 路易斯酸碱对在材料化学应用中的研究进展[J]. 有机化学, 2023, 43(3): 949-960. |
| [12] | 唐宏伟, 王超, 钟克利, 侯淑华, 汤立军, 边延江. 一种裸眼和荧光双通道快速检测Hg2+的探针及其多种应用[J]. 有机化学, 2023, 43(2): 712-717. |
| [13] | 郝二军, 丁笑波, 王珂新, 周红昊, 杨启亮, 石磊. 氮杂环丙烷与不饱和化合物发生[3+2]扩环反应的研究进展[J]. 有机化学, 2023, 43(12): 4057-4074. |
| [14] | 冯向青, 杜海峰. B(C6F5)3催化不饱和烃的硅化反应[J]. 有机化学, 2023, 43(10): 3544-3557. |
| [15] | 刘梦, 黄延茹, 孙小飞, 汤立军. 一种基于“聚集诱导发光+激发态分子内质子转移”机制的苯并噻唑衍生物荧光探针及其对次氯酸根的识别[J]. 有机化学, 2023, 43(1): 345-351. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||